Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna

Chemia organiczna
Zawarty w tej części materiał nie stanowi podstawowego kursu chemii organicznej. Prezentowane tutaj treści dotyczą wybranych zagadnień tego działu chemii i jako takie są uzupełnieniem materiału z jakim stykają się studenci w ramach wykładów kursowych.
Stereochemia
Stereoizomery to związki złożone z tych samych atomów połączonych tą samą sekwencją wiązań, ale posiadające różne struktury przestrzenne, które nie są wzajemnie zamienne. Te struktury przestrzenne nazywane są konfiguracjami.
Mówi się, że każdy materiał, który obraca płaszczyznę światła spolaryzowanego jest optycznie aktywny. Jeśli czysty związek jest optycznie czynny to cząsteczki związku nie można nałożyć na jej lustrzane odbicie. Jeśli przy takiej operacji cząsteczka nakłada się na swoje odbicie lustrzane, związek nie skręca płaszczyzny światła spolaryzowanego i tym samym jest optycznie nieaktywny. Właściwość braku możliwości nałożenia przedmiotu na jego lustrzane odbicie nazywa się chiralnością. Jeśli cząsteczka nie daje się nałożyć na swoje lustrzane odbicie, jest chiralna. Jeśli nakłada się na swoje lustrzane odbicie, jest achiralna. Związek między aktywnością optyczną a chiralnością jest absolutny. Nie są znane żadne wyjątki. Ostatecznym kryterium aktywności optycznej jest więc chiralność. Jest to warunek zarówno konieczny, jak i wystarczający. W każdym przypadku optycznej aktywności czystego związku występują dwa i tylko dwa izomery, zwane enancjomerami (czasami enancjomorfami). Enancjomery mają identyczne właściwości fizyczne i chemiczne z wyjątkiem dwóch istotnych cech:
- Obracają płaszczyznę światła spolaryzowanego w przeciwnych kierunkach, chociaż o równych wartościach bezwzględnych. Izomer, który obraca płaszczyznę w lewo (przeciwnie do ruchu wskazówek zegara), nazywany jest izomerem levo i jest oznaczony (–), podczas gdy ten, który obraca płaszczyznę w prawo (zgodnie z ruchem wskazówek zegara), nazywany jest izomerem dextro i jest oznaczony (+). Ponieważ różnią się tą właściwością, są często nazywane antypodami optycznymi.
- Reagują z różną szybkością z innymi chiralnymi związkami. Te szybkości mogą być na tyle zbliżone, że rozdzielenie enancjomerów jest praktycznie niemożliwe, lub mogą być tak bardzo różnić się, że jeden enancjomer reaguje z dogodną szybkością, podczas gdy drugi w praktycznie nie wchodzi w reakcję. To jest powód, dla którego wiele związków jest biologicznie aktywnych, podczas gdy ich enancjomery już nie. Enancjomery reagują z taką samą szybkością ze związkami achiralnymi.
Ogólnie można powiedzieć, że enancjomery mają identyczne właściwości w środowisku symetrycznym, ale ich właściwości mogą się różnić w środowisku niesymetrycznym. Poza ważnymi różnicami, o których wcześniej wspomniano, enancjomery mogą reagować z różną szybkością z cząsteczkami achiralnymi, jeśli obecny jest optycznie aktywny katalizator; mogą mieć różne rozpuszczalności w optycznie czynnym rozpuszczalniku; mogą mieć różne współczynniki załamania lub widma absorpcji, gdy są badane w świetle spolaryzowanym kołowo i tak dalej. W większości przypadków różnice te są zbyt małe, aby były użyteczne i często są zbyt małe, aby je zmierzyć. Chociaż czyste związki są zawsze optycznie aktywne, jeśli składają się z chiralnych cząsteczek, mieszaniny równych ilości enancjomerów są optycznie nieaktywne, ponieważ równe co do wartości bezwzględnej ale o przeciwnych znakach obroty płaszczyzny światła spolaryzowanego wzajemnie się znoszą. Takie mieszaniny nazywane są mieszaninami racemicznymi lub racematami. Ich właściwości nie zawsze są takie same jak właściwości poszczególnych enancjomerów. Właściwości w stanie gazowym, ciekłym lub w roztworze są zwykle takie same, ponieważ taka mieszanina jest prawie idealna, ale właściwości dotyczące stanu stałego, takie jak temperatura topnienia, rozpuszczalność i ciepło topnienia, są często różne. Zatem racemiczny kwas winowy ma temperaturę topnienia 204–206°C i rozpuszczalność w wodzie w temperaturze 20°C wynoszącą 206 g·l–1, podczas gdy dla (+) lub (–) enancjomeru odpowiednie wartości to 170°C i 1390 g·l–1. Występowanie aktywności optycznej zawsze świadczy o chiralności danego związku, ale jej brak nie świadczy o tym, że związek jest achiralny. Związek optycznie nieaktywny może być achiralny lub może być mieszaniną racemiczną.
Wielkość skręcalności optycznej α nie jest stała dla danego enancjomeru; zależy od długości drogi optycznej (wymiary kuwety w której badamy próbkę), temperatury, rozpuszczalnika i stężenia (dla roztworów), ciśnienia (dla gazów) i długości fali światła. Oczywiście skręcalność wyznaczona dla tego samego związku w tych samych warunkach jest zawsze identyczna. Długość naczynia (drogi optycznej) i stężenie lub ciśnienie określają liczbę cząsteczek na drodze wiązki, a zależność α od tych parametrów jest liniowa. Dlatego definiuje się liczbę, zwaną skręcalnością właściwą [α], taką że:
![]()
![]()
gdzie pierwszy wzór stosuje się w przypadku roztworów, a drugi czystych substancji. α to obserwowana skręcalność, l to długość kuwety w decymetrach, c stężenie w gramach na mililitr, a d to gęstość w tych samych jednostkach.
Skręcalność właściwą podaje się zwykle wraz z temperaturą i długością fali w postaci:
![]()
Wyrażenie [α]D oznacza, że skręcalność mierzono za pomocą linii emisyjnej D sodu, czyli długości fali λ = 589 nm. Ponadto określa się skręcalność molową będącą skręcalnością właściwą pomnożoną przez masę cząsteczkową podzieloną przez 100.
Należy podkreślić, że chociaż wartość a zmienia się wraz z warunkami w jakich wykonywany jest pomiar, to struktura cząsteczkowa pozostaje niezmieniona. Dzieje się tak nawet wtedy, gdy zmiany warunków są wystarczające, aby zmienić nie tylko wielkość skręcalności, ale nawet kierunek. Zatem jeden z enancjomerów kwasu asparaginowego po rozpuszczeniu w wodzie ma [α]D równą +4,36 w 20° C i –1,86 w 90° C, chociaż struktura cząsteczki pozostaje niezmieniona. Takie przypadki są konsekwencją przekroczenia pewnej granicznej temperatury, przy której związek nie wykazuje skręcalności (w tym przypadku 75° C). Oczywiście drugi enancjomer zachowuje się odwrotnie. Znane są inne przypadki, w których kierunek skręcania płaszczyzny światła spolaryzowanego jest odwracany przy zmianach długości fali, rozpuszczalnika, a nawet stężenia. Teoretycznie nie powinna następować zmiana [α] ze stężeniem, ponieważ jest to uwzględnione we wzorze, ale asocjacje, dysocjacje i interakcje między substancją rozpuszczoną a rozpuszczalnikiem często powodują nieliniowe zachowanie. Przykładowo [α]D kwasu (–) 2-etylo-2-metylobursztynowego w CHCl3 wynosi –5,0° przy stężeniu 16,5 g·100 ml–1 (0,165 g·ml–1), –0,7 przy c = 10,6, +1,7 przy c = 8,5 i +18,9 przy stężeniu 2,2. Zauważmy, że stężenie jest czasami podawane w g na 100 ml lub w g na decylitr zamiast standardowych gramów na mililitr (g·ml–1). Dla pewności należy zawsze sprawdzić jednostki stężenia.
Chociaż ostatecznym kryterium aktywności optycznej jest oczywiście niemożność nałożenia odbić lustrzanych (chiralność), można znaleźć inne wyrózniki, które jednak nie zawsze są ściśle spełnione. Jednym z nich jest obecność płaszczyzny symetrii. Płaszczyzna symetrii (zwana również płaszczyzną lustrzaną) to płaszczyzna przechodząca przez obiekt w taki sposób, że część po jednej stronie płaszczyzny jest dokładnym odbiciem części po drugiej stronie. Związki posiadające taką płaszczyznę są zawsze optycznie nieaktywne optycznie, ale znanych jest kilka przypadków, w których związki nie posiadają płaszczyzny symetrii, a mimo to są nieaktywne. W cząsteczkach takich związków występuje środek symetrii lub inwersyjna oś symetrii. Związki, którym brakuje inwersyjnej osi symetrii, są zawsze chiralne. Cząsteczka, która zawiera tylko jeden chiralny (stereogeniczny) atom węgla (zdefiniowany jako atom węgla połączony z czterema różnymi grupami; nazywany również asymetrycznym atomem węgla) jest zawsze chiralna, a zatem optycznie aktywna. Jednak obecność chiralnego węgla nie jest ani koniecznym, ani wystarczającym warunkiem dla wystąpienia aktywności optycznej, ponieważ aktywność optyczna może występować w cząsteczkach bez chiralnego atomu, a dodatkowo niektóre cząsteczki z dwoma lub więcej chiralnymi atomami węgla są nieaktywne gdyż ich lustrzane odbicia są nieodróżnialne.
Związki optycznie czynne można podzielić na kilka kategorii.
Związki ze stereogenicznym atomem węgla. Jeśli jest tylko jeden taki atom, cząsteczka musi być optycznie aktywna. Dzieje się tak bez względu na to, jak niewielkie są różnice między czterema grupami. Aktywność optyczna została wykryta nawet w przypadkach, takich jak 1-butanol-1-D, gdzie jedna grupa to wodór, a druga deuter:
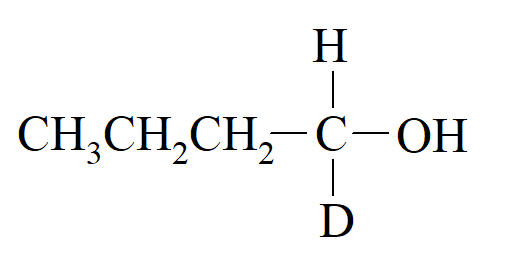
Jednak wielkość skręcalności jest w dużym stopniu zależna od charakteru czterech grup przy węglu chiralnym, i na ogół rośnie wraz ze wzrostem różnic w polaryzacjach między grupami. Grupy alkilowe mają bardzo podobne polaryzowalności, a aktywność optyczna 5-etylo-5-propylundekanu jest zbyt niska, aby można ją było zmierzyć przy dowolnej długości fali pomiędzy 280 a 580 nm.
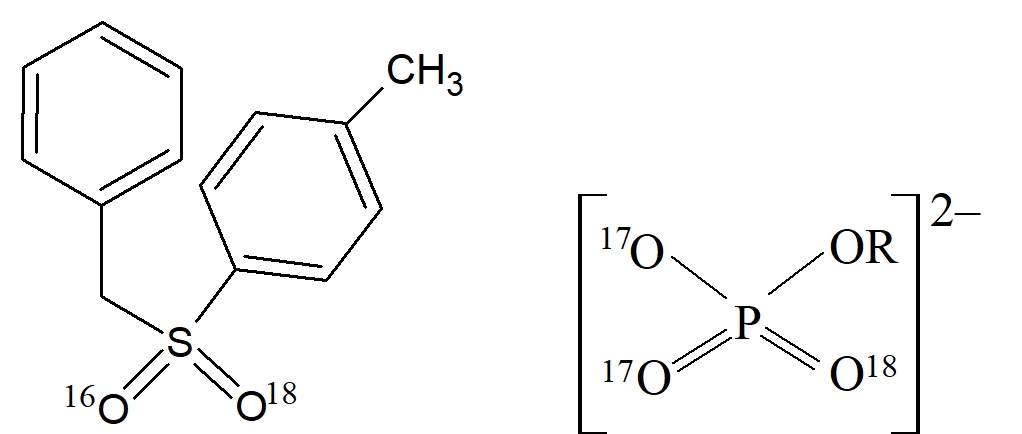
Związki z innymi czterowartościowymi atomami stereogenicznymi. Każda cząsteczka zawierająca atom, który ma cztery wiązania skierowane do rogów czworościanu, będzie optycznie aktywna, jeśli te cztery grupy są różne. Wśród atomów w tej kategorii są Si, Ge, Sn, i N (w solach czwartorzędowych lub N-tlenkach). W sulfonach siarka posiada cztery wiązania rozmieszczone w układzie czworościennym, ale ponieważ dwie z grup są zawsze tlenami, to obserwujemy zwykle barak aktywności optycznej. Jednak wytwarzanie optycznie czynnego sulfonu, w którym jeden tlen to izotop 16O, a drugi 18O, ilustruje fakt, że potrzebne są jedynie niewielkie różnice w obrębie podstawników.
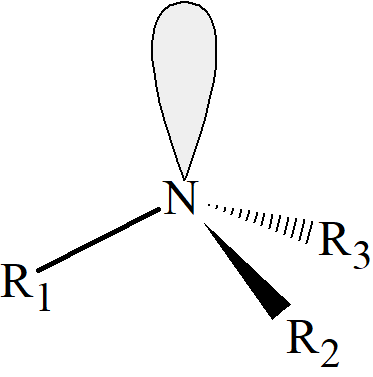
Związki ze stereogenicznymi atomami posiadającymi wolną parę elektronową. Można oczekiwać, że atomy z wiązaniami rozłożonymi przestrzennie w układ piramidalny będą wykazywać aktywność optyczną, jeśli atom jest połączony z trzema różnymi grupami, ponieważ wolna para elektronowa, stanowiąca na swój sposób czwarty podsatwnik, z konieczności różni się od pozostałych. Na przykład, oczekuje się, że amina drugorzędowa lub trzeciorzędowa, z trzema różnymi podstawnikami przy azocie, będzie chiralna. Podjęto wiele prób otrzymania takich związków, ale do 1968 r. wszystkie one zawiodły z powodu inwersji wywołanej oscylacjami wolnej pary elektronowej, która przekształca cząsteczkę w jej enancjomer.
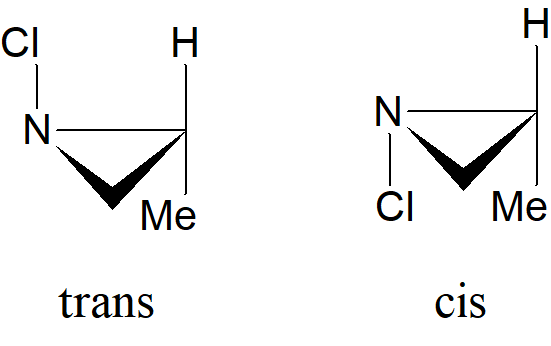
 W przypadku amoniaku następuje 2·1011 inwersji na sekundę. Szybkość inwersji jest niższa dla podstawionej cząsteczki NH3 (aminy, amidy). Na przykład bariera interkonwersji dla endo vs egzo metylu w N-metylo-2-azabicyklo [2.2.1] heptanie wynosi 0,3 kcal. Szczególnie wolno zachodzi inwersja w przypadku dwóch typów atomów azotu, a mianowicie atomu azotu w pierścieniu trójczłonowym i atom azotu połączonego z innym atomem, który ma wolną parę elektronową. Jednak nawet w takich związkach inwersja okazała się zbyt szybka uniemożliwiając wyodrębnienie oddzielnych izomerów. Cel ten został osiągnięty dopiero wtedy, gdy zsyntetyzowano związki, w których połączono obie cechy: atom azotu w trójczłonowym pierścieniu połączony z atomem zawierającym wolną parę elektronową. Przykład dwa izomery 1-chloro-2-metyloazyrydyny zostały rozdzielone i nie ulegają wzajemnej konwersji w temperaturze pokojowej:
W przypadku amoniaku następuje 2·1011 inwersji na sekundę. Szybkość inwersji jest niższa dla podstawionej cząsteczki NH3 (aminy, amidy). Na przykład bariera interkonwersji dla endo vs egzo metylu w N-metylo-2-azabicyklo [2.2.1] heptanie wynosi 0,3 kcal. Szczególnie wolno zachodzi inwersja w przypadku dwóch typów atomów azotu, a mianowicie atomu azotu w pierścieniu trójczłonowym i atom azotu połączonego z innym atomem, który ma wolną parę elektronową. Jednak nawet w takich związkach inwersja okazała się zbyt szybka uniemożliwiając wyodrębnienie oddzielnych izomerów. Cel ten został osiągnięty dopiero wtedy, gdy zsyntetyzowano związki, w których połączono obie cechy: atom azotu w trójczłonowym pierścieniu połączony z atomem zawierającym wolną parę elektronową. Przykład dwa izomery 1-chloro-2-metyloazyrydyny zostały rozdzielone i nie ulegają wzajemnej konwersji w temperaturze pokojowej:
Stabilność konformacyjną wykazano również dla oksazyrydyn, diazyrydyn triazyrydyn i 1,2-oksazolidyn, chociaż w ostatnim przypadku pierścień jest pięcioczłonowy. Należy jednak zauważyć, że tutaj atom azotu jest połączony z dwoma atomami tlenu.
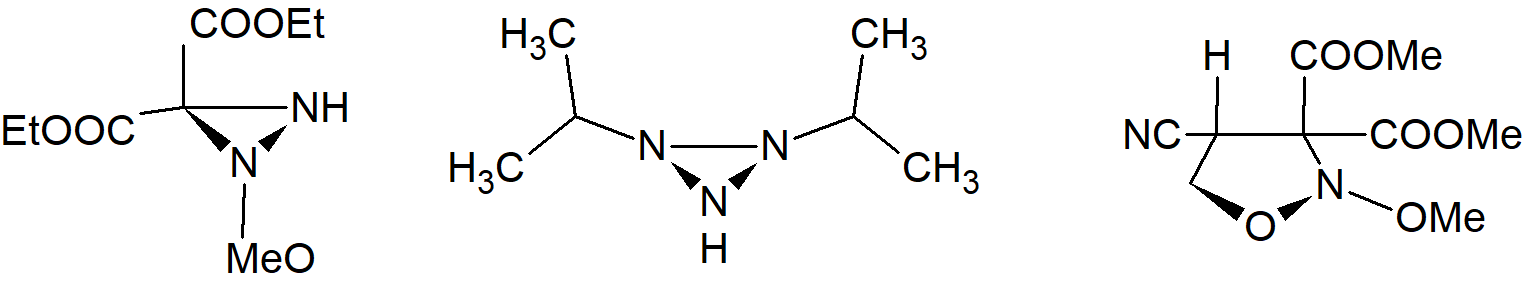
Innym związkiem, w którym azot jest połączony z dwoma tlenami, jest
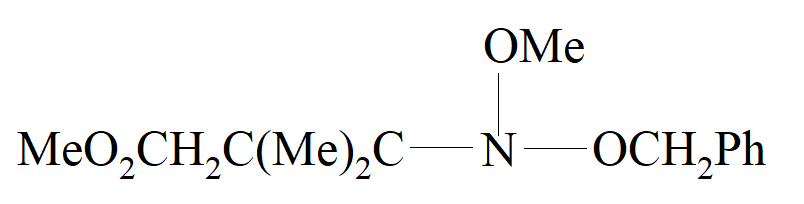
w przypadku którego nie występuje układ pierścieniowy ale został on rozdzielony na (+) i (–) enancjomery o skręcalności właściwej około 3°. Jednak nie jest on optycznie stabilny racemizując w temperaturze 20° C z okresem półtrwania 1,22 godziny. Podobny związek, w którym OCH2Ph zastąpiono przez OEt ma dłuższy okres półtrwania, 37,5 godziny w 20° C.
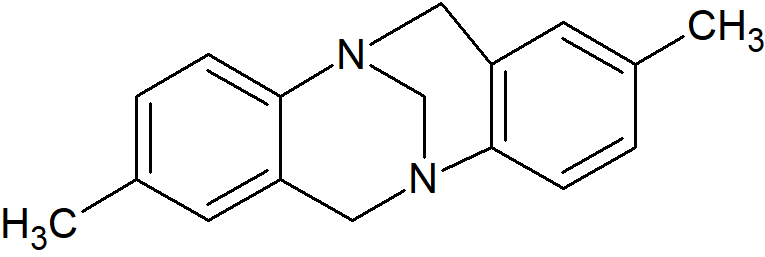
W cząsteczkach, w których atom azotu jest włączony w układ policykliczny inwersja nie zachodzi. Takie cząsteczki, jeśli są chiralne, można rozdzielić na enancjomery. Przykładem jest optycznie czynna zasada Trögera:
Interesującym przykładem jest (+)Ph12CH2SO13CH2Ph, sulfotlenek, w którym dwie grupy alkilowe różnią się tylko izotopem węgla 12C i 13C, ale który wykazuje skręcalność [α]280=+0,71°.
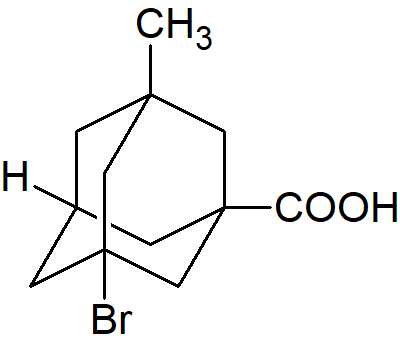
Podstawione adamantany, czyli adamantany z czterema różnymi podstawnikami w pozycjach wierzchołkowych są chiralne i optycznie czynne.
Związki w których występuje blokada rotacji wokół wiązania. Niektóre związki, które nie zawierają asymetrycznych atomów, są jednak chiralne, ponieważ zawierają strukturę, którą składającą się z dwóch prostopadłych płaszczyzn, z których żadna nie może być nałożona na drugą w wyniku działania płaszczyzny symetrii. Bifenyle zawierające cztery duże grupy w pozycjach orto nie mogą swobodnie obracać się wokół centralnego wiązania ze względu na zawadę przestrzenną. Przykładowo bariera rotacji dla 2-karboksy-2’-metoksy-6-nitrobifenylu wynosi ΔG =21,8 kcal·mol-1. Niektóre związki, które nie zawierają asymetrycznych atomów, są jednak chiralne, ponieważ zawierają strukturę, którą składającą się z dwóch prostopadłych płaszczyzn, z których żadna nie może być nałożona na drugą w wyniku działania płaszczyzny symetrii. Bifenyle zawierające cztery duże grupy w pozycjach orto nie mogą swobodnie obracać się wokół centralnego wiązania ze względu na zawadę przestrzenną. Przykładowo bariera rotacji dla 2-karboksy-2’-metoksy-6-nitrobifenylu wynosi ΔG =21,8 kcal·mol-1.
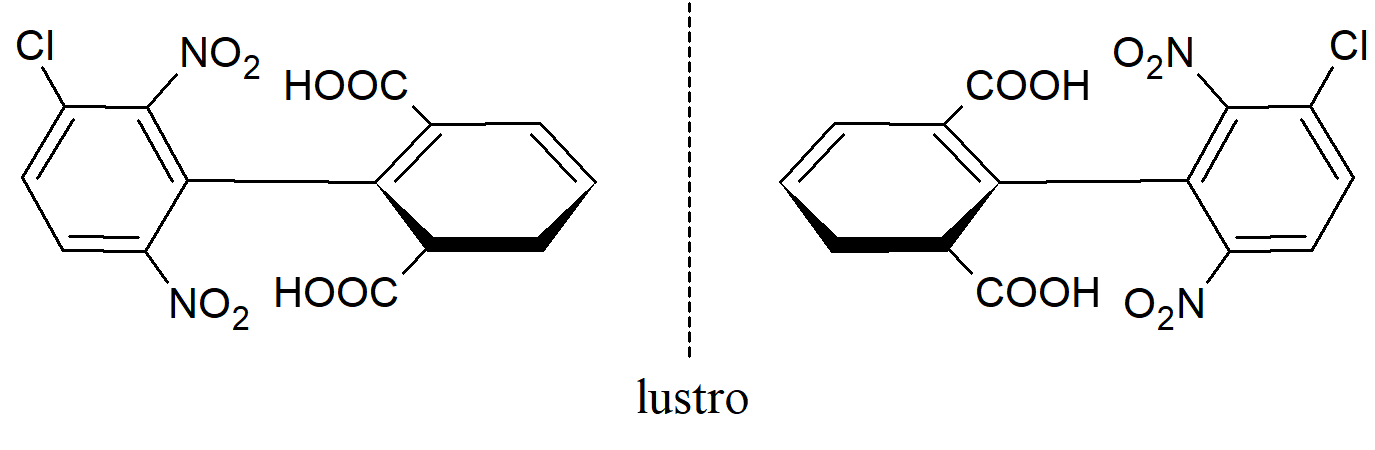
W takich związkach oba pierścienie wyznaczają wzajemnie prostopadłe płaszczyzny. Jeśli którykolwiek z pierścieni jest symetrycznie podstawiony, cząsteczka ma płaszczyznę symetrii i jest niechiralna. Natomiast cząsteczka:
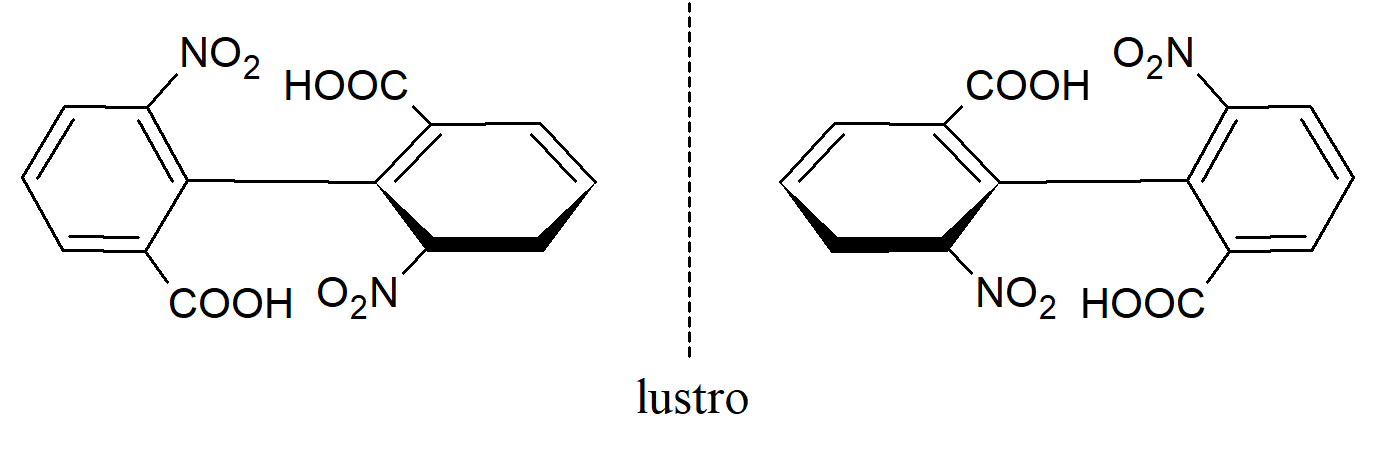
nie ma płaszczyzny symetrii i jest chiralna. Należy pamiętać, że grupy w pozycji para nie mogą powodować braku symetrii. Izomery, które można rozdzielić tylko dlatego, że rotacja wokół pojedynczych wiązań jest uniemożliwiona lub znacznie spowolniona, nazywane są atropoizomerami. 9,9’-biantraceny (biantryle) również wykazują duże bariery rotacji i antropoizomerię.
Nie zawsze jest konieczne występowanie czterech dużych grup w pozycjach orto, aby zapobiec rotacji. Związki z trzema, a nawet dwoma grupami, jeśli są wystarczająco duże, mogą utrudniać rotację. Przykładem jest kwas bifenylo-2,2’-bis-sulfonowy. W niektórych przypadkach grupy mogą być wystarczająco duże, aby znacznie spowolnić rotację, ale nie zapobiegać jej całkowicie. W takich przypadkach daje się uzyskać optycznie czynne związki. Przykładowo:
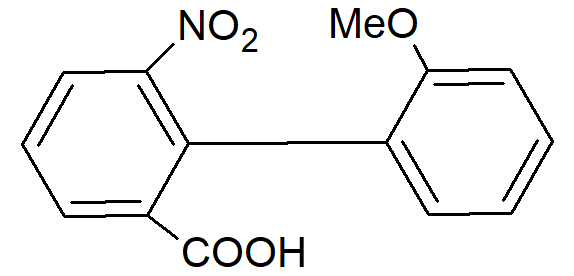
traci aktywność optyczną z okresem półtrwania równym 9,4 minuty w etanolu w 25° C.
W allenach centralny atom węgla jest w stanie hybrydyzacji sp. Pozostałe dwa orbitale p są wzajemnie prostopadłe i każdy z nich oddziałuje z orbitalem p sąsiedniego atomu węgla, wymuszając tym samym położenie dwóch pozostałych wiązań węgla do zawierania się w prostopadłych płaszczyznach.
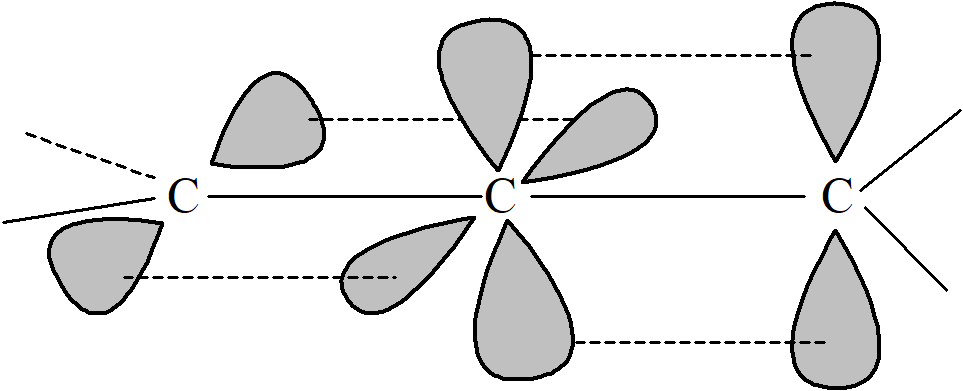
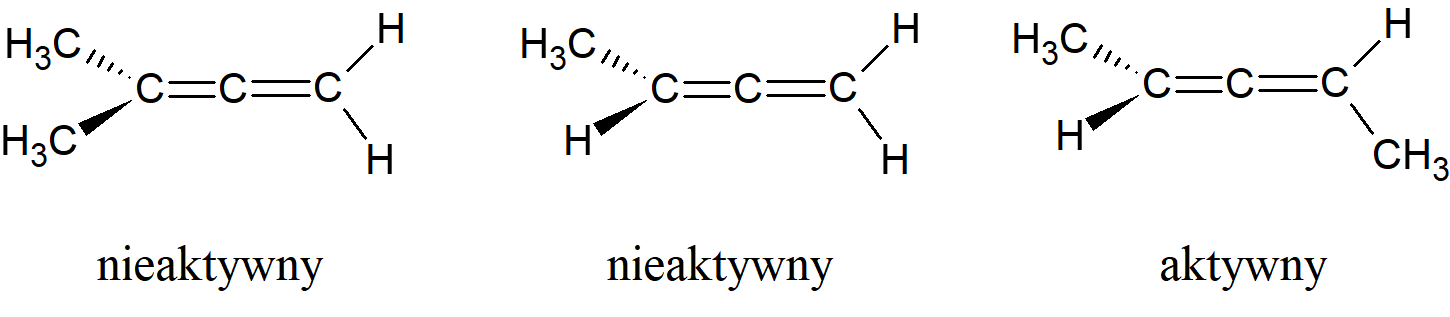
Podobnie jak bifenyle, alleny są chiralne tylko wtedy, gdy oba terminalne atomy węgla są podstawione niesymetrycznie. Przypadki te są zupełnie inne niż izomeria cis-trans związków z jednym wiązaniem podwójnym. W tych ostatnich przypadkach wszystkie cztery grupy znajdują się w jednej płaszczyźnie, izomery nie są enancjomerami ani nie są chiralne, podczas gdy w allenach grupy terminalne są położone w dwóch prostopadłych płaszczyznach, a izomery są parą optycznie czynnych enancjomerów. Kiedy w cząsteczce występuje nieparzysta liczba sprzężonych wiązań podwójnych cztery podstawniki zajmują jedną płaszczyznę i obserwuje się izomerię cis-trans. Gdy natomiast mamy parzystą liczbę skumulowanych wiązań podwójnych, sytuacja jest analogiczna do tej w przypadku allenów i możliwa jest aktywność optyczna.
Wśród innych typów związków, które są chiralne jeśli obie strony cząsteczki są niesymetryczne, są spirany i związki z egzocyklicznymi wiązaniami podwójnymi.
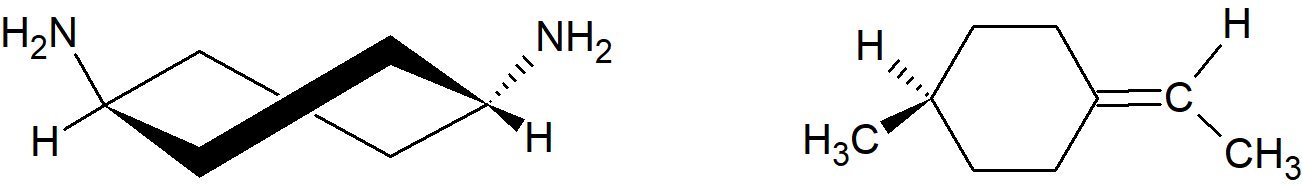
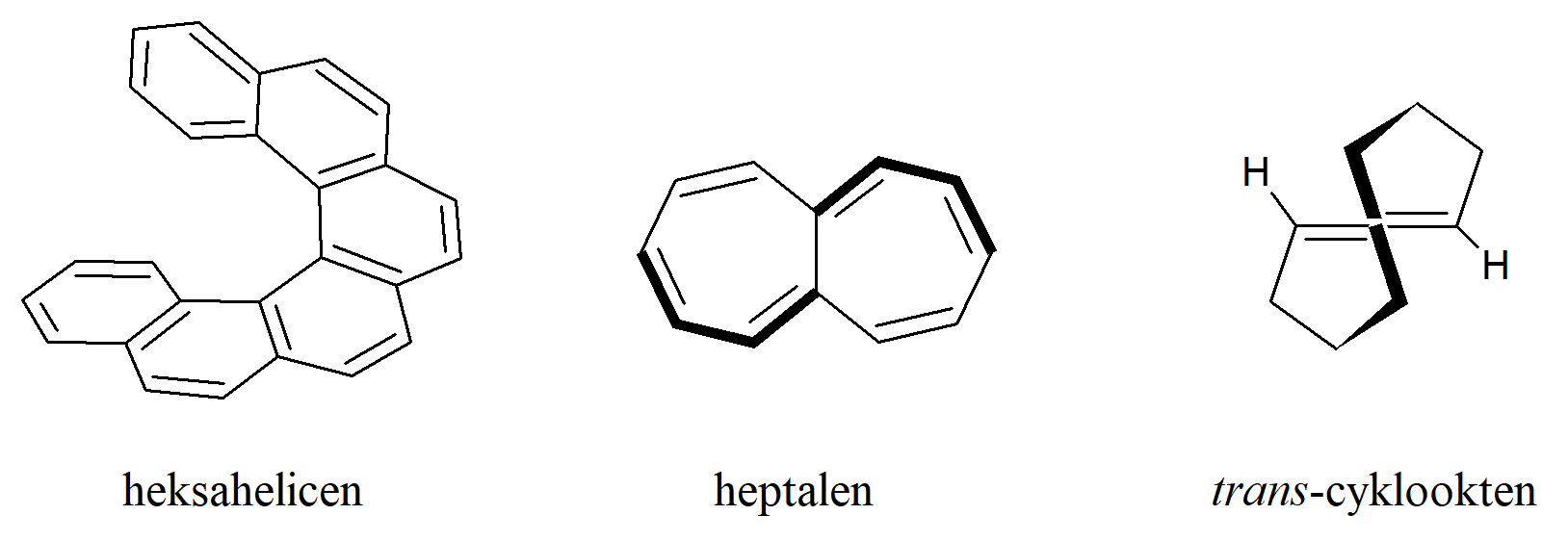
Chiralność wynikająca ze spiralnego kształtu cząsteczki. Otrzymano związki, które są chiralne, ponieważ mają kształt helikalny i dlatego mogą być orientowane w lewo lub w prawo. Cała cząsteczka jest zwykle krótsza niż jeden pełny obrót helisy, ale nie zmienia to możliwości wystąpienia lewo– i prawoskrętności. Przykładem jest heksahelicen. Bariera rotacyjna dla helicenu wynosi 22,9 kcal·mol–1 i jest znacznie wyższa, gdy zostanie podstawniona. Wykazano, że dianion helicenu zachowuje swoją chiralność. Heptalen to kolejny związek, który nie jest płaski. Jego skręcona struktura sprawia, że jest chiralny, ale enancjomery szybko ulegają konwersji.
Aktywność optyczna spowodowana ograniczoną rotacją innego rodzaju. Podstawione paracyklofany mogą być optycznie czynne.
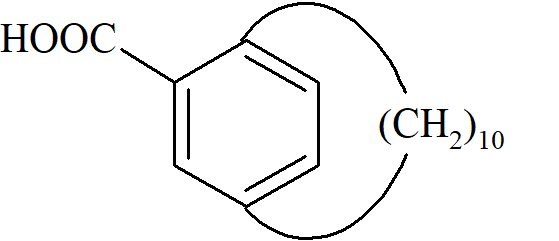
W tym przypadku chiralność wynika z tego, że pierścień benzenowy nie może obracać się w taki sposób, że grupa karboksylowa przechodzi przez pierścień alicykliczny. Metalloceny podstawione co najmniej dwoma różnymi grupami w jednym pierścieniu są również chiralne.
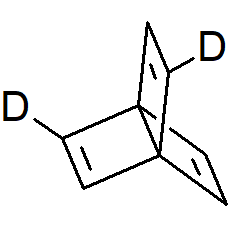
Metalloceny podstawione co najmniej dwoma różnymi grupami na jednym pierścieniu są również chiralne. Pochodna 2,5-dideutero norbornanu jest chiralna, chociaż macierzysty węglowodór i pochodna monodeuterowa nie są.