Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Reakcje addycji do wiązania wielokrotnego
Reakcje addycji do wiązania wielokrotnego
Istnieją cztery podstawowe sposoby addycji do wiązania podwójnego lub potrójnego. Trzy z nich to procesy dwuetapowe, z początkowym atakiem nukleofila lub atakiem na elektrofil lub wolny rodnik. Drugi etap polega na połączeniu powstałego związku pośredniego z odpowiednio substratem kationowym, anionowym lub obojętnym elektrycznie. Czwarty typ mechanizmu to równoczesny atak na dwa atomy węgla pomiędzy którymi występuje podwójne lub potrójne wiązanie. To, który z czterech mechanizmów zachodzi w danym przypadku, zależy od rodzaju substratów i warunków reakcji.
Addycja elektrofilowa
W tym mechanizmie substrat kationowy zbliża się do wiązania podwójnego lub potrójnego i w pierwszym etapie tworzy z nim wiązanie σ wykorzystując elektrony π, wiązania wielokrotnego:
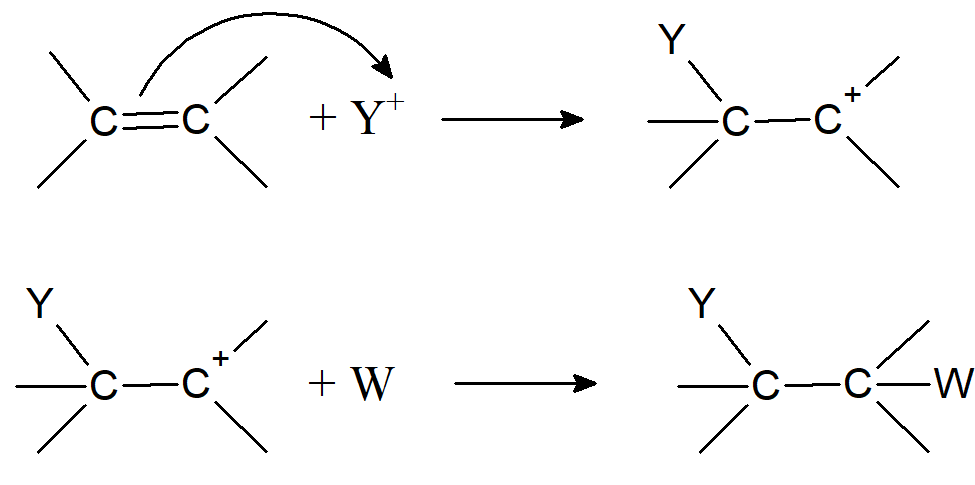
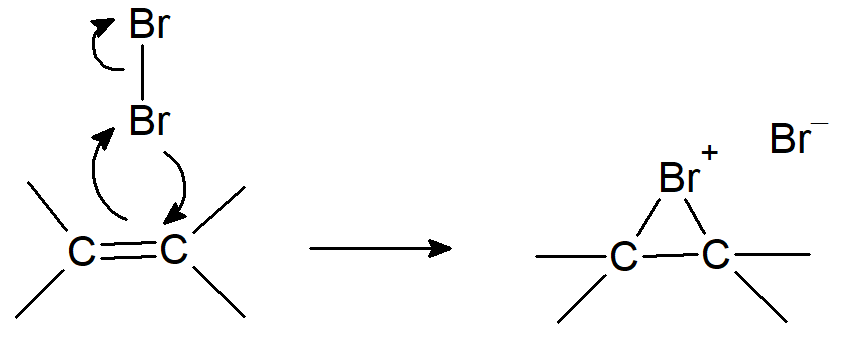
Podobnie jak w przypadku substytucji elektrofilowej, Y nie musi w rzeczywistości być jonem dodatnim, może być dodatnim końcem dipola lub dipola indukowanego, z ujemną częścią odrywającą się podczas pierwszego etapu lub wkrótce po nim. Drugi krok to połączenie związku przejściowego z cząsteczką posiadającą parę elektronów i często obdarzoną ładunkiem ujemnym. Nie wszystkie addycje elektrofilowe działają według tego prostego mechanizmu. W przypadku bromowania nawet jeśli powstaje związek przejściowy pokazany na schemacie to bardzo szybko cyklizuje do jonu bromianowego:
Rozważmy stereochemię addycji do wiązania podwójnego. Dwa atomy węgla pomiędzy którymi występuje wiązanie podwójne i cztery bezpośrednio do nich przyłączone atomy znajdują się w jednej płaszczyźnie mamy zatem trzy możliwości procesu addycji. Grupy Y i W mogą zostać przyłączone od tej samej strony płaszczyzny, i addycja będzie stereospecyficzna tworząc konformację syn; mogą zostać przyłączone z przeciwnych stron płaszczyzny i nastąpi addycja anty; lub reakcja może być niestereospecyficzna. W celu określenia, która z tych możliwości występuje w danej reakcji, często przeprowadza się następujący eksperyment: YW są przyłączane do izomerów cis i trans alkenu postaci ABC=CBA. Jako przykładu możemy użyć izomeru cis alkenu. Jeśli addycja jest typu syn, produkt będzie parą erytro dl, ponieważ każdy węgiel ma 50% szansy na atak czynnika Y:
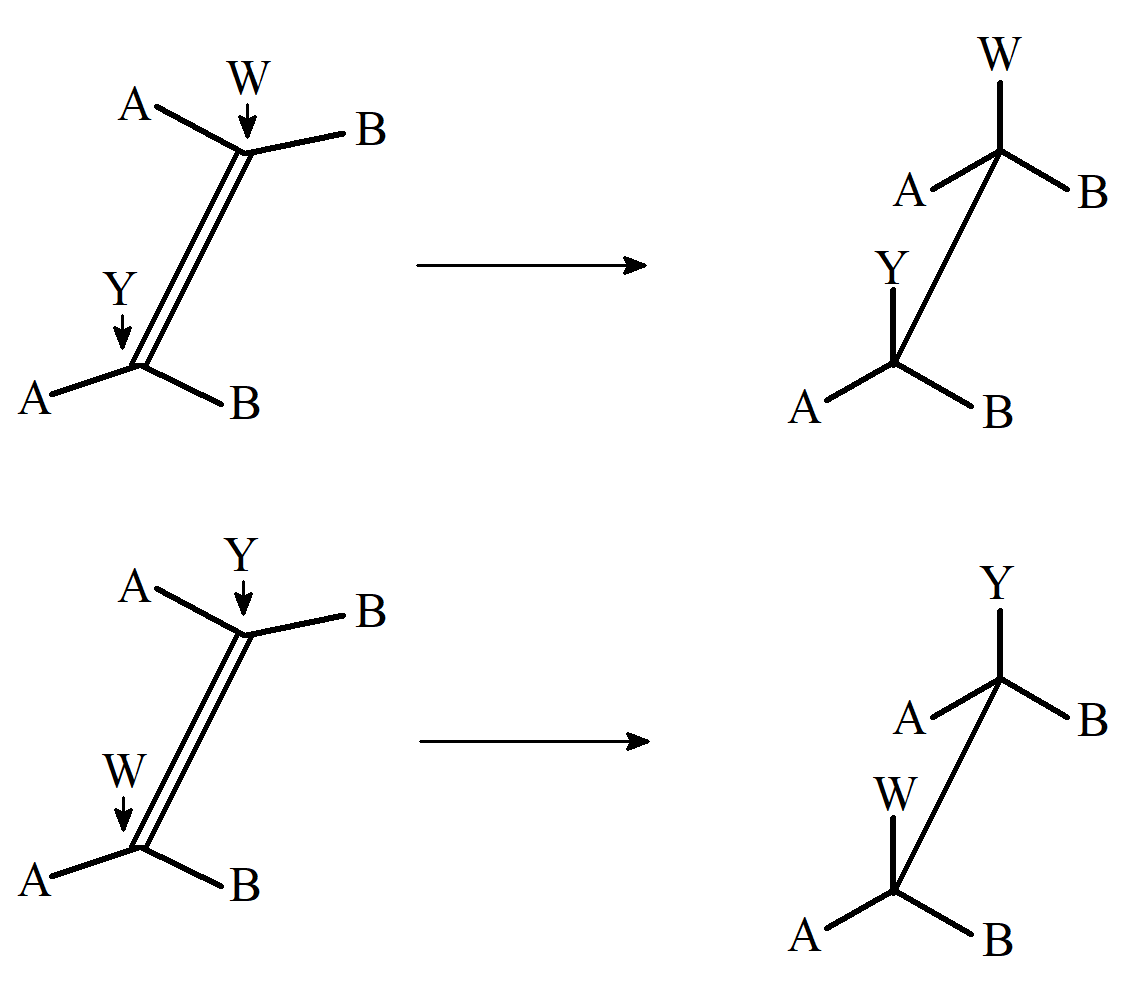 Addycja syn powstaje para erytro dl.
Addycja syn powstaje para erytro dl.
W przypadku addycji anti powstaje para treo dl.
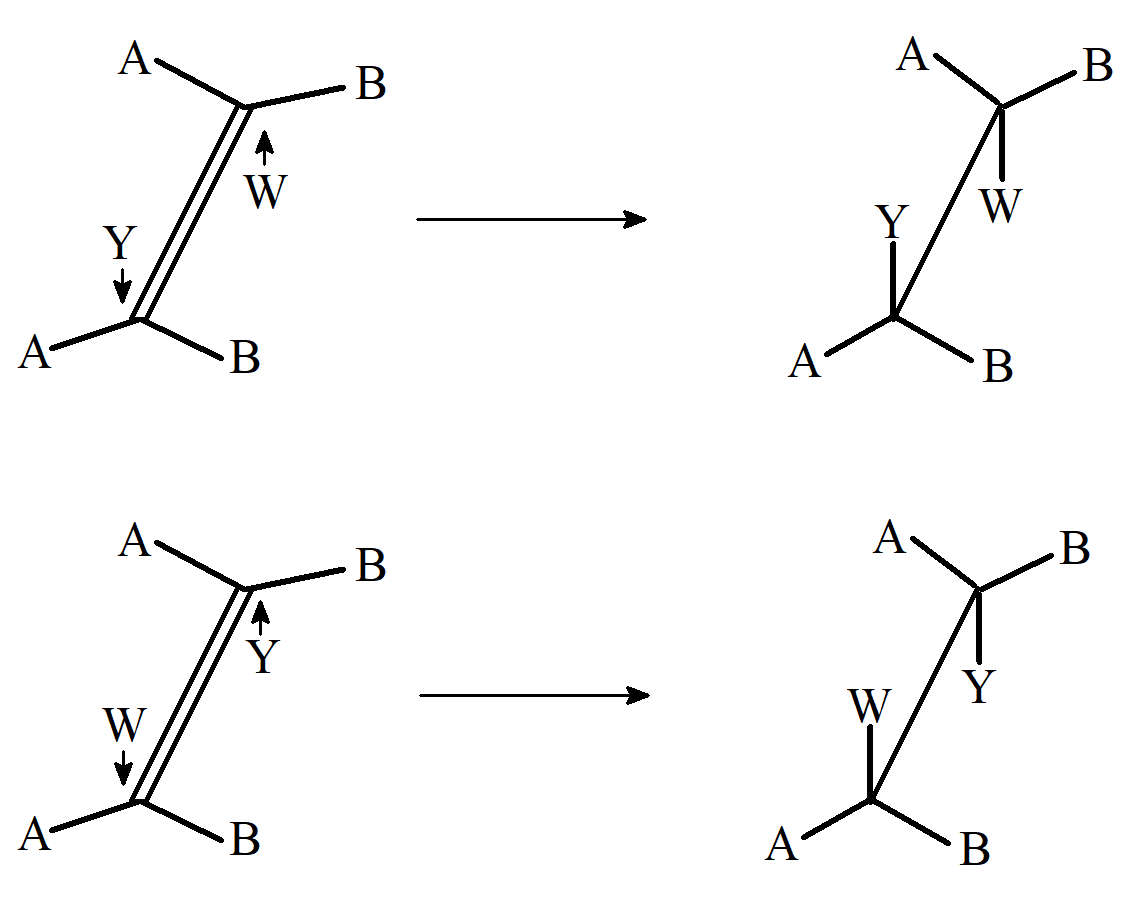 Addycja anti powstaje para treo dl.
Addycja anti powstaje para treo dl.
W przypadku izomerów trans rezultaty addycji są odwrotne, czyli para diastereoizomerów treo powstaje podczas addycji syn, a erytro addycji anti. W przypadku związków z wiązaniem potrójnym AC≡CA addycja syn prowadzi do cis a anti do trans alkenu. W przypadku gdy addycja prowadzi do cyklicznego układu przejściowego musi być ona typu anti.
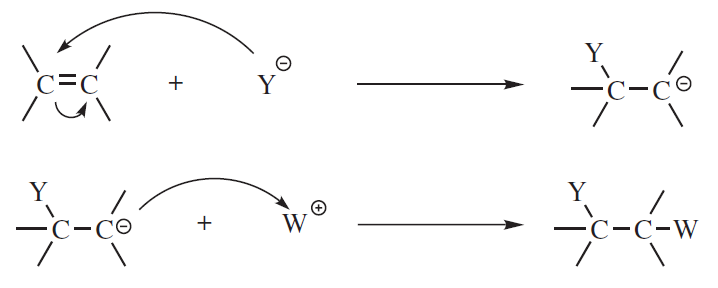
Addycja nukleofilowa
W pierwszym etapie addycji nukleofilowej nukleofil przenosi parę elektronową do jednego z atomów węgla pomiędzy którymi występuje podwójne lub potrójne wiązanie, tworząc karboanion. W drugim etapie następuje połączenie karboanionu z cząsteczką posiadającą ładunek dodatni:
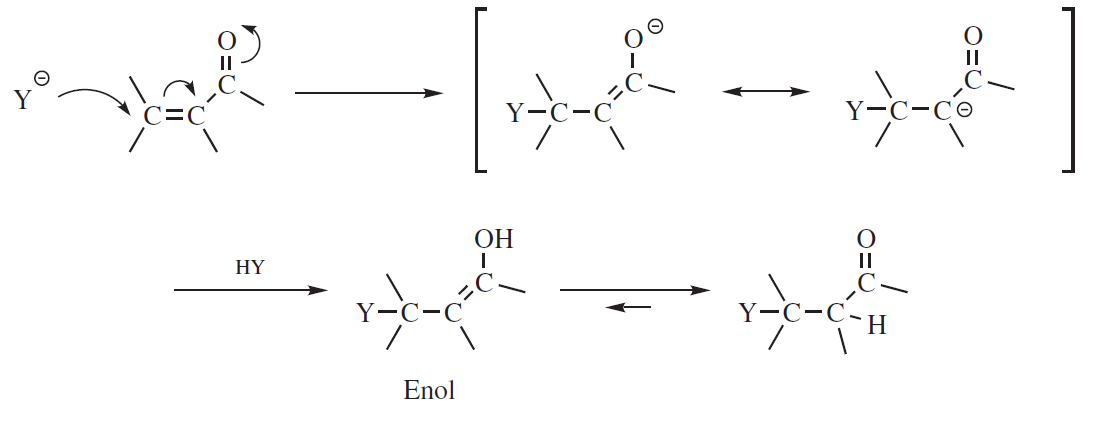
W szczególnym przypadku addycji HY do związku postaci –C=C–Z, gdzie Z jest grupą CHO, COR, COOR, CONH2, CN, NO2, SOR, SO2R, addycja prawie zawsze następuje według mechanizmu nukleofilowego, a Y łączy się z węglem bardziej oddalonym podstawnika Z.
Addycja wolnorodnikowa
Pod wpływem światła lub innego czynnika związek YW rozpada się na rodniki:
YW → Y· + W·
lub też rozpad zachodzi w reakcji z innym rodnikiem:
R· + YW → RW + Y·
W kolejnym etapie następuje propagacja reakcji rodnikowej:
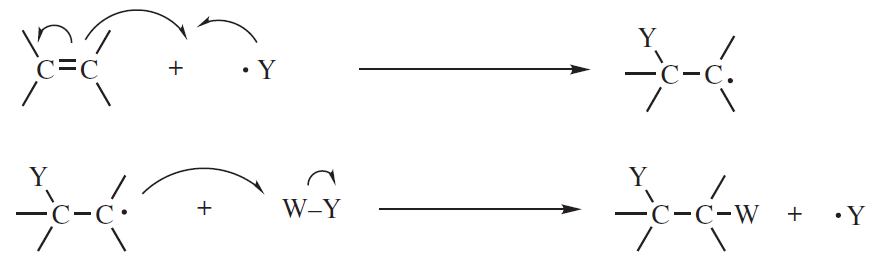
A zakończenie łańcucha może nastąpić poprzez utworzeniu dimeru:

Podobnie jak w przypadku elektrofilowej substytucji aromatycznej grupy będące donorami elektronów zwiększają reaktywność wiązania podwójnego w stosunku do addycji elektrofilowej, a grupy odciągające elektrony ją zmniejszają. Reaktywność w reakcji addycji elektrofilowej w przypadku alkenów wzrasta w kolejności CCl3CH=CH2 < Cl2CHCH=CH2 < ClCH2CH=CH2 < CH3CH2=CH2. W przypadku addycji nukleofilowej sytuacja jest odwrotna. Reakcje addycji najlepiej zachodzą dla związków zawierających trzy lub cztery grupy odciągające elektrony. Wpływ podstawników takich jak F, CN jest tak duży że można stwierdzić, że proste alkeny nie reagują w mechanizmie nukleofilowym, a polifluoro lub policyjano alkeny na ogół nie reagują w mechanizmie elektrofilowym.
Kierunek addycji określa reguła Markownikowa zgodnie z którą na ogół w reakcjach addycji do wiązania −C=C− atomy lub grupy o mniejszej elektroujemności przyłączają się do tego z dwóch atomów węgla, do którego już wcześniej było przyłączone więcej atomów lub grup o własnościach elektrododatnich. Można tę regułę przedstawić w postaci: bardziej elektroujemna grupa przyłącza się zawsze do tego atomu węgla, przy którym jest mniej atomów wodoru lub że bardziej elektrododatnia grupa przyłącza się do tego atomu węgla, przy którym jest więcej atomów wodoru.
Addycja do wiązań wielokrotnych węgiel–heteroatom
Wiązania C=O, C=N i C≡N są silnie polarne, z dodatnim ładunkiem na węglu (z wyjątkiem izocyjanków). Atakujące nukleofile zawsze łączą się z węglem, a elektrofile z tlenem lub azotem. Addycje do wiązań C=S są rzadziej spotykane, ale w tych przypadkach kierunek reakcji może być inny.
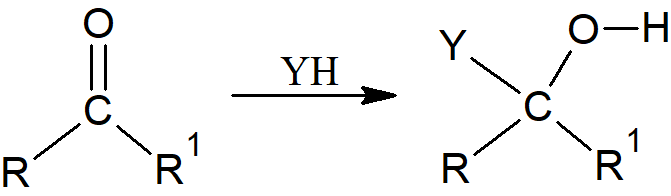
Powstający związek ma stereogeniczny węgiel, ale jeśli nie występuje chiralność w obrębie R lub R1 lub YH jest optycznie aktywny, powstający produkt jest mieszaniną racemiczną. To samo dotyczy addycji do wiązań C=N i C=S, ponieważ w żadnym z tych przypadków chiralność nie może być obecna na heteroatomie. Addycja jednej cząsteczki YH do potrójnego wiązania węgiel-azot, mimo iż produkt reakcji może występować w formach (E) i (Z), to reakcje te generalnie dają produkty iminowe, które ulegają dalszej reakcji.
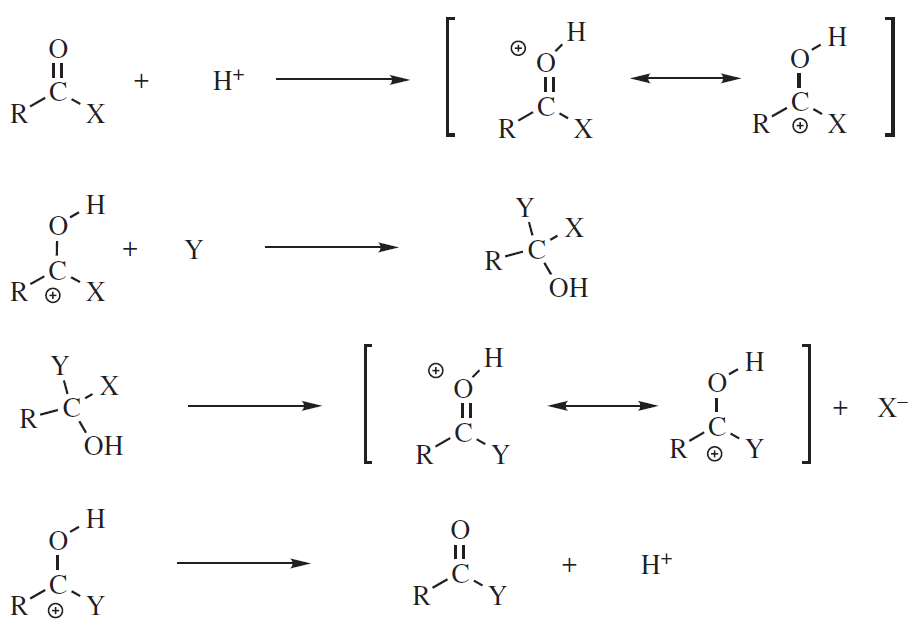
Mechanizm reakcji można rozważać w ten sposób, że w pierwszym etapie powstaje wiązanie pomiędzy węglem a nukleofilem:
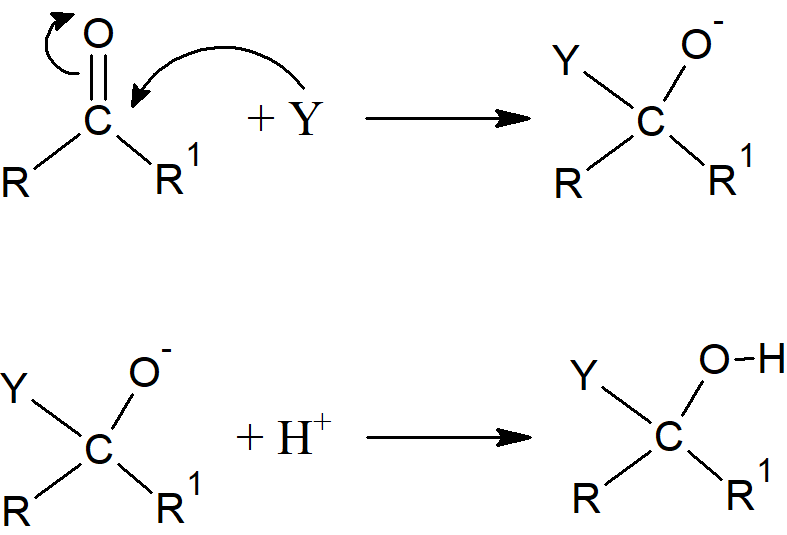
a następnie elektrofilowe przyłączenie kationu H+.
Możliwe jest również, że heteroatom reaguje jako zasada, przyłączając formy elektrofilowe, czyli najczęściej proton, i wtedy mechanizm jest następujący:
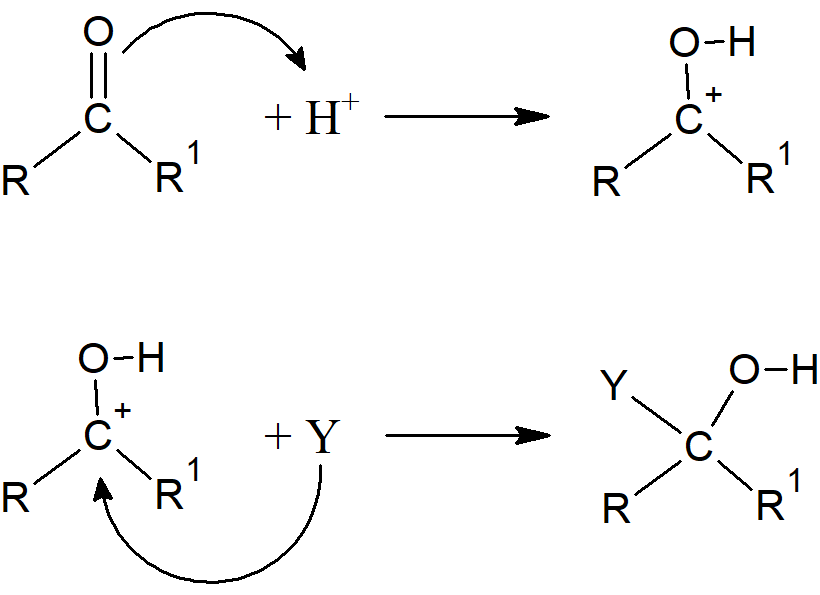
Niezależnie od tego, czy nukleofil atakuje węgiel, czy heteroatom reaguje z elektrofilem, etapem określającym szybkość jest zwykle ten obejmujący atak nukleofilowy. Wiele z tych reakcji może być katalizowanych zarówno przez kwasy, jak i zasady.Zasady katalizują reakcję, przekształcając YH w silniejszy nukleofil Y–. Kwasy katalizują reakcję przekształcając substrat w kation stabilizowany przez heteroatom, dzięki czemu jest bardziej podatny na atak nukleofilowy. Podobny efekt katalityczny wywołują jony metali (np. Ag+), które działają jako kwasy Lewisa. Jeżeli podstawniki R i R1 są grupami elektronodonorowymi szybkość reakcji addycji ulega zmniejszeniu, natomiast w przypadku podstawników elektronoakceptorowych zwiększa się. Obecność wiązań podwójnych sprzężonych z wiązaniem C=X również obniża szybkość reakcji addycji. Analogiczny efekt wywołuje zawada przestrzenna, co widać porównując szybkości reakcji ketonów i aldehydów. Ketony w rodzaju heksametyloacetonu czy keton dineopentylowy nie ulegają reakcji addycji do wiązania C=O.
Substytucja do grup C=X może również przebiegać według mechanizmu drugorzędowego SET. Mechanizm takiej reakcji jest następujący:
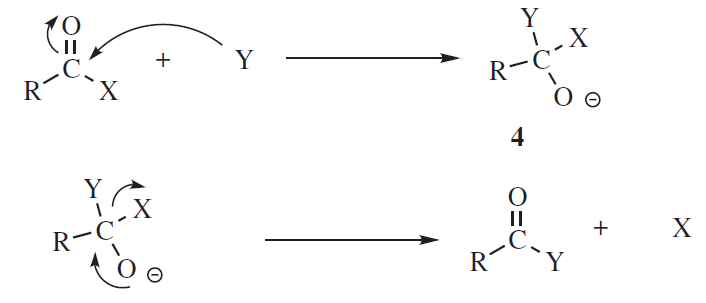
Jeżeli reakcja jest prowadzona w środowisku kwaśnym dochodzi etap początkowy, w którym jon H+ jest katalizatorem.