 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Skład wody i kwasu azotowego - H. Cavendish
Skład wody i kwasu azotowego - H. Cavendish
H. Cavendish rozpoczął badania nad wytwarzaniem wody z palnego powietrza (wodór) i powietrza deflogistonowanego (tlen) jako kontynuację prac J. Priestleya i J. Warltire'a. Notatka napisana przez Cavendisha ukazała się pod tytułem „Experiments on Air”,a sam tekst rozpoczyna od wykazania, że kiedy dwa gazy reagują gwałtownie w zamkniętym miedzianym lub szklanym naczyniu, nie obserwuje się utraty masy, jak przypuszczał Warltire. Cavendish używając mieszanin gazów w różnych proporcjach doszedł do wniosku, że:
„Kiedy palne i zwykłe powietrze eksplodują w odpowiednich proporcjach, prawie całe powietrze palne i prawie jedna piąta zwykłego powietrza tracą swoją elastyczność i skraplają się w postaci rosy, która osadza się na szkle. Aby dokładniej zbadać naturę tej rosy podpaliłem gazy, a spalone powietrze przepuściłem przez szklaną rurkę o długości 8 stóp, aby skroplić powstającą rosę. W ten sposób w cylindrze skropliło się ponad 135 ziaren wody, które nie miały smaku ani zapachu i nie pozostawiły żadnego wyczuwalnego osadu po odparowaniu do sucha; podczas parowania nie wydzielał też żadnego ostrego zapachu; krótko mówiąc, wydawało się, że jest to czysta woda.”
Następnie Cavendish powtórzył eksperyment Priestleya, podpalając mieszaninę palnego i deflogistonowanego powietrza za pomocą iskry elektrycznej w „szklanej kuli, mieszczącej 8800 miar ziarna, wyposażonej w mosiężny kurek i aparat do wypalania powietrza za pomocą elektryczności. Ta kula została opróżniona za pomocą pompy powietrznej, a następnie wypełniona mieszaniną palnego i deflogistonowanego powietrza, przez kurek, do którego zamocowano wygiętą szklaną rurkę, której drugi koniec znajdował się w szklanym słoju odwróconym do góry dnem pod wodą, i zawierający mieszaninę 19500 ziaren deflogistonowanego powietrza i 37000 palnego powietrza.” W przypisie wyjaśnia, że koniec wygiętej rurki został zamknięty odrobiną wosku, „który został starty po podniesieniu ponad powierzchnię wody. Gazy zostały zawilgocone, ale nie podjęto próby ich wysuszenia, chociaż Cavendish wcześniej używał rurek wypełnionych środkiem suszącym. Po przeprowadzeniu szeregu takich eksperymentów podał stosunek objętości powietrza palnego i deflogistonowanego 2,02 do 1, co było zgodne z wynikami poprzednich doświadczeń. Jednak pojawiła się jedna istotna różnica. Otóż okazało się, że powstająca w doświadczeniach z iskrą elektryczną woda jest „wyczuwalnie kwaśna, a po nasyceniu stałymi alkaliami i odparowaniu pozostawały blisko dwa ziarna saletry; wskazywało to, że woda ta była mieszaniną zwykłej wody z niewielką ilością kwasu azotawego”. Cavendish stwierdził, że powstało więcej kwasu, gdy stosował nadmiar deflogistonowanego powietrza, ale gdy zastosował nadmiar palnego powietrza, kwas nie powstawał, podobnie jak w przypadku gdy dokonywał spalenia palnego powietrza w normalnym powietrzem atmosferycznym. Wyniki te zaskoczyły Cavendisha, co opóźniło publikację jego pracy. W międzyczasie pisze:
„Myślę, że musimy dopuścić, że deflogistonowane powietrze jest w rzeczywistości niczym więcej niż deflogistonowaną wodą lub wodą pozbawioną flogistonu; lub innymi słowy, że woda składa się z deflogistonowanego powietrza połączonego z flogistonem; a tym palnym powietrzem jest albo czysty flogiston, jak przypuszczają dr Priestley i pan Kirwan, albo woda połączona z flogistonem.” Należy wspomnieć, że sam Cavendish w 1766 roku uważał, że palne powietrze jest czystym flogistonem. Spośród tych dwóch alternatyw uważał drugą za bardziej prawdopodobną, czyli:
deflogistonowane powietrze = woda - φ,
palne powietrze = woda + φ.
W związku z tym powstająca w reakcjach spalania gazów woda miała istnieć w gazach, a przyczyną wybuchu była redystrybucja flogitonu. Powód, dla którego uważał drugą alternatywę za bardziej prawdopodobną można wyjaśnić w następujący sposób. Zwykłe lub deflogistonowane powietrze łączy się w zwykłej temperaturze z powietrzem saletrzanym (NO), które jest związkiem kwasu azotowego i flogistonu, a ponieważ w reakcji powstaje kwas azotowy (w obecności wody), a deflogistonowane powietrze może pobrać flogiston z jego kombinacji z kwasem azotowym. Jednak palne powietrze nie reaguje z deflogistonowanym powietrzem, dopóki nie zostanie podgrzane do odpowiednio wysokiej temperatury, co trudno wytłumaczyć, jeśli palne powietrze jest wolnym flogistonem.
W artykule wydrukowanym w 1784 r. Cavendish dodaje, że uzyskane wyniki można również wyjaśnić posługując się teorią Lavoisiera, zgodnie z którą „musimy przypuszczać, że woda składa się z palnego powietrza połączonego z deflogistonowanym powietrzem. . . i rzeczywiście. . . dodawanie deflogistonowanego powietrza do ciała sprowadza się do tego samego, co pozbawianie go flogistonu i dodawanie do niego wody”; ale „powszechnie przyjęta zasada flogistonu wyjaśnia wszystkie zjawiska, a przynajmniej równie dobrze jak teoria pana Lavoisiera”; i dlatego Cavendish przyjął teorię Lavoisiera, chociaż czasami wydaje się, że myśli na podstawie nowej teorii, ale posługując się starą terminologią, jak wtedy, gdy mówi, że czerwony osad to „tylko rtęć, która pochłonęła, podczas przygotowywania, deflogistonowane powietrze z atmosfery”.
Skład kwasu azotowego
H. Cavendish w swoim drugim tekście na ten temat, opublikowanym w 1785 r., znalazł wyjaśnienie przyczyny kwasowości wody powstającej w reakcjach spalania inicjowanych iskrą elektryczną. Kwas azotowy (który nazywa „azotawym”) powstaje z azotu („flogistonowanego powietrza”) zawartego jako zanieczyszczenie w deflogistonowanym powietrzu. Natomiast kwas nie powstaje podczas eksplozji mieszaniny palnego i zwykłego powietrza, ponieważ płomień nie jest wtedy wystarczająco gorący. Cavendish udowodnił eksperymentalnie, że kwas azotowy(V) powstaje gdy iskry elektryczne przepuszcza się przez mieszaninę tlenu i azotu w obecności roztworu potażu, co prowadzi do utworzenia saletry. (J. Priestley w 1774 r. wiedział, że podczas iskrzenia w powietrzu powstaje kwas co stwierdził dokonując wyładowań elektrycznych nad roztworem zawierającym lakmus). Cavendish wykonał eksperyment, w którym mieszanina dwóch gazów została umieszczona w wygiętej szklanej rurce zawierającej roztwór potażu, której końce były zanurzone w rtęci. Mieszanina gazów w rurce stopniowo zmniejszała swoją objętość w wyniku wyładowań elektrycznych i powstał roztwór saletry. Nadmiar tlenu został usunięty roztworem wątroby siarczanej (siarczek potasu), pozostawiając mały pęcherzyk gazu, „z pewnością nie więcej niż 1/120 masy flogistonowego powietrza umieszczonego w rurce; tak więc jeśli istnieje jakakolwiek część flogistonowego powietrza naszej atmosfery, która różni się od reszty i nie może być zredukowana do kwasu azotawego, możemy spokojnie stwierdzić, że nie jest to więcej niż 1/120 całości.”
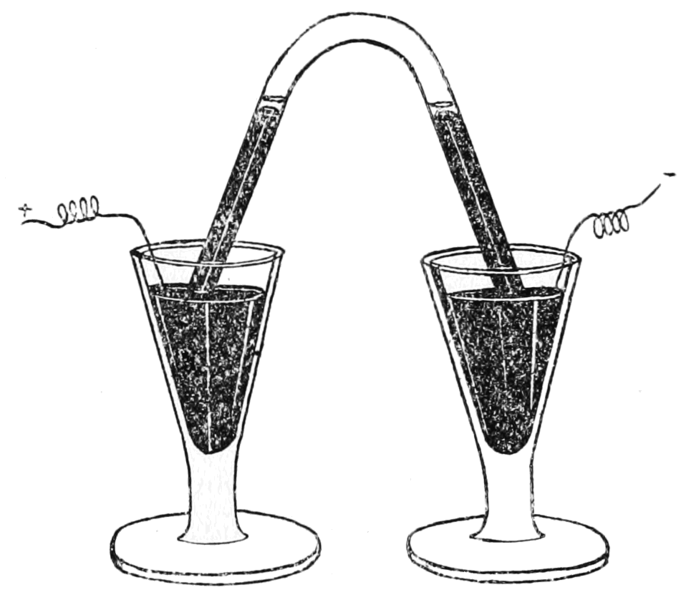 Schemat aparatury Cavendisha do analizy składu powietrzaTa niewielka pozostałość gazu została znacznie później zbadana przez Rayleigha i Ramsaya i nazwana argonem, a jej wykrycie jest hołdem dla doskonałych umiejętności eksperymentalnych Cavendisha i jego absolutnej uczciwości w raportowaniu wyników badań. Pisze on, że eksperymenty dowiodły, że „flogistonowane powietrze mogło za pomocą iskry elektrycznej utworzyć chemiczną kombinację z deflogistonowanym powietrzem, a tym samym zostało zredukowane do kwasu azotawego, który połączył się z osadami mydlanymi (roztwór potażu) i utworzył roztwór saletry; Podczas tych eksperymentów dwa powietrza faktycznie zniknęły, a kwas azotawy faktycznie powstał w ich miejsce.” Na niezwykłe umiejętności Cavendisha wskazuje również obserwacja jaką poczynił, że chociaż roztwór dał osad z azotanem(V) srebra, nie było to wywołane obecnością kwas chlorowodorowego, ponieważ saletra, po silnym podgrzaniu, rozkłada się na deflogistonowane powietrze i pozostawia pozostałość, który po rozpuszczeniu w wodzie tworzy azotan(V) srebra. „Ta właściwość flogistonowanej saletry jest warta uwagi chemików, ponieważ w przeciwnym razie mogą czasami popaść w błędy, badając obecność kwasu morskiego (kwas solny był tak nazywany przez alchemików) za pomocą roztworu srebra”. Ponieważ niektórzy chemicy wyrazili wątpliwości co do dokładności badań Cavendisha, komitet Royal Society powtórzył je w latach 1787–88 potwierdzając w pełni jego wyniki.
Schemat aparatury Cavendisha do analizy składu powietrzaTa niewielka pozostałość gazu została znacznie później zbadana przez Rayleigha i Ramsaya i nazwana argonem, a jej wykrycie jest hołdem dla doskonałych umiejętności eksperymentalnych Cavendisha i jego absolutnej uczciwości w raportowaniu wyników badań. Pisze on, że eksperymenty dowiodły, że „flogistonowane powietrze mogło za pomocą iskry elektrycznej utworzyć chemiczną kombinację z deflogistonowanym powietrzem, a tym samym zostało zredukowane do kwasu azotawego, który połączył się z osadami mydlanymi (roztwór potażu) i utworzył roztwór saletry; Podczas tych eksperymentów dwa powietrza faktycznie zniknęły, a kwas azotawy faktycznie powstał w ich miejsce.” Na niezwykłe umiejętności Cavendisha wskazuje również obserwacja jaką poczynił, że chociaż roztwór dał osad z azotanem(V) srebra, nie było to wywołane obecnością kwas chlorowodorowego, ponieważ saletra, po silnym podgrzaniu, rozkłada się na deflogistonowane powietrze i pozostawia pozostałość, który po rozpuszczeniu w wodzie tworzy azotan(V) srebra. „Ta właściwość flogistonowanej saletry jest warta uwagi chemików, ponieważ w przeciwnym razie mogą czasami popaść w błędy, badając obecność kwasu morskiego (kwas solny był tak nazywany przez alchemików) za pomocą roztworu srebra”. Ponieważ niektórzy chemicy wyrazili wątpliwości co do dokładności badań Cavendisha, komitet Royal Society powtórzył je w latach 1787–88 potwierdzając w pełni jego wyniki.