 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Fotochemia związków organicznych
Fotochemia związków organicznych
Elektrony w cząsteczce związku chemicznego mogą ulegać wzbudzeniu ze stanu podstawowego do stanu o wyższej energii w wyniku na przykład absorpcji kwantu promieniowania elektromagnetycznego z zakresu ultrafioletu, widzialnego lub podczerwieni. Ponieważ energia cząsteczki jest skwantowana to wzbudzenie elektronu wymaga ściśle określonej porcji energii, czyli absorbowane będzie tylko światło o energii odpowiadającej różnicy energii stanów wzbudzonego i podstawowego. Zakresy promieniowania o innych długościach fali (innych energiach) będą przechodziły przez próbkę bez zmiany intensywności. Związek chemiczny absorbujący pewien zakres światła widzialnego jest odbierany przez nas jako posiadający kolor komplementarny do absorbowanego. Przykładowo związek absorbujący wysokoenergetyczne promieniowanie z zakresu fioletu jest postrzegany jako żółty.
Absorpcyjne widmo elektronowe nie składa się z jednego lub więcej ostrych pików, z których każdy odpowiada przeniesieniu elektronu z jednego poziomu na drugi. Wynika to z faktu, że cząsteczki znajdują się w nieustannym ruchu wibrując i obracając się, które to drgania są również kwantowane. Cząsteczka w dowolnym momencie znajduje się nie tylko w danym stanie elektronowym, ale także w danym stanie wibracyjnym i rotacyjnym. Różnica między dwoma sąsiednimi poziomami wibracyjnymi jest znacznie mniejsza niż różnica między sąsiednimi poziomami elektronowymi, a różnica między sąsiednimi poziomami rotacyjnymi jest jeszcze mniejsza. Kiedy elektron przemieszcza się z jednego poziomu elektronowego na drugi, przemieszcza się z danego poziomu wibracyjnego i rotacyjnego na tym poziomie elektronowym do pewnego poziomu wibracyjno-rotacyjnego na następnym poziomie. Badana próbka zawiera dużą liczbę cząsteczek i nawet jeśli wszystkie z nich znajdują się w podstawowym stanie elektronowym, to nadal występują różne stany wibracyjne i rotacyjne, chociaż największą populację ma oczywiście podstawowy stan wibracyjny. Oznacza to, że absorbowane jest światło nie tylko o jednej długości fali, ale o kilku blisko siebie położonych, chociaż maksimum absorpcji odpowiada najbardziej prawdopodobnym przejściom elektronowym. Natomiast w cząsteczkach zawierających pewną ilość atomów dostępnych jest szereg, blisko siebie położonych, możliwych stanów wzbudzonych w wyniku czego rejestruje się stosunkowo szerokie pasmo absorpcji.
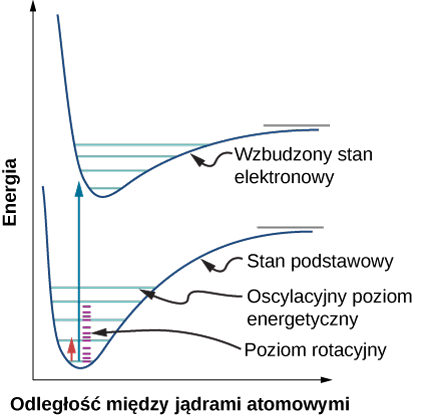
Przejścia czysto wibracyjne rejestrowane są w zakresie podczerwieni (spektroskopia IR), a czysto rotacyjne w zakresie bliskiej podczerwieni oraz zakresie mikrofalowym.
Ponieważ wzbudzenie elektronowe angażuje dwa, konkretne orbitale w mniejszym stopniu wpływając na resztę cząsteczki związku, to obecność w cząsteczce pewnych grup, jak np. wiązanie podwójne C=C, skutkuje absorpcją w pewnym określonym zakresie długości fali. Grupy, których obecność w cząsteczce związku powoduje absorpcję promieniowania elektromagnetycznego w danym zakresie noszą nazwę chromoforów.
Stany singletowe i tripletowe
W większości cząsteczek organicznych wszystkie elektrony w stanie podstawowym są sparowane, i zgodnie z zasadą Pauliego każdy elektron pary ma przeciwny spin. Kiedy jeden z pary elektronów jest wzbudzany na orbital o wyższej energii, dwa elektrony nie zajmują już ego samego orbitalu, a wzbudzony elektron może mieć taki sam lub przeciwny spin. Cząsteczka, w której dwa niesparowane elektrony mają ten sam spin, znajduje się w stanie tripletowym, podczas gdy wszystkie spiny są sparowane, stan nosi nazwę singletowego. W większości przypadków stan tripletowy ma niższą energię niż odpowiadający mu stan singletowy, co jest zgodne z regułą Hunda. W związku z tym do wzbudzenia elektronu ze stanu podstawowego (który jest prawie zawsze singletem) do wzbudzonego stanu singletowego, a nie do odpowiadającego mu stanu tripletowego, wymagana jest inna ilość energii, a tym samym inna długość fali. Wydawałoby się więc, że wzbudzenie danego elektronu w cząsteczce może skutkować stanem wzbudzenia singletowego lub tripletowego w zależności od ilości zaabsorbowanej energii. Jednak często tak się nie dzieje, ponieważ przejścia między poziomami energii są regulowane przez reguły wyboru, które stanowią, że pewne przejścia są „zabronione”. Istnieje kilka rodzajów przejść „zabronionych”, z których dwa są spełniane bardziej rygorystycznie.
- Przejścia zabronione spinowo. Przejścia, w których zmienia się spin elektronu, są niedozwolone, ponieważ zmiana spinu na przeciwny pociąga za sobą zmianę momentu pędu i taka zmiana naruszyłaby prawo zachowania momentu pędu. Dlatego przejścia singlet–triplet i triplet–singlet są zabronione, natomiast przejścia singlet–singlet i triplet–triplet są dozwolone.
- Przejścia zabronione przez symetrię. Ta reguła dotyczy cząsteczek posiadających środek symetrii. W takich przypadkach przejścia g→g lub u→u są „zabronione”, podczas gdy g→u lub u→g jest dozwolone. (g – symetryczne, u- antysymetryczne względem środka symetrii)
Słowo „zabronione” zostało wzięte w cudzysłów ponieważ przejścia te nie tyle są zabronione co wysoce nieprawdopodobne. Reguła zabraniająca przejść ze zmianą spinu jest silniej przestrzegana, chociaż gdy w cząsteczce związku organicznego znajdzie się ciężki atom, jak przykładowo jod, wzbudzenia singlet–triplet najprawdopodobniej są rejestrowane. Przejścia zabronione symetrią są często obserwowane na widmach absorpcyjnych ale ich intensywność jest niska.
Rodzaje przejść elektronowych w związkach organicznych
W przypadku cząsteczek związków organicznych mamy do czynienia z czterema rodzajami wzbudzenia elektronowego zgodnie ze wzrastającą energią wzbudzenia:
- σ → σ* - alkany.
- n → σ* - alkohole, aminy, etery.
- π → π* - alkeny, aldehydy, estry.
- n → π* - aldehydy, ketony, estry.
Obecność sprzężonych wiązań podwójnych w cząsteczce związku powoduje przesunięciu maksimum absorpcji w kierunku dłuższych fal (niższych energii).
Maksima absorpcji układów CH3–(CH2=CH2)n–CH3 dla wybranych wartości n.
| n | λ nm |
| 2 | 227 |
| 3 | 263 |
| 6 | 352 |
| 9 | 413 |
Podstawniki znajdujące się otoczeniu grup chromoforowych mogą wpływać na położenie maksimum absorpcji danego chromoforu. Podstawniki zawierające wiązania podwójne lub heteroatomy z wolnymi parami elektronowymi powodują przesunięcie maksimum absorpcji w kierunku dłuższych fal – efekt batochromowy. Przeciwieństwem jest efekt hipsochromowy, czyli przesunięcie maksimum absorpcji w kierunku wyższych energii. Niektóre grupy wprowadzone do cząsteczki związku powodują przesunięcie maksimum pasma absorpcyjnego oraz zmianę natężenia pasma, grupy takie noszą nazwę auksochromów.
Cząsteczka absorbując kwant światła, przechodzi do stanu wzbudzonego. W rzeczywistości nie jest to jedyny możliwy skutek. Ponieważ energia światła widzialnego i UV jest tego samego rzędu wielkości, co energia wiązań kowalencyjnych, inną możliwością jest fragmentacja cząsteczki w procesie znanym jako fotoliza. Istnieją trzy przypadki, które mogą prowadzić do zerwania wiązania:
– wzbudzenie może doprowadzić cząsteczkę do tak wysokiego poziomu wibracyjnego, że nastąpi zerwanie wiązania;
– nawet jeśli wzbudzenie prowadzi do niższych poziomów wibracyjnych, cząsteczka może ulec rozpadowi. W stanach wzbudzonych odległości równowagowe (długości wiązań) są większe niż w stanie podstawowym. Zgodnie z zasadą Francka–Condona wzbudzenie elektronu zachodzi znacznie szybciej niż pojedyncza wibracja cząsteczki (wzbudzenie trwa 10–15 s; drganie 10–12 s). Z tego powodu, gdy elektron zostaje wzbudzony, nawet do stosunkowo niskoenergetycznego poziomu wibracyjnego, odległość między atomami pozostaje zasadniczo niezmieniona, czyli wiązanie pomiędzy atomami staje się wysokoenergetyczne. W takim wypadku czynnik zewnętrzny może spowodować zerwanie wiązania i uwolnienie nadmiaru energii zlokalizowanego w obszarze wiązania;
– w niektórych przypadkach stan wzbudzony jest stanem całkowicie dysocjacyjnym, czyli pozbawionym minimum energetycznego dla pewnej odległości pomiędzy atomami. Przykładem jest cząsteczka wodoru, gdzie wzbudzenie s → s* zawsze powoduje dysocjację cząsteczki na atomy wodoru.
W wyniku rozpadu fotolitycznego mogą powstać dwie, mniejsze cząsteczki lub dwa rodniki. Znane są przypadki gdy fotoliza prowadzi do wytworzenia dwóch jonów.
Czas życia cząsteczki w stanie wzbudzonym jest ograniczony. W większości przypadków wzbudzenie ma charakter przejścia ze stanu S0 do S1, czyli przejścia od singletowego stanu podstawowego do pierwszego singletowego stanu wzbudzonego. Wzbudzenia ze stanów S0 do stanów tripletowych są „zabronione”. Wzbudzenie do S2 i wyższych stanów singletowych mają miejsce, ale w cieczach i ciałach stałych te wyższe stany wzbudzone zwykle bardzo szybko ulegają konwersji do stanu S1 (10–13– 10–11 s). Energia wzbudzenia w procesie przejścia ze stanów S2, S3 do S1 jest rozpraszana w wyniku zderzeń z sąsiednimi cząsteczkami. Proces taki nazywany jest kaskadą energetyczną. W podobny sposób zachodzi proces dyssypacji energii kolejnych poziomów wibracyjnych na danym poziomie wzbudzonym. Z tego powodu w większości przypadków najniższy poziom wibracyjny stanu S1 jest jedynym istotnym singletowym stanem wzbudzonym. Stan ten może podlegać różnym procesom fizycznym i chemicznym.
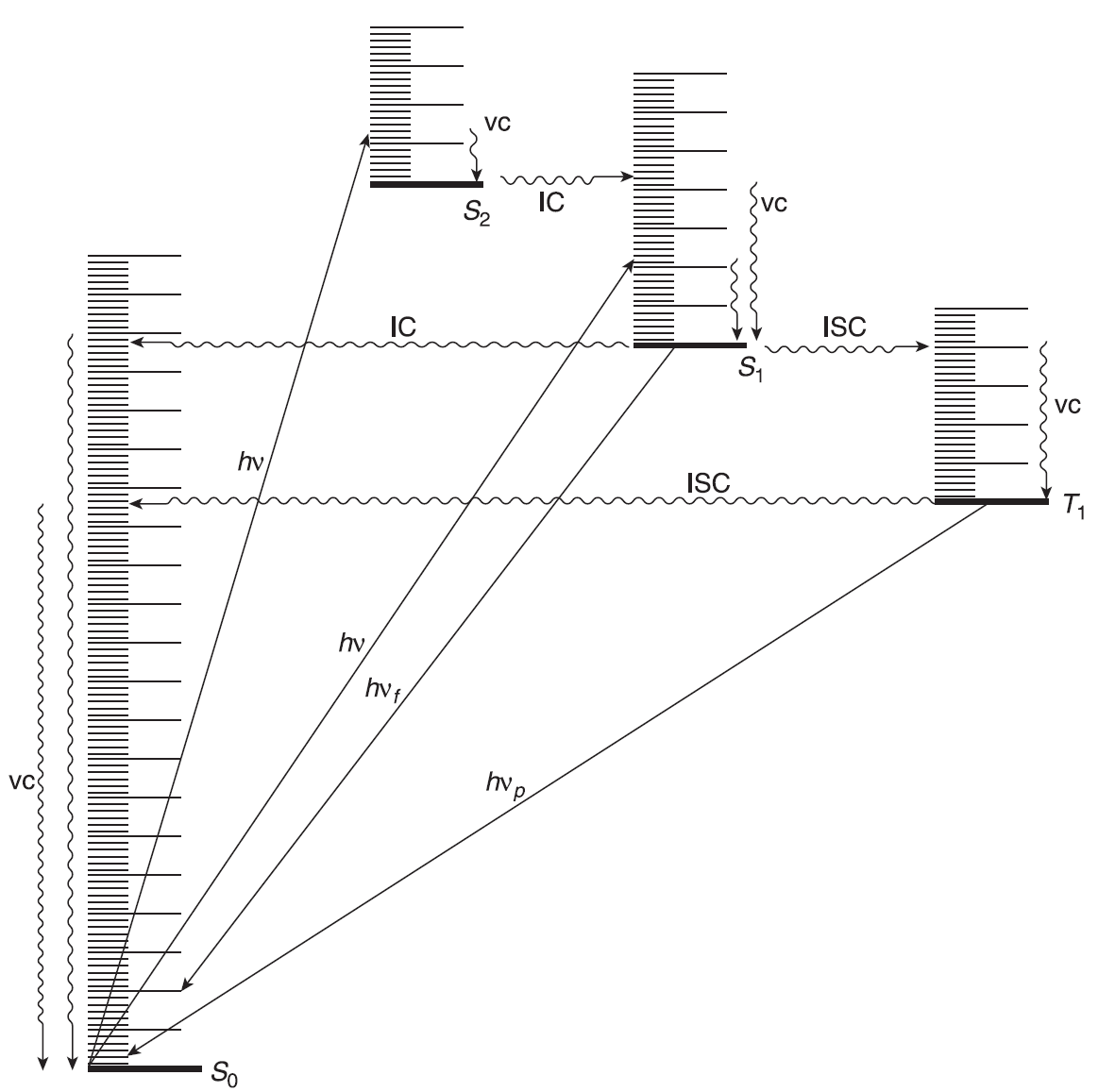 Zmodyfikowany diagram Jabłońskiego przedstawiający przejścia między stanami wzbudzonymi a stanem podstawowym. Procesy promieniste są przedstawiane liniami prostymi, procesy bezpromieniste falistymi. vc – kaskada wibracyjna; hvf – fluorescencja; hvp – fosforescencja.
Zmodyfikowany diagram Jabłońskiego przedstawiający przejścia między stanami wzbudzonymi a stanem podstawowym. Procesy promieniste są przedstawiane liniami prostymi, procesy bezpromieniste falistymi. vc – kaskada wibracyjna; hvf – fluorescencja; hvp – fosforescencja.
Cząstka znajdująca się w pierwszym singletowym lub tripletowym stanie wzbudzonym może ulegać następującym przemianom fizycznym i chemicznym:
- Cząsteczka w stanie S1 może kaskadowo tracić energię przechodząc przez poszczególne poziomy wibracyjne stanu S0, a tym samym powrócić do stanu podstawowego, ale proces taki przebiega dość wolno ze względu na znaczną ilość energii wzbudzenia. Proces ten nosi nazwę konwersji wewnętrznej (IC). Ze względu na długi czas takiego procesu, większość cząsteczek w stanie S1 podąża innymi ścieżkami dyssypacji energii.
- Cząsteczka w stanie S1 może znaleźć się na pewnym, niskim poziomie wibracyjnym stanu S0, emitując energię w postaci światła. Ten proces, który zwykle następuje w ciągu 10–9 s, nazywa się fluorescencją. Ten proces również nie jest częsty gdyż jest stosunkowo wolny. W przypadku większości związków fluorescencja jest bardzo słaba lub niewykrywalna. Fluorescencja prawie zawsze jest wynikiem przejścia S1 → S0, choć w przypadku niektórych związków aromatycznych, np. azulenu i jego prostych pochodnych, fluorescencja wynika z przejścia S2 → S0.
- Większość cząsteczek (choć w żadnym wypadku nie wszystkie) w stanie S1 może w wyniku przejścia wewnątrzsystemowego (ISC) znaleźć się na najniższym stanie tripletowym T1. Przykładem jest benzofenon, który po wzbudzeniu ulega całkowicie konwersji ze stanu S1 do T1. Przejście międzysystemowe ze stanu singletowego do tripletowego jest oczywiście procesem „zabronionym”, ale przejścia międzysystemowe odbywają się bez straty energii. Ponieważ stan singletowy ma zwykle wyższą energię niż odpowiadający mu triplet, a w związku z tym cząsteczka w stanie T1 ulega szybkiemu procesowi kaskadowej utraty energii wibracyjnej (10–12 s).
- Cząsteczka w stanie T1 może powrócić do stanu S0, oddając ciepło (przejście międzysystemowe) lub emitując światło w procesie zwanym fosforescencją, który przebiega znacznie wolniej (10–3– 101 s) niż fluorescencja. Stany T1 są generalnie znacznie trwalsze niż stany S1. Fosforescencja występuje przy dłuższych falach niż fluorescencja (z powodu większej różnicy energii między S1 i S0 niż między T1 i S0) i trwa znacznie dłużej, ze względu na większą trwałość stanu T1.
- Jeśli żaden z [powyższych procesów nie zachodzi cząsteczka w stanie wzbudzonym (S1 lub T1) może przenieść posiadaną nadwyżkę energii na inną cząsteczkę w procesie zwanym fotosensybilizacją. Wzbudzona cząsteczka (D) przechodzi w ten sposób do stanu S0, podczas gdy inna cząsteczka (A) zostaje wzbudzona:
D* + A → D + A*
Zatem cząsteczka może osiągnąć stan wzbudzony na dwa sposoby: przez absorpcję kwantu światła lub transfer energii od wcześniej wzbudzonej cząsteczki. Cząsteczka D* jest nazywana fotouczulaczem. Ten transfer energii podlega zasadzie zachowania spinu Wignera, która jest w rzeczywistości szczególnym przypadkiem prawa zachowania pędu. Zgodnie z regułą Wignera całkowity spin elektronów nie zmienia się w procesie przeniesienia energii.
|
D* |
A |
|
D |
A* |
|
|
(↑↑)* + |
↑↓ |
→ |
↑↓ + |
(↑↑)* |
singlet + triplet |
|
|
|
→ |
↑↑↓ + |
↑ |
dublet + dublet (dwa rodniki) |
|
|
|
→ |
↑↑ + |
↓ + ↑ |
triplet + dwa dublety |
|
|
|
→ |
↑↓ + |
↑ + ↑ |
singlet + dwa dublety |
W każdym przypadku mamy trzy spiny „w górę” i cztery „w dół” tak jak po lewej stronie równania, czyli zasada zachowania spinu jest spełniona.
W przypadku dwóch najważniejszych typów fotosensybilizacji tripletowy stan wzbudzony generuje kolejny triplet, a wzbudzony stan singletowy generuje kolejny singlet.
DT1 + AS0 → AT1 + DS0
DS1 + AS0 → AS1 + DS0
- Cząsteczka wzbudzona może ulec procesowi wygaszenia, czyli dezaktywacji w wyniku oddziaływań międzycząsteczkowych lub wewnątrzcząsteczkowo w procesach bezpromienistych. Typowe mechanizmy tych procesów obejmują transfer energii i przenoszenie ładunku.
- Cząsteczki wzbudzone mogą ulegać również procesom chemicznym takim jak rozpad na rodniki, rozkład z utworzeniem cząsteczek obojętnych, wewnętrznemu przegrupowaniu, fotoizomeryzacji, fotodimeryzacji itp.