 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Kinetyka chemiczna
Kinetyka chemiczna
Kinetyka chemiczna jest działem chemii, w którym omawia się zagadnienia szybkości i mechanizmu reakcji chemicznych (mechanizmy reakcji zostały omówione w odrębnym miejscu serwisu). Termin szybkość reakcji jest używany do opisu szybkości z jaką przebiega reakcja chemiczna. Termin mechanizm natomiast jest używany do opisu kolejnych etapów reakcji , które składają się na przemianę chemiczną. W wielu reakcjach obserwuje się jedynie zanik substancji wyjściowych (substratów) i pojawienie się produktów końcowych, czyli obserwuje się jedynie reakcję sumaryczną. Jednak w większości przypadków reakcja sumaryczna tylko opisuje całość zmian jakie zaszły. Przemiana sumaryczna może składać się z kilku kolejnych reakcji, które stanowią poszczególne etapy tworzenia produktu końcowego. Przy rozpatrywaniu reakcji chemicznych istotne jest rozróżnianie reakcji sumarycznej i poszczególnych etapów przejściowych. Gdy reakcja przebiega wieloetapowo to prawdopodobnie tworzą się produkty przejściowe, których nie jesteśmy w stanie wykryć, ponieważ są zużywane w kolejnych reakcjach pośrednich. Jednak badając wpływ różnych czynników na szybkość reakcji sumarycznej można wnioskować o produktach przejściowych i ich roli w mechanizmie reakcji. Czynnikami jakie wpływają na szybkość reakcji ą właściwości substancji reagujących, ich stężenie, temperatura i obecność katalizatorów.
Właściwości substancji reagujących
W reakcji chemicznej następuje zrywanie wiązań chemicznych i tworzenie nowych. W związku z tym szybkość reakcji będzie zależała od charakteru wiązań biorących udział w reakcji. Przykładowo redukcja jonu manganianowego(VII) w środowisku kwaśnym za pomocą siarczanu(VI) żelaza(II) jest praktycznie natychmiastowa. Fioletowe zabarwienie pochodzące od jonu MnO4– zanika natychmiastowo z taką szybkością z jaką dodawany jest roztwór FeSO4. Tutaj czynnikiem decydującym jest szybkość mieszania roztworów. Natomiast redukcja tego samego jonu Mn(VII) w środowisku kwaśnym za pomocą kwasu szczawiowego jest znacznie wolniejsza. Charakterystyczna barwa jonu manganianowego(VII) utrzymuje się przez dłuższy czas po zmieszaniu roztworów. Jak widać czynnikiem decydującym o szybkości reakcji redukcji jonu manganianowego(VII) są właściwości czynnika redukującego.
Stężenie substancji reagujących
Doświadczalnie stwierdzono, że szybkość reakcji homogenicznej (jednofazowej) zależy od stężenia reagentów. Reakcje heterogeniczne, w których substancje reagujące znajdują się w różnych fazach przebiegają z szybkością zależną od powierzchni zetknięcia się faz. Szybkość reakcji homogenicznej zależy w zasadzie od stężenia reagentów w roztworze. Dla roztworów gazowych stężenia można zmieniać przez zmianę ciśnienia. W roztworach ciekłych stężenia poszczególnych reagentów można modyfikować poprzez ich dodanie lub usuwanie , lub tez poprzez zmianę ilości rozpuszczalnika. Natomiast efekty zmiany stężenia można stwierdzić jedynie na drodze doświadczalnej związanej z szeregiem trudności. Zazwyczaj rejestruje się zmiany stężenia jednej z substancji przy ustalonych wszystkich pozostałych parametrach reakcji. Trudności doświadczalne związane są z koniecznością wyznaczania stężenia składnika w danej chwili ponieważ stężenie zmienia się w czasie. W każdym razie ogólny wzór określający szybkość reakcji:
nA + mB → pC + qD
ma postać:
szybkość reakcji = k[A]α[B]β[x]γ
gdzie: α, β, γ - wykładniki potęg do których należy podnieść stężenia substancji A, B i X, przy czym X oznacza stężenie substancji nie występującej w sumarycznym równaniu reakcji, ale która może być związana z równaniem kinetycznym. Wykładniki α, β, γ są zazwyczaj liczbami całkowitymi, ale mogą też być ułamkami, równać się 0 lub być liczbami ujemnymi. Ujemny wykładnik oznacza odwrotną proporcjonalność, gdy wzrost stężenia danego substratu powoduje zmniejszenie szybkości reakcji. Wartości;α, β, γ określają rząd reakcji względem A, B, … .Jeżeli α=1 to reakcja jest pierwszego rzędu względem A, jeżeli α=2 to reakcja jest rzędu drugiego względem A itd. Ogólny rząd reakcji oznacza suma α +β + γ … . Należy pamiętać, że równanie szybkości reakcji ustala się doświadczalnie, a współczynniki zbilansowanego równania reakcji sumarycznej nie są równe wykładnikom potęgi w równaniu kinetycznym reakcji, czyli wykładnikom α, β, γ, …. .
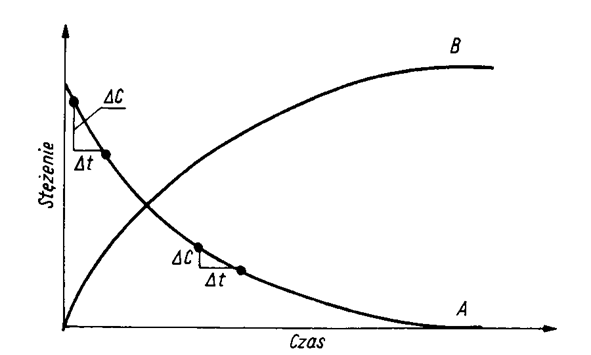 Stężenia i szybkość reakcji zmieniają się w czasie zgodnie z równaniem kinetycznym, tak jak to pokazano na rysunku obok. Ponieważ pomiędzy A i B istnieje zależność stechiometryczna to szybkość przemiany chemicznej można opisać jako szybkość zaniku A, albo jako szybkość przyrastania B. Jak widać szybkość zmiany stężenia A nie jest stała, a można ją opisać poprzez zmniejszenie się nachylenia krzywej w miarę upływu czasu. Matematycznie określa to pochodna opisana wzorem:
Stężenia i szybkość reakcji zmieniają się w czasie zgodnie z równaniem kinetycznym, tak jak to pokazano na rysunku obok. Ponieważ pomiędzy A i B istnieje zależność stechiometryczna to szybkość przemiany chemicznej można opisać jako szybkość zaniku A, albo jako szybkość przyrastania B. Jak widać szybkość zmiany stężenia A nie jest stała, a można ją opisać poprzez zmniejszenie się nachylenia krzywej w miarę upływu czasu. Matematycznie określa to pochodna opisana wzorem:
![]()
gdzie ΔCA jest różnicą pomiędzy CA w momencie t+Δt i CA w momencie t. Wyraz dC/dt można odczytać jako przyrost C podzielony przez przyrost t, czyli jest on nachyleniem krzywej C w zależności od czasu t. Dla reakcji A → B, której szybkość zależy od stężenia A w pierwszej potędze równanie kinetyczne można zapisać w formie:
![]()
Znak minus wynika z faktu, że stężenie A maleje w czasie reakcji. Stała szybkości reakcji k wyznaczona z tego równania wynosi:
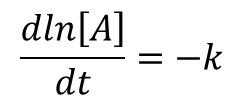
Z czego wynika, że dla reakcji pierwszego rzędu wykres zależności ln[A] od czasu jest linią prostą o stałym nachyleniu równym –k. Inaczej mówiąc stosunek zmiany stężenia do czasu jest stały i niezależny od czasu. Oznacza to również, ze czas potrzebny do przereagowania połowy reagenta (jaka jeszcze pozostała) jest stały. Oczywiście w miarę upływu czasu stężenie reagenta maleje ale czas potrzebny do zmniejszenia jego ilości do połowy pozostaje stały przez co reakcja przebiega coraz wolniej. Czas półtrwania dla reakcji pierwszego rzędu określa zależność:
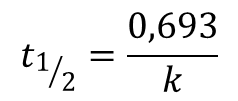
gdzie współczynnik 0,693 jest logarytmem naturalnym z 2.
Temperatura
Wzrost temperatury zazwyczaj zawsze powoduje wzrost szybkości reakcji. Spadek temperatury zazwyczaj zawsze powoduje zmniejszenie szybkości reakcji, niezależnie czy jest to reakcja endo– czy egzotermiczna. Zmiana szybkości reakcji ze zmianą temperatury wyraża się w zmianie stałej szybkości reakcji. Dla każdej reakcja k wzrasta wraz ze wzrostem temperatury, ale wielkość tego efektu jest różna dla różnych reakcji. Z dużym przybliżeniem można powiedzieć, że wzrost temperatury o 10K powoduje dwu– lub trzykrotny wzrost szybkości reakcji. Zależność pomiędzy stałą szybkości reakcji a temperaturą wyraża równanie Arrheniusa:
k = Ae–E/RT
gdzie: A jest stałą charakterystyczną dla danej reakcji; e – podstawa logarytmu naturalnego; E – energia aktywacji reakcji; R – stała gazowa równa 8,314 J/mol·K. Zależność k od T jest wykładnicza dlatego też małe zmiany temperatury powodują znaczne zmiany szybkości reakcji.
Teoria zderzeń
Wiele zaobserwowanych zjawisk dotyczących kinetyki chemicznej można wyjaśnić na gruncie teorii zderzeń. Zgodnie z tą teorią reakcja chemiczna może zajść wtedy gdy nastąpi zderzenie cząsteczek reagentów. W zderzeniu następuje przegrupowanie atomów i wiązań co powoduje powstanie nowej substancji (produktu). Zgodnie z teorią zderzeń szybkość każdego etapu reakcji jest wprost proporcjonalna do:
- liczby zderzeń w jednostce czasu cząstek biorących udział w danym etapie;
- stosunku zderzeń efektywnych do całkowitej liczby zderzeń.
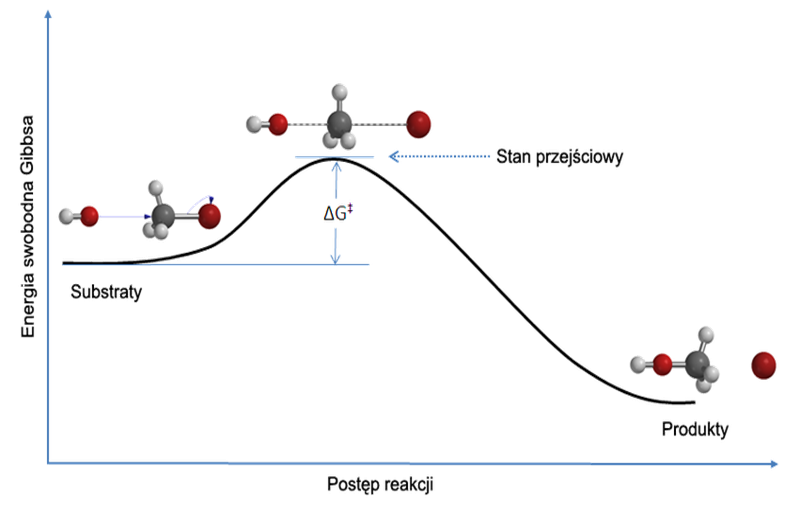 Nie wszystkie zderzenia są efektywne chociażby ze względu na szybkość poruszających się cząstek. Ponadto chmury elektronowe zderzających się cząstek odpychają się co wymusza odpowiednią energię zderzenia konieczną do zajścia reakcji. Nadmiar energii potrzebny do zajścia reakcji chemicznej nosi nazwę energii aktywacji. Niektóre reakcje wymagają dużej energii aktywacji, i z tego powodu przebiegają powoli gdyż tylko niewielka liczba zderzeń jest efektywna. Inne charakteryzuje niska energia aktywacji, są to reakcje szybkie gdyż większość zderzeń cząsteczek substratów jest efektywna. Teoria zderzeń jakościowo wyjaśnia wpływ czterech czynników wymienionych powyżej na szybkość reakcji:
Nie wszystkie zderzenia są efektywne chociażby ze względu na szybkość poruszających się cząstek. Ponadto chmury elektronowe zderzających się cząstek odpychają się co wymusza odpowiednią energię zderzenia konieczną do zajścia reakcji. Nadmiar energii potrzebny do zajścia reakcji chemicznej nosi nazwę energii aktywacji. Niektóre reakcje wymagają dużej energii aktywacji, i z tego powodu przebiegają powoli gdyż tylko niewielka liczba zderzeń jest efektywna. Inne charakteryzuje niska energia aktywacji, są to reakcje szybkie gdyż większość zderzeń cząsteczek substratów jest efektywna. Teoria zderzeń jakościowo wyjaśnia wpływ czterech czynników wymienionych powyżej na szybkość reakcji:
- Szybkość reakcji zależy od reagujących substratów ponieważ energia aktywacji jest różna dla różnych reakcji;
- Szybkość reakcji zależy od stężenia reagentów gdyż liczba zderzeń wzrasta wraz ze wzrostem stężenia;
- Szybkość reakcji zależy od temperatury ponieważ wraz ze wzrostem temperatury zwiększa się prędkość cząsteczek, zderzenia są liczniejsze i co istotne bardziej energetyczne przez co kończą się reakcją. Każdy zbiór cząsteczek charakteryzuje się pewnym rozkładem energii. Zgodnie z teorią zderzeń tylko cząsteczki bogate w energię są zdolne do reakcji. Wraz ze wzrostem temperatury maksimum krzywej rozkładu energii przesuwa się w kierunku większych energii i wzrasta liczba cząstek o dużej energii, tym samym zwiększając liczbę zderzeń efektywnych. W równaniu Arrheniusa wielkość A można uważać za liczbę zderzeń, a człon wykładniczy za ułamek zderzeń efektywnych;
- Szybkość reakcji wzrasta w obecności katalizatora ponieważ katalizator zwiększa liczbę zderzeń efektywnych. Dzieje się tak na przykład gdy jeden lub więcej reagentów reaguje z katalizatorem tworząc cząsteczki, które wymagają mniejszej energii aktywacji.
Reakcje wielostopniowe (następcze)
Reakcje następcze to takie, w których produkty powstają z substratów dwuetapowo lub wieloetapowo, poprzez produkty przejściowe, powstające w kolejnych reakcjach elementarnych. Sposób analizy szybkości reakcji następczych prześledźmy na przykładzie procesu dwuetapowego, złożonego z dwóch reakcji prostych pierwszego rzędu:
A → B → C
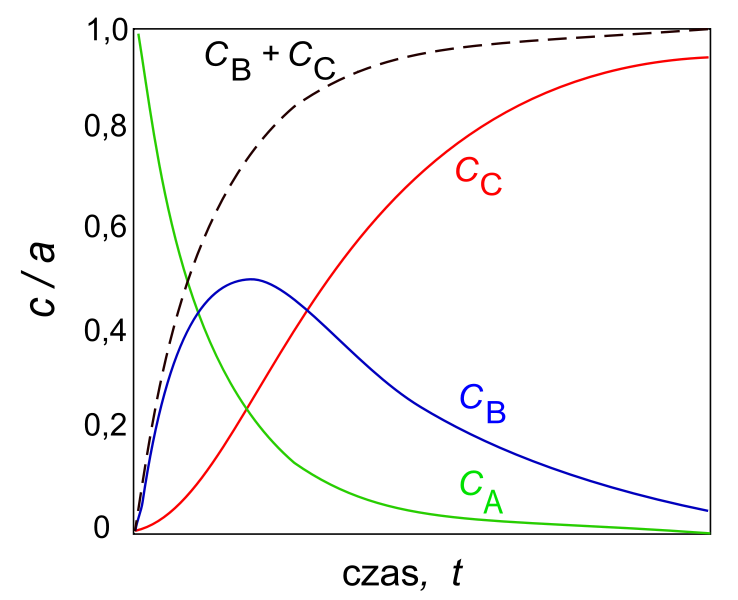 Jeżeli proces zachodzi w układzie termodynamicznie zamkniętym sumaryczne stężenie (c} wszystkich trzech reagentów nie ulega zmianom w czasie, a więc w każdej chwili jest spełniona zależność:
Jeżeli proces zachodzi w układzie termodynamicznie zamkniętym sumaryczne stężenie (c} wszystkich trzech reagentów nie ulega zmianom w czasie, a więc w każdej chwili jest spełniona zależność:
a = cA + cB + cC
gdzie a – początkowe stężenie substratu A. Szybkość reakcji wyraża się jako szybkość zmian stężenia substratu lub produktu w czasie. W przypadku reakcji I rzędu szybkość zmian stężenia substratu (A) w wyniku reakcji pierwszej (A → B, stała szybkości reakcji – k1) wyraża równanie:
![]()
lub po scałkowaniu i przekształceniu:
![]()
Produkt pośredni B (produkt reakcji 1 i substrat reakcji 2) początkowo gromadzi się w układzie, ponieważ szybkość reakcji A → B jest większa od B → C. W tym okresie zmniejsza się stężenie cA, a stężenie cB rośnie, co powoduje zmniejszanie się szybkości reakcji 1 i wzrost szybkości reakcji 2 (powstawanie produktu końcowego C). W kolejnym okresie stężenie cA zbliża się do zera, a cB osiąga wartość maksymalną w danych warunkach zewnętrznych. W następnym okresie obserwuje się stopniowe zmniejszanie się stężenia cB i wzrost stężenia cC,