 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Elektroujemność
Elektroujemność
Elektroujemność została zdefiniowana przez Paulinga jako zdolność atomu w cząsteczce do przyciągania elektronów. Jest pojęciem pozwalającym przewidywanie polarności wiązania chemicznego pomiędzy dwoma pierwiastkami, a pośrednio na przewidywanie reaktywności związków chemicznych. Pierwszą skalę liczbową elektroujemności wprowadził Pauling, opierając się na teorii wiązań walencyjnych, uznając, że elektroujemność przejawia się poprzez wzrost trwałości spowodowany domieszaniem jonowej formy rezonansowej do cząsteczkowej funkcji falowej. Wartości liczbowe skali elektroujemności Pauling otrzymał opierając się na danych dotyczących energii wiązań, które przeliczał zgodnie z zaleznością:
![]() gdzie B(A–B) jest energią wiązania A–B w kJ/mol, a xA jest elektroujemnością pierwiastka A. Wartość 96 jako stałej została wybrana w celu wyrażenia wartości (xA – xB)2 w elektronowoltach.
gdzie B(A–B) jest energią wiązania A–B w kJ/mol, a xA jest elektroujemnością pierwiastka A. Wartość 96 jako stałej została wybrana w celu wyrażenia wartości (xA – xB)2 w elektronowoltach.
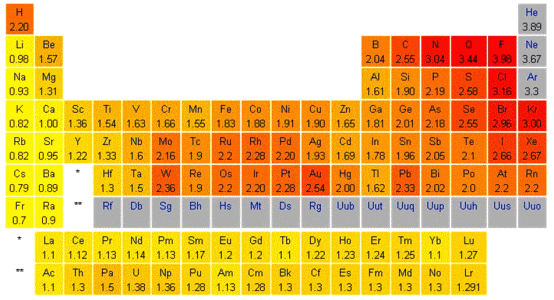 Skala opracowana przez Paulinga pozwala z dobrą dokładnością przewidywać energie wielu wiązań chemicznych. Obliczona energia wiązania P–Cl wynosi 331 kJ/mol. Wartość eksperymentalna wyznaczona dla PCl3 wynosi 325 kJ/mol. Obliczona na podstawie wartości ciepła tworzenia dla PCl5 wynosi 268 kJ/mol. Wynik nie jest zaskakujący od strony jakościowej gdyż wiązanie P–Cl jest spolaryzowane, przy czym atomy chloru posiadają większy ujemny ładunek. Dodanie dwóch następnych atomów chloru do PCl3 powoduje, że będą one z większą trudnością odciągać ładunek od atomu fosforu naładowanego dodatnio. Pauling przewidując taki stan rzeczy wprowadził regułę elektroobojętności do swoje teorii elektroujemności, zgodnie z którą ładunki cząstkowe ładunki pojedynczych atomów w cząsteczce muszą zawierać się w zakresie od +1 do –1. Wprowadzenie tej reguły wzbudziło pewne kontrowersje gdyż zgodnie z teorią wiązania chemicznego jego utworzenie polega ono na przekazywaniu elektronów (ładunku ujemnego) od atomów posiadających duży ładunek ujemny do tych, które posiadają ładunek dodatni, a to implikuje posiadanie znacznie większych od założonych przez Paulinga wartości ładunków ±1. Jednak z drugiej strony skoro znaczna część chmury elektronowej elektronów walencyjnych znajduje się w obszarze nakładania pomiędzy atomami to trudno ją przypisać do któregokolwiek z atomów tworzących wiązanie.
Skala opracowana przez Paulinga pozwala z dobrą dokładnością przewidywać energie wielu wiązań chemicznych. Obliczona energia wiązania P–Cl wynosi 331 kJ/mol. Wartość eksperymentalna wyznaczona dla PCl3 wynosi 325 kJ/mol. Obliczona na podstawie wartości ciepła tworzenia dla PCl5 wynosi 268 kJ/mol. Wynik nie jest zaskakujący od strony jakościowej gdyż wiązanie P–Cl jest spolaryzowane, przy czym atomy chloru posiadają większy ujemny ładunek. Dodanie dwóch następnych atomów chloru do PCl3 powoduje, że będą one z większą trudnością odciągać ładunek od atomu fosforu naładowanego dodatnio. Pauling przewidując taki stan rzeczy wprowadził regułę elektroobojętności do swoje teorii elektroujemności, zgodnie z którą ładunki cząstkowe ładunki pojedynczych atomów w cząsteczce muszą zawierać się w zakresie od +1 do –1. Wprowadzenie tej reguły wzbudziło pewne kontrowersje gdyż zgodnie z teorią wiązania chemicznego jego utworzenie polega ono na przekazywaniu elektronów (ładunku ujemnego) od atomów posiadających duży ładunek ujemny do tych, które posiadają ładunek dodatni, a to implikuje posiadanie znacznie większych od założonych przez Paulinga wartości ładunków ±1. Jednak z drugiej strony skoro znaczna część chmury elektronowej elektronów walencyjnych znajduje się w obszarze nakładania pomiędzy atomami to trudno ją przypisać do któregokolwiek z atomów tworzących wiązanie.
Z matematycznego punktu widzenia zgodnie z teorią orbitali cząsteczkowych wyznacznik sekularny dla dwuatomowej cząsteczki heterojądrowej ma postać:
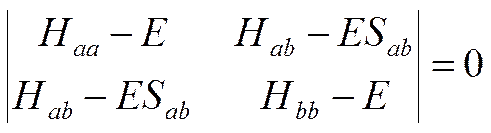 Z tego wynika, że elektroujemność ma związek z energią wiązania uwidocznioną przez różnicę pomiędzy wyrazami Haa i Hbb, które definiujemy jako energię wiązania orbitali atomów A i B. W ten sposób pomijamy efekty nakładania orbitali wyrażone przez Hab.–ESab.. Natomiast w równaniu zaproponowanym przez Paulinga nakładanie się orbitali (kowalencyjność wiązania) jest w pewien sposób uwzględniania przez wprowadzenie średniej (geometrycznej) energii wiązań homojądrowych cząsteczek A–A i B–B.
Z tego wynika, że elektroujemność ma związek z energią wiązania uwidocznioną przez różnicę pomiędzy wyrazami Haa i Hbb, które definiujemy jako energię wiązania orbitali atomów A i B. W ten sposób pomijamy efekty nakładania orbitali wyrażone przez Hab.–ESab.. Natomiast w równaniu zaproponowanym przez Paulinga nakładanie się orbitali (kowalencyjność wiązania) jest w pewien sposób uwzględniania przez wprowadzenie średniej (geometrycznej) energii wiązań homojądrowych cząsteczek A–A i B–B.
Natomiast w przypadku gdy różnica elektroujemności pomiędzy atomami w cząsteczce jest mała (Haa≈ Hbb) to pominięte wyrazy wyznacznika poza przekątną stają się znaczące, a wiązanie będzie miało charakter kowalencyjny. W przypadku gdy równiża elektroujemności pomiędzy atomami jest bardzo duża związek będzie miał wiązania jonowe i wtedy należy zrezygnować z ich opisu jako wiązań kowalencyjnych spolaryzowanych. Zamiast tego zastosowany zostanie model przyciągania pomiędzy jonami Madelunga. W układach, w których występują wiązania wielokrotne więcej niż jeden orbital atomowy bierze udział w tworzeniu wiązania A–B. To skłoniło niektórych chemików do wprowadzenia "elektroujemności orbitalnej" związanej z orbitalami atomowymi biorącymi udział w wiązaniu.
Istotnym elementem pojęcia elektroujemności jest fakt, że polarność czy siła wiązania A–B zależy nie tylko od atomów A i B lecz również od innych atomów znajdujących się w cząsteczce. Wiązania występujące w cząsteczkach nieorganicznych są zdelokalizowane, a siła i polarność tych wiązań zależą od stopni utlenienia i liczb koordynacyjnych atomów uczestniczących w wiązaniu.
Okazuje się, że szereg danych eksperymentalnych wykazuje zgodność z koncepcją elektroujemności rozumiana jako zdolność do przyciągania elektronów w cząsteczce. Należy jednak mieć na uwadze to aby nie mieszać wartości liczbowych elektroujemności odnoszących się do różnych liczb koordynacyjnych bądź różnych stopni utlenienia. Znacznie trudniej jest zmierzyć polarność wiązań chemicznych. Moment dipolowy nie jest wielkością w pełni wiarygodną gdyż nie zawsze można w sposób jednoznaczny określić orientację cząsteczki. Przykładowo dla wodorku telluru (H2Te) nie znamy kierunku stawienia cząsteczki a w związku z tym proste mnożeniu ładunku przez odległość zawodzi gdyż w tej cząsteczce ma miejsce znaczne nakładanie się orbitali, a gęstość chmury elektronowej jest nierówno rozłożona. Natomiast spektakularnym odkryciem w tym zakresie było stwierdzenie, że ujemny biegun dipola w cząsteczce tlenku węgla leży na atomie węgla. To wyjaśniło dlaczego w karbonylkach cząsteczka CO koordynuje poprzez węgiel (wiązanie M–C), co było sprzeczne z przewidywaniami opartymi na elektroujemności atomów węgla i tlenu. Moment dipolowy cząsteczki CO jest bardzo mały, a potrójne wiązanie pomiędzy węglem a tlenem (C≡O) skłania do ostrożnego traktowania prostych obliczeń opartych na koncepcji elektroujemności.
Spektroskopia kwadrupolowego rezonansu jądrowego pozwala mierzyć rozkład elektronów w cząsteczce. W przypadku halogenków, w których atom fluorowca tworzy wiązanie pojedyncze dane spektroskopowe odzwierciedlają wzrost jonowego charakteru wiązania wraz ze wzrostem różnicy elektroujemności pomiędzy atomami. Podwyższenie stopnia utlenienia jakiegoś pierwiastka powoduje zwiększenie kowalencyjnego charakteru wiązania tego pierwiastka z halogenem. W izoelektronowym szeregu AlCl4–, SiCl4, PCl4– ładunek na atomie centralnym wzrasta powoli pomimo, że jedyną zmiana zachodzącą w tym szeregu jest wzrost ładunku atomu centralnego – większa elektroujemność fosforu powoduje "odciągnięcie" chmury elektronowej od atomów chloru w stopniu wystraczającym do zrównoważenia wzrostu ładunku jąder.
| związek | wkład jonowości [%] |
ładunek na atomie centralnym |
|
SiCl4 |
63 | 2,52 |
|
PCl3 |
52 | 1,56 |
|
SCl2 |
28 | 0,58 |
|
PCl4– |
0 | 9 |
|
Cl2 |
41 | 2,64 |
|
PCl4+ |
45 | 1,70 |
|
PCl6– |
57 | 2.42 |
|
SbCl6– |
77 | 1.62 |
|
TeCl62– |
72 | 2.32 |
| AlCl4– | 81 | 2,24 |
|
NiCl62– |
93 | 1,32 |
|
CCl4 |
26 | 1,04 |
Poza skalą Paulinga zdefiniowano inne na podstawie różnych kryteriów. Mülliken zdefiniował elektroujemność jako średnią arytmetyczną z sumy energii jonizacji i powinowactwa elektronowego. Skala ta jest szeroko stosowana, ale pomimo tego, że definicja Müllikena zbliża pojęcie elektroujemności do energii orbitali to w niektórych przypadkach otrzymywane wyniki są znacznie przeszacowane. Przykładowo powinowactwo elektronowej jonu Cs+ w tej skali jest większe niż fluoru. Skalę tę można "ulepszyć" wprowadzając definicje powinowactwa elektronowego i energię jonizacji "stanu walencyjnego". Niestety takie podejście wymaga wprowadzenia hybrydyzacji co powoduje zaimplementowanie wszystkich wad jakie niesie ze sobą koncepcja orbitali zhybrydyzowanych. Ulepszeniem skali Müllikena było związanie energii jonizacji i powinowactwa elektronowego za pomocą równania kwadratowego i zdefiniowanie elektroujemności jako współczynnika różniczkowego ze względu na zmianę ładunku. Takie podejście odzwierciedla wzrost elektroujemności w miarę wzrostu ładunku na atomie.
Allred i Rochow stworzyli skalę elektroujemności związaną z wielkością oddziaływania elektrostatycznego na elektrony walencyjne wyrażając ją wzorem:
![]() gdzie νkor oznacza częstość poprawioną przez uwzględnienie efektów odpychania elektronowego, a χopt elektroujemność optyczną.
gdzie νkor oznacza częstość poprawioną przez uwzględnienie efektów odpychania elektronowego, a χopt elektroujemność optyczną.