 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Mechanizmy reakcji związków organicznych
Mechanizmy reakcji związków organicznych
W większości reakcji związków organicznych zerwaniu ulega jedno lub więcej wiązań kowalencyjnych. Możemy podzielić mechanizmy reakcji związków organicznych na trzy podstawowe typy.
- Jeśli zerwanie wiązania odbywa się w taki sposób, że obydwa elektrony tworzące wiązanie pozostają z jednym fragmentem, mechanizm nazywa się heterolitycznym. Takie reakcje niekoniecznie obejmują jonowe produkty pośrednie, chociaż zwykle tak jest. Ważne jest to, że elektrony zawsze są sparowane. W przypadku większości reakcji wygodnie jest nazwać jeden z reagentów czynnikiem atakującym, a drugi substratem; jako substrat należy oznaczać cząsteczkę dostarczającą węgiel do utworzenia nowego wiązania. Kiedy tworzą się wiązania węgiel-węgiel, konieczne jest arbitralne określenie, która substancja jest substratem, a która czynnikiem atakującym. W reakcjach heterolitycznych czynnik atakujący generalnie przenosi parę elektronów do substratu lub pobiera od niego parę elektronową. Czynnik, który posiada parę elektronową, nazywany jest nukleofilem, a reakcja, w której uczestniczy jest nukleofilowa. Czynnik, który przyjmuje parę elektronów, nazywany jest elektrofilem, a reakcja jest elektrofilowa. W reakcji, w której w cząsteczce związku następuje zerwanie wiązania, fragment ulegający odszczepieniu jest określany grupą opuszczającą.
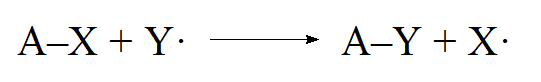
- Jeśli wiązanie zostaje zerwane w taki sposób, że każdy fragment zachowuje jeden elektron, powstają wolne rodniki i mówi się, że takie reakcje zachodzą w mechanizmie homolitycznym lub wolnorodnikowym.
- Trzeci typ reakcji to reakcja pericykliczna, podczas której stan przejściowy ma geometrię cykliczną, a sama reakcja przebiega w sposób uzgodniony (nazywany także skoordynowanym).
Generalnie wszystkie reakcje jakim ulegają związki organiczne można zaliczyć do sześciu kategorii.
- Substytucja (podstawienie). Jeśli reakcje tego rodzaju są heterolityczne, można je sklasyfikować jako nukleofilowe lub elektrofilowe, w zależności od tego, który reagent jest oznaczony jako substrat, a który jako reagent atakujący.
- Substytucja nukleofilowa
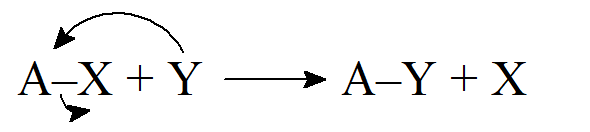
- Substytucja elektrofilowa
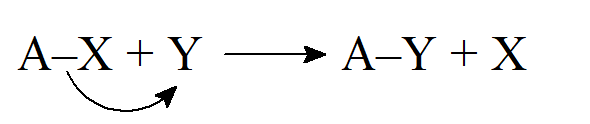
- Substytucja wolnorodnikowa
- Addycja do wiązań wielokrotnych. Reakcje te mogą zachodzić według trzech mechanizmów.
- Addycja elektrofilowa (heterolityczna)
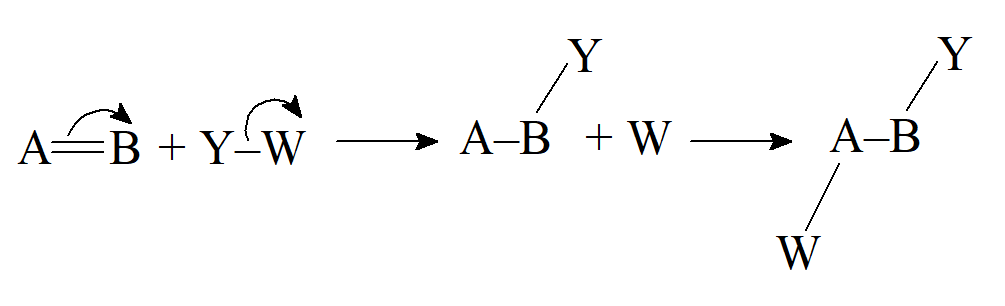
- Addycja nukleofilowa (heterolityczna)
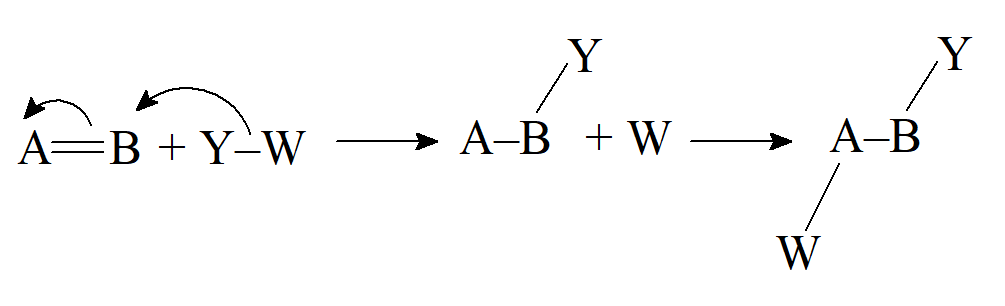
- Addycja wolnorodnikowa (homolityczna)
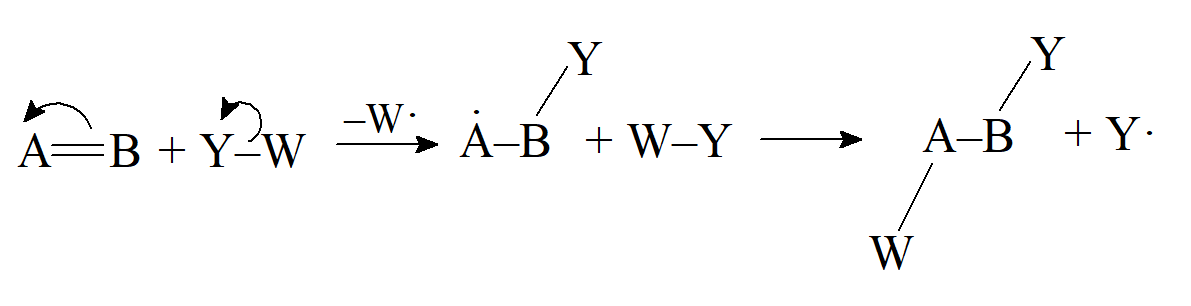
- Reakcja pericykliczna
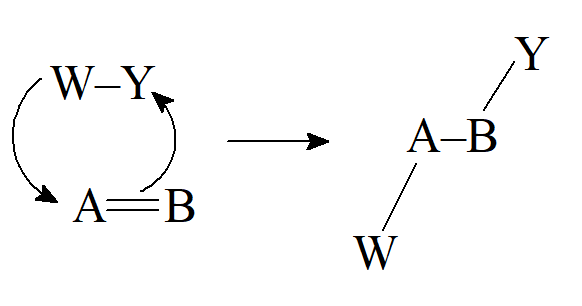
- β-eliminacja
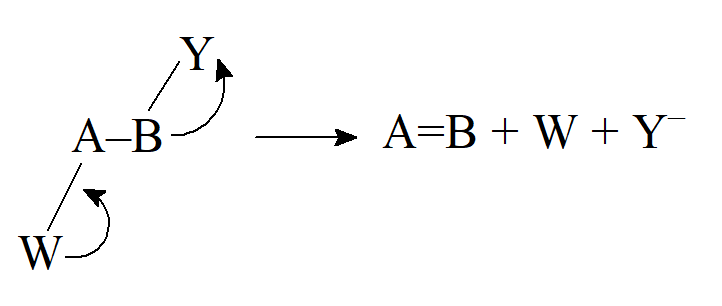
- Przegrupowanie. Wiele przegrupowań obejmuje migrację atomu lub grupy z jednego atomu do drugiego. Istnieją trzy typy, w zależności od tego, ile elektronów niesie ze sobą migrujący atom lub grupa.
- Przegrupowanie z parą elektronową (nukleofilowe)
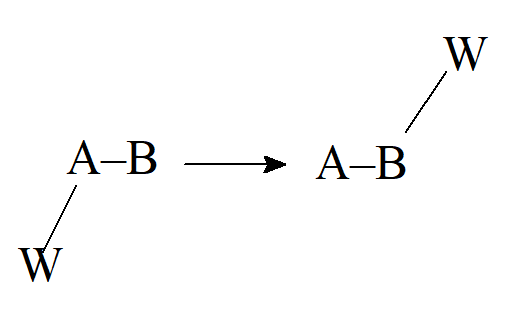
- Przegrupowanie jednoelektronowe (rodnikowe)
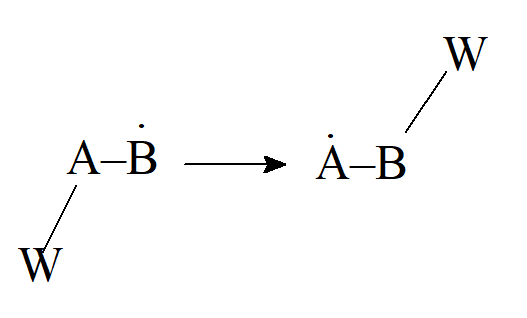
- Radko występujące przegrupowanie elektrofilowe
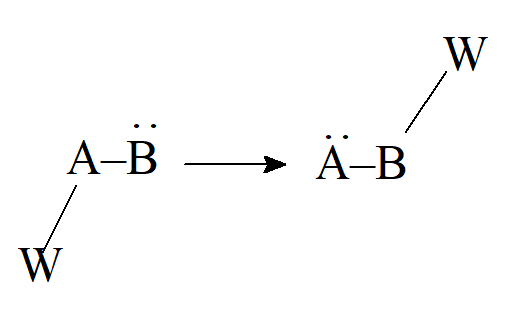
- Utlenianie i redukcja oraz kombinacje powyższych typów.
Aby reakcja zaszła spontanicznie, energia swobodna produktów musi być niższa niż energia swobodna reagentów; to znaczy G musi być ujemne. Oczywiście reakcje mogą przebiegać w odwrotnym kierunku, ale tylko wtedy, gdy dostarczona zostanie odpowiednia energia. Energia swobodna składa się z dwóch składników, entalpii H i entropii S, które to wielkości są powiązane równaniem:
ΔG = ΔH – TΔS
Zmiana entalpii w reakcji jest zasadniczo różnicą energii wiązania (w tym energii rezonansu, odkształcenia i solwatacji) między reagentami i produktami. Zmianę entalpii można obliczyć sumując energie wszystkich zerwanych wiązań, odejmując od tego sumę energii wszystkich utworzonych wiązań i dodając wszelkie zmiany energii rezonansu, odkształcenia lub solwatacji. Zmiany entropii są zupełnie inne i odnoszą się do nieuporządkowania lub przypadkowości systemu. Im mniejszy porządek w systemie, tym większa entropia. Preferowanymi warunkami w przyrodzie są niska entalpia i wysoka entropia, a w układach reagujących entalpia spontanicznie spada, podczas gdy entropia spontanicznie wzrasta. W przypadku wielu reakcji efekty entropowe są niewielkie i to właśnie entalpia decyduje głównie o tym, czy reakcja może zajść spontanicznie. Jednak w niektórych typach reakcji czynnik entropowy staje się na tyle istotny, że może dominować nad entalpią.
Ogólnie rzecz biorąc, ciecze mają niższe entropie niż gazy, ponieważ cząsteczki gazu mają znacznie więcej swobody i przypadkowości. Oczywiście ciała stałe charakteryzują się jeszcze niższymi entropiami. Każda reakcja, w której wszystkie reagenty są cieczami, a jeden lub więcej produktów jest gazem, jest zatem termodynamicznie faworyzowana przez zwiększoną entropię; stała równowagi dla tej reakcji będzie wyższa niż byłaby w innym przypadku. Podobnie entropia substancji gazowej jest wyższa niż tej samej substancji rozpuszczonej w rozpuszczalniku.
W reakcji, w której liczba cząsteczek produktu jest równa liczba cząsteczek substratów, na przykład A + B → C + D, efekty entropowe są zwykle małe, ale jeśli liczba cząsteczek po stronie produktów jest większa, na przykład A → B + C, występuje znaczny wzrost entropii. Reakcje, w których cząsteczka jest rozszczepiana na dwie lub więcej części, są zatem termodynamicznie faworyzowane przez czynnik entropowy. I odwrotnie, reakcje, w których liczba cząsteczek produktów jest mniejsza niż liczba cząsteczek substratów, wykazują spadek entropii i w takich przypadkach musi nastąpić znaczny spadek entalpii po stronie produktów, aby przezwyciężyć niekorzystną zmianę entropii.
Chociaż reakcje, w których cząsteczki są rozszczepiane na dwie lub więcej części, mają korzystne efekty entropowe, wiele potencjalnych rozpadów nie zachodzi z powodu dużego wzrostu entalpii. Przykładem jest rozszczepienie etanu na dwa rodniki metylowe. W tym przypadku wiązanie o energii ~79 kcal·mol–1 (330 kJ·mol–1) zostaje zerwane bez utworzenia żadnego nowego wiązania, które mogłoby skompensować wzrost entalpii. Jednak etan można rozłożyć w bardzo wysokich temperaturach, co ilustruje zasadę, że entropia staje się istotniejsza wraz ze wzrostem temperatury, jak wynika z równania ΔG = ΔH – TΔS; entalpia jest niezależna od temperatury, podczas gdy składnik entropowy jest wprost proporcjonalny do temperatury bezwzględnej.
Cząsteczka acykliczna ma większą entropię niż analogiczna cząsteczka cykliczna. Otwarcie pierścienia oznacza zatem zwiększenie entropii, a zamknięcie pierścienia jej obniżenie.
Tylko dlatego, że entalpia swobodna reakcji jest ujemna, niekoniecznie oznacza, że zajdzie ona w rozsądnym czasie. Ujemna wartość DG jest warunkiem koniecznym, ale niewystarczającym, aby reakcja zaszła spontanicznie. Na przykład reakcja między H2 i O2 prowadząca do H2O ma dużą ujemną wartość DG, ale mieszaniny wodoru i tlenu można utrzymywać w temperaturze pokojowej przez wiele stuleci bez żadnych znaczących reakcji. Aby reakcja zaszła, należy do układu dostarczyć energię aktywacji pozwalającą na utworzenie kompleksu aktywnego. Oczywiście energia aktywacji składa się z czynnika entalpowego i entropowego. Entalpia aktywacji jest różnicą energii wiązań, w tym energii odkształcenia, rezonansu i solwatacji, między związkami wyjściowymi a stanem przejściowym. Entropia aktywacji, która jest różnicą w entropii między związkami wyjściowymi a stanem przejściowym, staje się ważna, gdy dwie reagujące cząsteczki muszą zbliżyć się do siebie zachowując określoną orientację.
Entropia aktywacji jest również odpowiedzialna za trudność w zamykaniu pierścieni większych niż sześcioczłonowe. Rozważmy reakcję zamknięcia pierścienia, w której dwie oddziałujące grupy znajdują się na końcach 10-węglowego łańcucha. Aby nastąpiła reakcja, grupy muszą się spotkać. Ale łańcuch 10-węglowy ma wiele konformacji i tylko w kilku z nich końce łańcucha znajdują się blisko siebie. Zatem utworzenie stanu przejściowego wymaga dużej utraty entropii. Ten czynnik jest również obecny, chociaż w mniejszym stopniu, w procesach zamykania pierścienia o sześciu lub mniej członach (z wyjątkiem pierścieni trójczłonowych), ale w przypadku pierścieni o tej wielkości utrata entropii jest mniejsza niż w przypadku połączenia dwóch pojedynczych cząsteczek. Na przykład reakcja między grupą OH i grupą COOH w tej samej cząsteczce w celu utworzenia laktonu z pięcio- lub sześcioczłonowym pierścieniem zachodzi znacznie szybciej niż ta sama reakcja między cząsteczkami, z których jedna zawiera grupę OH a inną COOH. chociaż entalpia aktywacji jest mniej więcej taka sama, a entropia aktywacji jest znacznie mniejsza w przypadku związku cyklicznego. Jednakże, jeśli zamykany jest pierścień trzy– lub czteroelementowy, następują stosunkowo niewielkie odkształcenia i korzystna zmiana entropii aktywacji może nie wystarczyć do przezwyciężenia niekorzystnej zmiany entalpii aktywacji. Reakcje, w których stan przejściowy jest bardziej nieuporządkowany niż substraty, na przykład pirolityczny rozkład cyklopropanu do propenu, mają dodatnią wartość entropii aktywacji i z tego względu są uprzywilejowane ze względu na czynnik entropowy.