 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
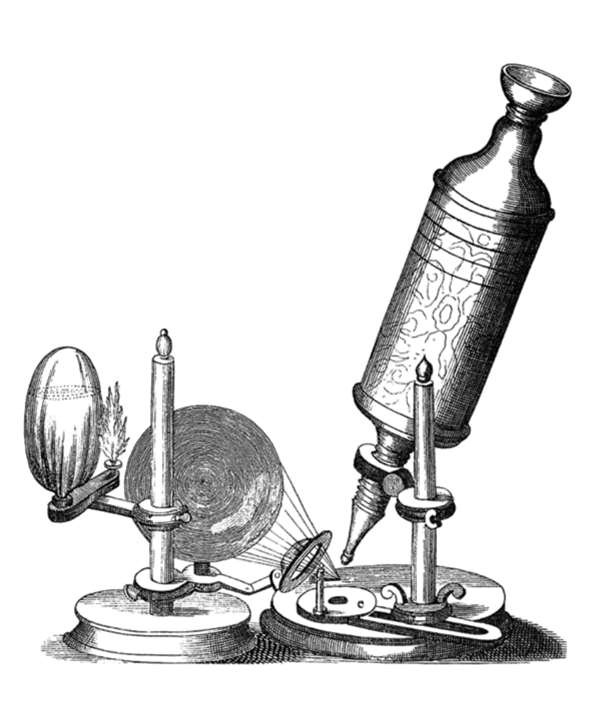 Robert Hooke, John Mayow, Jean Rey
Robert Hooke, John Mayow, Jean Rey
Robert Hooke, według Richarda Wallera, sekretarza Towarzystwa Królewskiego, „…chodził bardzo szybko, silnie zgarbiony… mając do noszenia jedynie lekkie ciało i bardzo dużo spraw i duchów, które mu towarzyszyły”. Waller opublikował zbór prac Hooke’a w 1705 roku dedykując je Newtonowi, który wtedy piastował stanowisko prezesa Towarzystwa Królewskiego. Trudno zrozumieć dedykację jaką opatrzył Waller pośmiertne wydanie prac Hooke’a biorąc pod uwagę, że pomiędzy Newtonem a Hookiem wystąpił spór o prawo pierwszeństwa odkryć w optyce i mechanice planet. Newtona charakteryzowała wręcz chorobliwa awersja do angażowania się w jakiekolwiek swady. W miarę jak kontrowersje pierwszeństwa odkryć narastały, odczuwał do Hooke’a nieodpartą niechęć, narastającą do tego stopnia, że wolał raczej nie publikować swojego dzieła Optikcs (Optyka), ani zaakceptować stanowiska w Towarzystwie Królewskim do momentu aż R. Hooke nie umrze. W takim kontekście pośmiertne wydanie dzieł Hooke’a z dedykacją dla Newtona wydaje się być zrozumiałe. Na tym tle warto przyjrzeć się temu co R. Waller ma do powiedzenia o R. Hooke’u. Scharakteryzował go jako skrajnie wychudzonego człowieka o bladej cerze, nie dbającego o wygląd zewnętrzny. Jednocześnie bardzo aktywnego, niespokojnego i niestrudzonego geniusza, który nie zwykł tracić czasu na sen, często pracując po całych nocach. Z wiekiem melancholia, nieufność, duma i zazdrość jakie prezentował w stosunku do innych ulegała pogłębieniu. Sylwetka jaką opisał Waller, człowieka prowadzącego życie pustelnika czy też cynika, okazała się jaskrawo przerysowana i niepasująca do rzeczywistego charakteru opisywanej osoby. R. Hooke przez całe życie prowadził osobisty i szczegółowy dziennik. Zachowały się jego pamiętniki, które zostały opublikowane w 1935 roku w trzechsetną rocznicę jego urodzin. Z nich wynika, że prowadził bardzo aktywne, pełne życie, był obdarzony ciepłymi, ludzkimi uczuciami, i że, w przeciwieństwie do Newtona, nie żywił żadnych trwałych urazów i nie przejawiał złej woli. Krótka analiza jego życia pozwoli nam spojrzeć z pewnej perspektywy na jego miejsce w nauce, wpływ na współczesnych mu ludzi i osiągnięcia, które przekazał tym, którzy przyszli po nim.
Robert Hooke urodził się 18 lipca 1635 roku, był synem wikariusza z małej parafii Freshwater na wyspie Wight. Był słabego zdrowia, jako młody chłopak borykał się nieustannie z silnymi bólami głowy. Pomimo kłopotów zdrowotnych wykazywał duży zapał do nauki, chociaż lekcje, które odbywał z ojcem przyprawiały go o potworne migreny. W związku z tym ojciec zaprzestał nauki syna. Kolejnych kilka lat nie pobierał regularnych nauk spędzając czas na konstruowaniu przeróżnych aparatów mechanicznych. Ponieważ przejawiał duży talent w tworzeniu szkiców, po śmierci ojca w 1648 roku, mając 13 lat został wysłany do Londynu gdzie miał zostać uczniem wielkiego malarza portretowego sir Petera Lely’ego. Robert szybko zniechęcił się do sztuki i wstąpił do Westminster School, gdzie wykazał się dużymi zdolnościami i osiągnięciami w matematyce, mechanice, łacinie i grece. W wieku 18 lat, w roku 1653, został chórzystą w Christ Church w Oksfordzie. Zmiany polityczne w okresie Republiki Angielskiej (Commonwealth of England), konkretnie zakaz wykonywania muzyki kościelnej, spowodowały, że Hooke z chórzysty został młodym stypendystą. Po dwóch latach pobytu w Oxfordzie został zatrudniony na stanowisku asystenta chemika przez dr Thomasa Willisa, członka grupy naukowej, której założycielem był wspomniany wcześniej John Wilkins. Wilkins był zagorzałym orędownikiem powstającej właśnie w Anglii filozofii eksperymentalnej, i to on najsilniej optował za powstaniem Królewskiego Towarzystwa Naukowego (Royal Society). Dzięki wsparciu badań naukowych Wilkinsowi udało się nakłonić R. Boyle’a do pozostania w Oksfordzie, i to właśnie on spowodował, że Ch. Wren, późniejszy członek kolegium All Souls dołączył do grupy Wilkinsa. W momencie gdy R. Boyle poszukiwał kogoś kto byłby w stanie ulepszyć konstrukcję pompy próżniowej niezbędnej do eksperymentów, Willis polecił swojego asystenta. Wynikające z tego zaangażowanie R. Hooke’a w prace członków grupy naukowej wpłynęło na całe jego późniejsze życie. Związek z Boylem, a później z Wrenem spowodował czynny udział w pracach powstałego Towarzystwa Królewskiego. Czynnikiem przełomowym była konstrukcja pompy próżniowej, której wykorzystanie i uzyskane rezultaty eksperymentów ugruntowały reputację R. Boyle’a jako naukowca, a R. Hooke dał się poznać jako zdolny eksperymentator i matematyk. Bliska współpraca tych dwóch uczonych trwała do 1662 roku, kiedy to założone dwa lata wcześniej Royal Society uznało, że potrzebuje osoby, która mogłaby sprawować pieczę nad aparaturą będącą w posiadaniu Towarzystwa oraz „dostarczać wyniki trzech lub czterech eksperymentów” na spotkania członków Towarzystwa. Zebrania odbywały się raz w tygodniu co pokazuje jakim wyzwaniem było podjęcie się takiej pracy. Pomimo wyzwań R. Hooke, zarekomendowany przez Boyle’a, je podjął. Z pewnością jego demonstracje doświadczeń i dyskusje wyników przyczyniły się znacząco do sukcesu Towarzystwa Naukowego we wczesnych lata jego istnienia. Aktywny udział w pracach Royal Society w niedługim czasie doprowadził do objęcia przez Hooke’a stanowiska akademickiego. Wybitny matematyk Isaac Barrow, który przybył do Gresham w tym samym czasie co R. Hooke, zrezygnował w 1664 roku z profesury, aby zostać pierwszym profesorem matematyki (i poprzednikiem Newtona) w Cambridge. Na to stanowisko opuszczone przez Barrowa został wybrany R. Hooke, ale z powodu nieprawidłowości formalnych w trakcie posiedzenia, zatwierdzenie jego wyboru przesunęło się do następnego roku. Mniej więcej w tym samym czasie podjął się wygłoszenia wykładów Cutlerowskich na temat procesów przemysłowych w Gresham. Pomimo złego stanu zdrowia i obowiązków związanych z pracami geodezyjnymi na terenie Londynu oraz pełnienia funkcji sekretarza w Royal Society, przez trzydzieści lat pełnił funkcję opiekuna aparatury w Royal Society oraz prowadził dwa kursy w ramach wykładów Cutlerowskich. W związku z tym nietrudno uwierzyć w słowa Richarda Wallera, który pisał o Hooke’u: „rzadko kładł się spać przed drugą, trzecią czy czwartą rano”.
Głównym efektem jego badań z jakim jest obecnie kojarzony jest prawo elastyczności określające zależność odkształcenia od naprężenia. Sam Hooke sformułował tę zależność posługując się łacińskim anagramem „ut tensio, sic vis”, czyli jakie odkształcenie taka siła. W uproszczeniu można to prawo wyrazić następująco: w granicach elastyczności bryły jej odkształcenie (rozciągnięcie) jest proporcjonalne do przyłożonego nacisku. Prawo to ma fundamentalne znaczenie przy projektowaniu konstrukcji i urządzeń mechanicznych. Na szczególne podkreślenie zasługuje fakt, że R. Hooke jako pierwszy stwierdził, że ruchy ciał w układzie słonecznym należy rozpatrywać tak jak każdy inny problem mechaniczny. Jego poglądy na astronomię i pomysły dotyczące powszechnej grawitacji były wystarczająco zbieżne z tymi jakie głosił Newton aby doprowadzić do wzajemnej animozji, jednak Hooke’owi brakowało umiejętności w zakresie matematyki aby móc rozwinąć swoje idee.
Wkrótce po objęciu stanowiska profesora w kolegium w Gresham, R. Hooke opublikował pod patronatem Royal Society, swoje dzieło Micrographia., w którym, poza obrazami mikroskopowymi, zamieścił swoją teorię spalania. Praca Hooke'a nad spalaniem najwyraźniej opierały się na stwierdzeniu zawartym w Sceptical Chymist Boyle'a, że jeśli węgiel drzewny jest silnie ogrzewany w zamkniętej retorcie, nie ulega spaleniu, ale (pozostałość) staje się czarna po ochłodzeniu. Jeśli jednak do retorty zostanie wpuszczone powietrze, węgiel drzewny spala się i pozostawia po sobie biały popiół. R. Boyle rozróżniał zatem działanie płonących substancji w zamkniętych naczyniach i ich ekspozycję na powietrze. Hooke nie podaje żadnych szczegółów eksperymentów nad spalaniem w Micrographia, ale na podstawie swoich niepublikowanych obserwacji wysuwa w dwunastu twierdzeniach teorię spalania, w której mówi między innymi: (i) „Powietrze jest uniwersalnym rozpuszczalnikiem wszystkich substancji siarczkowych; (3) to rozpuszczanie wytwarza bardzo wielkie ilości ciepła i to, co nazywamy ogniem; (5) to rozpuszczanie dokonuje się przez właściwą substancję zmieszaną z powietrzem, taką samą jak to co znajduje się w saletrze; (6) w tym rozpuszczaniu ciał przez powietrze pewna ich część zostaje zespolona lub rozpuszczona i zamieniona w powietrze, z którym usoni się w górę lub w dół wraz z nim”. Hooke’owi nie udało się odizolować tego wspólnego składnika powietrza i saletry, który w 1682 roku nazwał „saletrzanym powietrzem”. W tekstach R. Boyle’a również spotyka się niejasne stwierdzenia o„ lotnej saletrze” w powietrzu. (R. Boyle. Suspicions about some hidden Qualities of Air, 1674).
W pracy Lampas (1677) Hooke podaje rozszerzenie opisu struktury płomienia świecy, o którym wspominał w Micrographia. Pisze, że lśniące ciało, które nazywamy płomieniem ”jest niczym innym, jak tylko rafinowaną częścią łoju, wzniesioną przez ciepło do postaci pary”, na którą działa powietrze swymi rozpuszczającymi właściwościami, ale oddziaływanie to zachodzi na tych częściach, które są na zewnątrz. . . wytwarzając światło, które obserwujemy; ale te fragmenty, które wznoszą się z knota, będąc w środku, nie zmieniają się w lśniący płomień, dopóki nie uniosą się na szczyt stożka (płomienia), do którego swobodnie może dotrzeć powietrze i je rozpuścić. Można to zobaczyć, trzymając cienki kawałek szkła lub miki w poprzek płomienia, obserwując, że „środek stożka płomienia nie świeci ani się nie pali, tak jak jego zewnętrzna powierzchnia, która przylega do czystego i nie zawierającego „ustalonego powietrza” powietrza.”
Hooke przypuszczał zatem, że powietrze, dzięki obecności w nim czegoś, co również jest zawarte w saletrze, rozpuszcza ciała palne jako takie, i że wydzielane ciepło jest ciepłem roztworu, analogicznym do tego jakie jest wydzielane podczas rozpuszczania niektórych substancji )np. kwasu siarkowego(VI)) w wodzie. Dalszy postęp został dokonany przez J. Mayowa.
John Mayow
John Mayow urodził się w Morval, niedaleko Looe, w Kornwalii, do Wadham College w Oksfordzie wstąpił w 1658 r., a w 1660 roku został członkiem Fellow All Souls College, gdzie w 1670 roku uzyskał stopień naukowy doktora, ale zrezygnował z pracy na uniwersytecie zostają lekarzem w Bath i Londynie. Większość jego prac chemicznych wydaje się być wykonana w Oksfordzie. W 1673 r. ukończył Tractatus quinque Medico-Physici, który został opublikowany rok później w Oksfordzie. Przedstawia w nim teorie spalania i oddychania poparte pomysłowymi i nowatorskimi eksperymentami. Doszedł do wniosku, że powietrze zawiera dwa rodzaje cząstek, z których jeden nazwał cząstkami ogniowymi, saletrzanymi, lub spirytusem saletrzanym, które podczas spalania i oddychania są usuwane z powietrza, a drugi rodzaj cząstek pozostaje po tych procesach w zmniejszonej objętości powietrza. Wszystkie ciała palne zawierają „cząsteczki siarczane”, a ciepło wydzielane podczas spalania wynika z gwałtownego zderzenia tych cząstek i „cząstek saletrzanych” (teoria inna niż Hooke). Ciepło zwierząt wynika z interakcji „cząstek siarczanych” we krwi z „cząsteczkami saletrzanymi” we wdychanym powietrzu. W przypadku spalania prochu strzelniczego w próżni lub pod wodą „cząsteczki saletrzane” są dostarczane przez saletrę, a są zawarte w kwasowej (kwas azotowy(V)) części saletry. Siarka nie zawiera kwasu, a kwas siarkowy(VI) powstający podczas spalania lub utleniania pirytów na powietrzu powstaje z siarki i „cząstek saletrzanych” w nim zawartych. Mayow zauważa, że kiedy sproszkowany metaliczny antymon jest wygrzewany na marmurowej płycie za pomocą światła skupionego w soczewce, powstające wapno jest cięższe niż użyty do reakcji metal, pomimo wydzielania się dużych ilości dymów – eksperyment opisany przez Hamerusa Poppiusa (1618) i Nicolasa Le Fevre (1660) i wyjaśniony jako proces związany z wiązaniem światła. Mayow mówi, że saletrzane cząstki atmosfery są wiązane w metalu, a produkt kalcynacji jest identyczny z produktem otrzymanym przez działanie kwasu azotowego(V) na antymon i ogrzewanie powstałego ciała stałego.
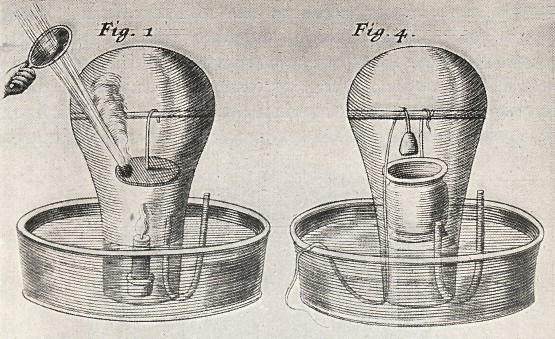 Rysunek z Tractatus quinque Medico-Physici, J. Mayow (1674)Mayow udowodnił, że tylko część powietrza bierze udział w procesach spalania i oddychania, które uznawał za zasadniczo podobne do siebie, dzięki kilku genialnym eksperymentom. Spalił świecę w szklanej naczyniu zanurzonym w wodzie, wyrównując poziomy wody wewnątrz i na zewnątrz naczynia za pomocą szklanego syfonu, który następnie szybko usunięto. Poziom wody wewnątrz naczynia podniósł się wskazując, że ubyła pewna ilość powietrza podczas spalania. Kiedy zgasła świeca, pozostała, znaczna część powietrza, w której nie dało się zapalić próbek siarki lub kamfory znajdującej się na półeczce umieszczonej w naczyniu. Aby zapewnić dostęp skupionych promieni słonecznych do wnętrza naczynia, Mayow zabezpieczył fragment naczynia, w którym spalał próbkę za pomocą papieru, który został po zgaśnięciu świecy usunięty za pomocą przymocowanej do niego nici przechodzącej na zewnątrz kolby. Podobne doświadczenia zostały opisane przez Filona z Bizancjum (2 wiek p. n. e.), Roberta Fludda (1617) i van Helmonta ale nie zadbali oni o wyrównanie poziomów wody na zewnątrz i wewnątrz naczynia, w którym spała się świeca.
Rysunek z Tractatus quinque Medico-Physici, J. Mayow (1674)Mayow udowodnił, że tylko część powietrza bierze udział w procesach spalania i oddychania, które uznawał za zasadniczo podobne do siebie, dzięki kilku genialnym eksperymentom. Spalił świecę w szklanej naczyniu zanurzonym w wodzie, wyrównując poziomy wody wewnątrz i na zewnątrz naczynia za pomocą szklanego syfonu, który następnie szybko usunięto. Poziom wody wewnątrz naczynia podniósł się wskazując, że ubyła pewna ilość powietrza podczas spalania. Kiedy zgasła świeca, pozostała, znaczna część powietrza, w której nie dało się zapalić próbek siarki lub kamfory znajdującej się na półeczce umieszczonej w naczyniu. Aby zapewnić dostęp skupionych promieni słonecznych do wnętrza naczynia, Mayow zabezpieczył fragment naczynia, w którym spalał próbkę za pomocą papieru, który został po zgaśnięciu świecy usunięty za pomocą przymocowanej do niego nici przechodzącej na zewnątrz kolby. Podobne doświadczenia zostały opisane przez Filona z Bizancjum (2 wiek p. n. e.), Roberta Fludda (1617) i van Helmonta ale nie zadbali oni o wyrównanie poziomów wody na zewnątrz i wewnątrz naczynia, w którym spała się świeca.
Mayow zebrał tlenek azotu, wydzielany podczas działania rozcieńczonego kwasu azotowego(V) na stalowe kulki, i wykazał eksperymentalnie, że gaz ten podlega prawu Boyle'a-Mariotta. Generując tlenek azotu w kolbie, której wylot był zanurzony w wodzie odkrył, że jedna czwarta powietrza jest usuwana z naczynia. Trzymając mysz w zamkniętym naczyniu, w którym umieszczono pęcherz wypełniony powietrzem, obserwował zwiększanie objętości pęcherza na skutek obniżania się ciśnienia w naczyniu. Mysz żyła o połowę krócej gdy była trzymana w naczyniu razem z płonącą świecą, w porównaniu z naczyniem bez świecy. Mayow miała bardzo zdecydowane poglądy na temat powinowactwa. Pisze: „Gdy kwaśny spirytus soli [HC1] reaguje z lotną solą [amoniak]. ., chociaż mieszane sole [kwas i zasada] wydają się być zniszczone, ale można je od siebie oddzielić w postaci niezmienionej, co ma miejsce, gdy salmiak ... jest destylowany z solą kamienia nazębnego [K2C03]. . . . Powodem tego jest to, że kwaśny spirytus soli może wejść w bliższe połączenie z dowolną nielotną solą niż z solą lotną, tak że natychmiast opuszcza lotne sole, aby móc się ściślej połączyć z solą nielotną." podaje też klarowny opis wypierania bardziej lotnego kwasu azotowego(V) z saletry przez kwas siarkowy(VI), zgodny z opracowanymi znacznie później koncepcjami Bertholleta. Mayow pisze:
„Bez wątpienia dzieje się tak, ponieważ lotna sól kwaśna [HNO3] saletry została usunięta z soli zasadowej przez mniej lotny kwas witriolowy, że kwas azotowy(V), teraz uwolniony z połączenia z solą alkaliczną, zostaje uniesiony pod wpływem ciepła nie większego niż jest wymagane do rektyfikacji ducha saletry. ... potwierdzeniem tego jest fakt, że masa pozostawiona w retorcie ... bardzo przypomina siarczany kamień nazębny [K2SO4].”
Jean Rey
Nie powinniśmy pozostawić szlaku prawdziwych odkryć otwartego przez R. Boyle’a, R. Hooke’a i J. Mayowa na pastwę teorii flogistonowej bez wspomnienia o Jeanie Reyu, który opublikował swój esej: Sur la Recerche de la causepour laquelle l’Estain le Plomb augmentant depoids quand na les caline, w roku 1777. J. Rey pisze, że „poświęcił kilka godzin” na rozważenie wzrostu masy cyny i ołowiu podczas kalcynacji (co było dobrze znane w jego czasach) i doszedł do wniosku, że jest to spowodowane „zagęszczonym powietrzem”, które „ulega zmieszaniu z wapnem” (c'est Fair qui se mesle parmi la chaux de l’estain du plomb qu'on calcine, qui l’augmente de poids). Rey twierdzi, że przeprowadził kilka eksperymentów kalcynacji cyny, ale nigdzie nie mówi, że powstanie wapna wynika z połączenia powietrza, w całości lub w części, z metalem i że wzrost masy jest spowodowany tym połączeniem. Jego pomysły są interesujące, ale prymitywne, a ich znaczenie zostało przecenione. J. Rey wyraźnie podkreśla, że wzrost masy ciała nie przekracza pewnej wartości: „Natura w swojej nieodgadnionej mądrości wyznaczyła granice, których nigdy nie przekracza” (s’est ici mise des barres qu’elle ne franchit jamais).