 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
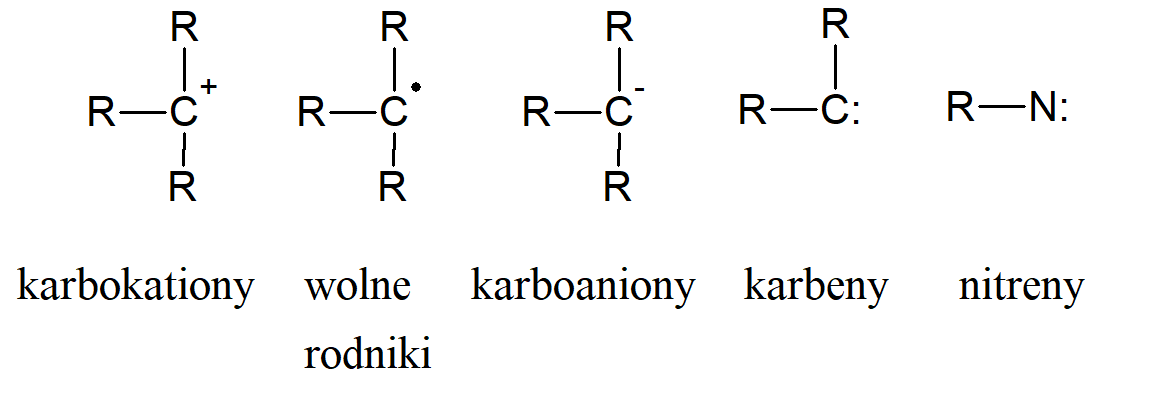
 Karbokationy, karboaniony i rodniki
Karbokationy, karboaniony i rodniki
Istnieją cztery rodzaje związków organicznych, w których atom węgla ma wartościowość tylko 2 lub 3. Zwykle są to związki bardzo nietrwałe i większość z nich występuje tylko jako produkty przejściowe szybko przekształcane w bardziej stabilne cząsteczki. Jednak niektóre z nich są w miarę stabilne. Zaliczamy do nich karbokationy, wolne rodniki, karboaniony i karbeny. Z tych czterech połączeń tylko karboaniony posiadają pełny oktet elektronowy na atomie węgla. Istnieje wiele innych jonów i rodników organicznych obdarzonych ładunkiem i posiadających niesparowane elektrony na atomach innych niż węgiel, ale zwrócimy uwagę tylko na nitreny, azotowe analogi karbenów.
Wśród metod powstawania karbokationów można wyróżnić:
- jonizację, w której grupa przyłączona do atomu węgla odchodzi wraz ze swoją parą elektronową, jak ma to miejsce w reakcjach solwolizy halogenków alkilowych lub estrów sulfonowych (proces może być odwracalny)
![]()
- jonizację po początkowej reakcji, która przekształca jedną grupę funkcyjną w grupę opuszczającą, jak w przypadku protonowania alkoholu w celu uzyskania jonu oksoniowego lub konwersji pierwszorzędowej aminy w sól diazoniową, z których obie jonizują do odpowiedniego karbokationu:
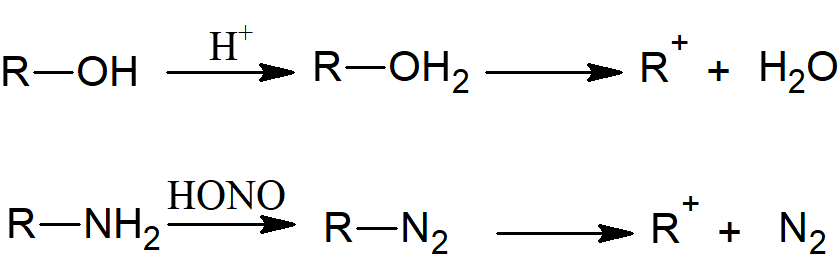
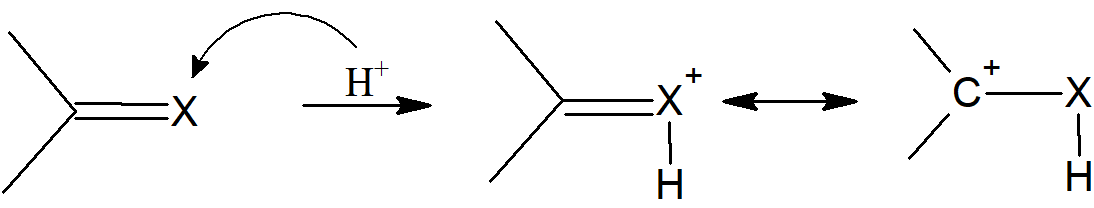
- proton lub inna dodatnio naładowana cząstka dołącza do jednego z alkenowych lub alkinowych atomów węgla pozostawiając sąsiedni atom węgla z ładunkiem dodatnim:

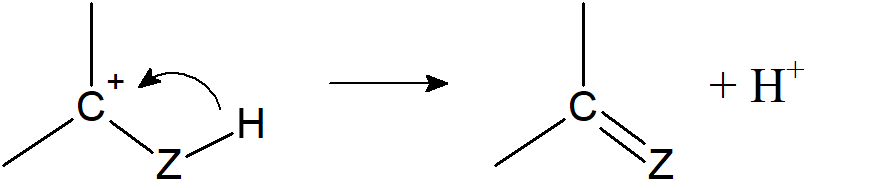
- proton lub inna cząstka obdarzona dodatnim ładunkiem przyłącza się do jednego atomu wiązania C=X, gdzie, w większości przypadków, X = O, S, N, pozostawiając sąsiedni atom węgla z ładunkiem dodatnim. Kiedy X = O, S powstający jon jest stabilizowany rezonansowo. Gdy X = NR, protonacja prowadzi do jonu iminiowego, z ładunkiem zlokalizowanym na azocie.
Powstające karbokationy są najczęściej krótko żyjącymi indywiduami przejściowymi ulegającymi dalszym reakcjom bez ich wydzielania.
- Karbokation może łączyć się z cząsteczką posiadającą parę elektronową, taką jak OH–, jon halogenkowy lub jakikolwiek inny jon ujemny, lub może to być cząsteczka obojętna obdarzona wolną donorową parą elektronową.
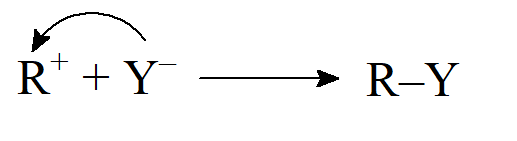
W takim przypadku powstający produkt posiada ładunek dodatni. Reakcje tego typu przebiegają bardzo szybko. Wykazano, że stała szybkości reakcji prostego trzeciorzędowego karbokationu ks jest równa 3,5·1012 s–1.
- Karbokation może oddać proton (lub znacznie rzadziej inny jon dodatni) z sąsiedniego atomu.
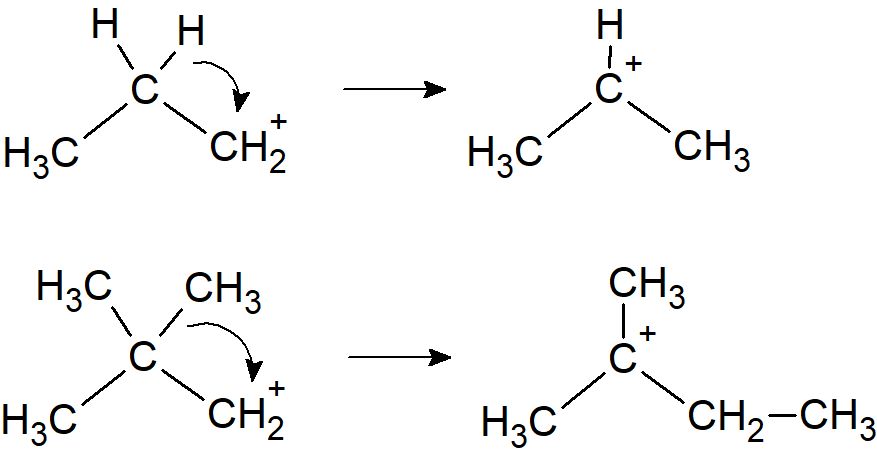
Karbokationy mogą również ulegać reakcjom nie prowadzącym do trwałych produktów, ale do innych karbokationów na drodze przegrupowania lub addycji.
Przegrupowanie. Grupa alkilowa lub arylowa lub wodór migruje ze swoją parą elektronów do dodatniego centrum, pozostawiając za sobą dodatni ładunek w innym miejscu:
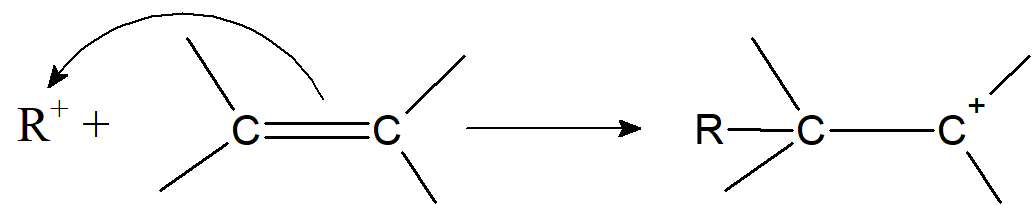
Addycja. Karbokation może przyłączyć się do wiązania podwójnego, generując ładunek dodatni na innym atomie węgla.
Karboaniony
Związek metaloorganiczny to związek zawierający wiązanie między atomem węgla a atomem metalu. Znanych jest wiele takich związków, a chemia metaloorganiczna to bardzo rozległy obszar, znajdujący się na pograniczu chemii organicznej i nieorganicznej. Wiele wiązań węgiel-metal (np. Wiązania węgiel-rtęć) jest niewątpliwie kowalencyjnych, ale w wiązaniach między węglem a bardziej aktywnymi metalami elektrony są bliżej węgla. To, czy położenie elektronów w danym wiązaniu jest wystarczająco blisko węgla, aby uzasadnić nazwanie wiązania jonowym, a ugrupowanie węglowe karboanionem, zależy od metalu, struktury części węglowej i rozpuszczalnika, a w niektórych przypadkach jest kwestia spekulacji. W tej sekcji omawiamy karbaniony z niewielkim odniesieniem do metalu. W następnej części zajmiemy się strukturami związków metaloorganicznych.
Z definicji każdy karbanion posiada parę elektronów i dlatego jest zasadą. Kiedy karboanion przyjmuje proton, przekształca się w sprzężony kwas. Stabilność karboanionu jest bezpośrednio związana z mocą kwasu sprzężonego. Im słabszy kwas, tym większa moc zasady i niższa stabilność karboanionu. Przez stabilność rozumiemy tutaj stabilność względem donora protonów; im niższa stabilność, tym bardziej karboanion jest skłonny przyjąć proton z dowolnego dostępnego źródła. Zatem określenie szeregu stabilności karboanionów jest równoważne określeniu szeregu mocy sprzężonych kwasów, a informacje o względnej stabilności karboanionów można uzyskać z tabeli mocnych kwasów, takiej jak tabela 8.1. Istnieją dowody na to, że proste karboaniony, takie jak etyl i izopropyl, są niestabilne tracąc elektron przekształcają się w rodniki.
Na trwałość karboanionów może mieć też wpływ efekt stabilizujący grup funkcyjnych przyłączonych bezpośrednio do atomu węgla z ładunkiem ujemnym, które są w stanie częściowo przejąć nadmiarowe elektrony, czyli mają własności elektrofilowe. Oprócz tego stabilizująco na karboaniony może działać rezonans chemiczny. Szczególnie trwałe są karboaniony w których na skutek rezonansu tworzy się aromatyczny układ wiązań.
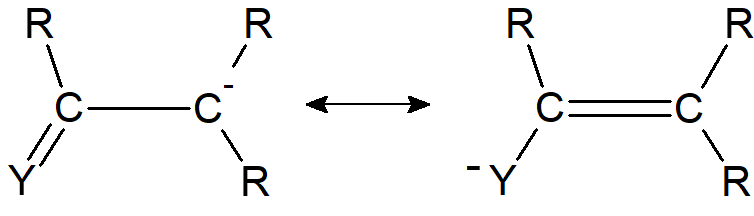
W przypadkach, gdy wiązanie podwójne lub potrójne znajduje się w pozycji a w stosunku do węgla karboanionowego, jon jest stabilizowany rezonans, w którym para elektronowa węgla karboanionowego oddziałuje z elektronami p wiązania podwójnego.
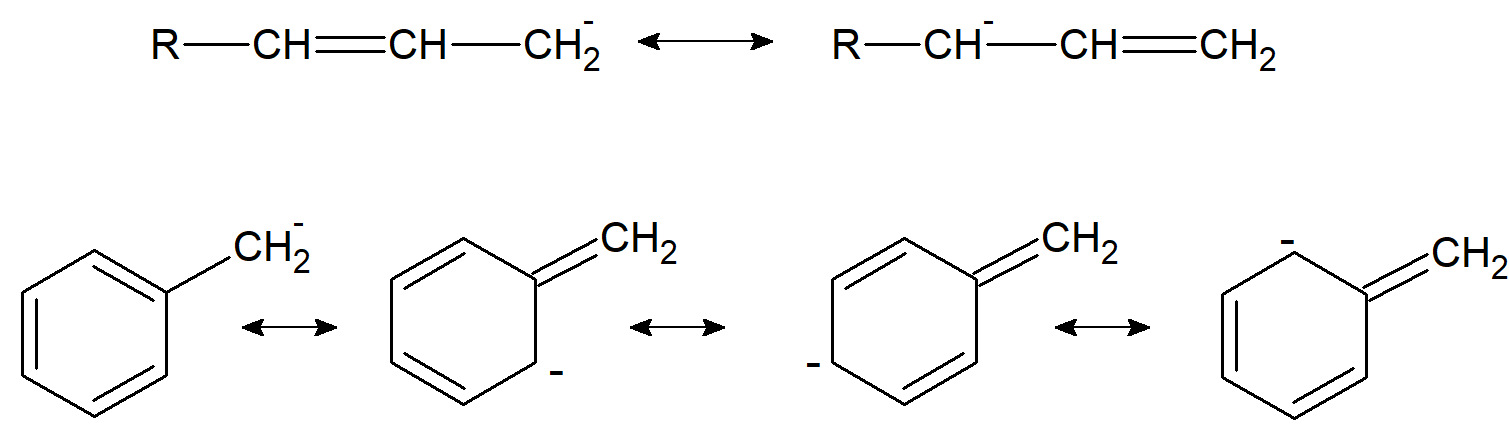
W przypadku gdy węgiel karboanionowy jest sprzężony z wiązaniem wielokrotnym węgiel-tlen lub węgiel-azot, stabilność jonu jest większa niż w przypadku anionów triarylometylowych, ponieważ elektroujemne atomy mają większą tendencję do gromadzenia ładunku ujemnego niż węgiel.
Trwałość karboanionów otrzymanych z węglowodorów zależy od hybrydyzacji atomu węgla, na którym zlokalizowany jest ładunek ujemny. Im większy udział orbitali s w układzie hybrydowym, tym karboanion jest trwalszy, gdyż elektrony znajdują się bliżej jądra atomu i mają mniejszą energię. Stąd trwałość karboanionów maleje w kolejności:
RC≡C− (hybrydyzacja sp – 50% udziału s) > R2C=C−H (sp2 33% s) > R3C−C−H2 (sp3 25% s)
Przyłączenie do karboanionowego węgla atomu siarki lub fosforu powoduje wzrost stabilności karboanionu, chociaż przyczyny tego są dyskusyjne. Jedna z teorii głosi, że wolna para elektronowa oddziałuje z pustym orbitalem d tworząc wiązanie typu pp–dp. Istnieją jednak przesłanki, że proces taki nie zachodzi. W przypadku podstawnika PhS uważa się, że stabilizacja karbanionów jest wynikiem połączenia efektów indukcji i polaryzowalności grupy, a oddziaływanie d – pp odgrywa rolę drugorzędną, jeśli w ogóle ma miejsce. Atom krzemu również stabilizuje karboaniony. Większość grup, które stabilizują karboaniony na skutek rezonansu wykazuje również charakter elektronowo-akceptorowy, a tym samym stabilizują karboanion poprzez rozpraszanie gęstości ładunku ujemnego. Ogólnie można uszeregować grupy funkcyjne w pozycji a stabilizujące karboaniony w następującej kolejności: NO2> RCO> COOR> SO2> CN ~ CONH2> Hal> H> R.
Dwie główne drogi generowania karboanionów są analogiczne jak w przypadku karbokationów. Pierwsza droga to heterolityczne uwolnienie grupy przyłączonej do węgla z pozostawieniem pary elektronowej.
R–H → R– + H+
Najczęściej grupą opuszczającą jest proton, a proces tego typu jest typową reakcją kwasowo-zasadową, do której niezbędna jest obecność zasady. Znane są tez inne przykłady:
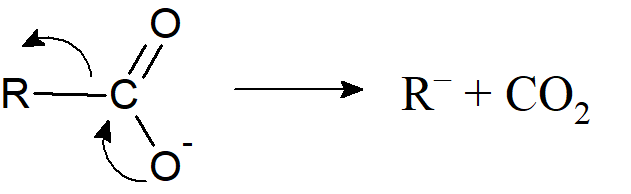
Druga droga polega na przyłączeniu jonu ujemnego do podwójnego lub potrójnego wiązania węgiel-węgiel.
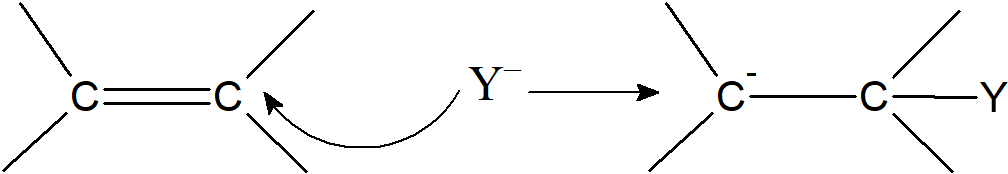
Dołączenie anionu do wiązania podwójnego węgiel-tlen nie prowadzi do utworzenia karboanionu gdyż ładunek ujemny jest zlokalizowany na tlenie.
Karboaniony najczęściej ulegają reakcjom kationami, zwykle protonem, lub z innym cząsteczkami posiadającymi puste orbitale na zewnętrznej powłoce elektronowej (reakcja kwas-zasada Lewisa):
R– + Y → R–Y
Karboaniony biorą udział w reakcjach substytucji:
R– + R3C–X → R4C + X–
Podobnie jak karbokationy, karboaniony mogą brać udział w reakcjach w których powstają cząsteczki obdarzone ładunkiem ujemnym:
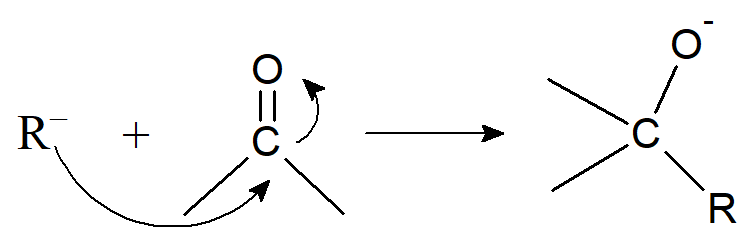
Natomiast rzadko ulegają procesom przegrupowania.
Wolne rodniki
Wolny rodnik (często nazywany po prostu rodnikiem) można zdefiniować jako cząsteczkę zawierającą jeden lub więcej niesparowanych elektronów. Należy zauważyć, że ta definicja obejmuje pewne stabilne cząsteczki nieorganiczne (np. NO i NO2), a także wiele atomów (np. Na i Cl). Podobnie jak w przypadku karbokationów i karboanionów, proste rodniki alkilowe są bardzo reaktywne. Ich żywotność jest wyjątkowo krótka w roztworze, ale można je przechowywać przez stosunkowo długi czas zamrożone w sieciach krystalicznych innych cząsteczek. Nawet w tych warunkach rodnik metylowy rozkłada się z okresem półtrwania 10-15 minuty w sieci metanolowej o temperaturze 77 K. Podobnie jak w przypadku karbokationów, szereg stabilności wolnych rodników jest następujący rodnik trzeciorzędowy> drugorzędowy> pierwszorzędowy. Możliwość rezonansu stabilizuje wolne rodniki. Postulowano, że obecność grup elektronodonorowych i elektronoakceptorowych przy centrum rodnikowym zwiększa stabilność wolnych rodników. Jednak brak jest jednoznacznych dowodów. Przykładowo rodniki FCH2· oraz F2CH·są bardziej stabilne niż CH3· to rodnik F3C· jest niestabilny. Niektóre rodniki, w których niesparowany elektron jest zlokalizowany na innym niż węgiel atomie są stabilne.
Proste rodniki alkilowe charakteryzują się płaską budową cząsteczki, w której węgiel jest w stanie hybrydyzacji sp2 z niesparowanym elektronem zlokalizowanym na trzecim orbitalu p.
Chociaż płaska konfiguracja geometryczna jest bardziej stabilna, struktury piramidalne są prawdopodobne. Generalnie różnica energii między płaską a piramidalną geometrią wolnego rodnika nie jest duża. Jednak wolne rodniki, w których węgiel jest połączony z atomami o wysokiej elektroujemności, na przykład ·CF3, preferują kształt piramidy. Rodniki cyklopropylowe są również piramidalne. Natomiast cząsteczki wolnych rodników, w których możliwy jest rezonans są zdecydowanie płaskie.
Znane są również układy dwurodnikowe, które na widmach spektroskopowych dają charakterystyczne triplety. Chociaż dwurodniki są bardzo krótko żyjącymi indywiduami (poniżej 0,1 ns) to istnieją przykłady o bardzo długim okresie półtrwania. Przykładowo czas życia dirodnika [3,5-di-tert-butyl-3’-(N-tert-butyl-N-aminoksy)-4-oxybifenyl]
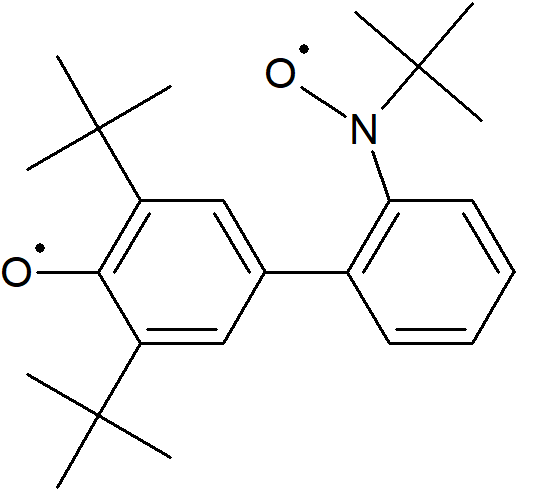
jest trwały w okresie tygodniowym, nawet w obecności tlenu.
Wolne rodniki są generowane w procesach homolitycznego zrywania wiązań, a energia niezbędna do rozerwania wiązania może być dostarczana w postaci ciepła lub światła o długościach fali w zakresie od 300 do 600 nm. Rodniki również powstają w reakcjach pomiędzy rodnikiem i cząsteczką. Natomiast procesy zaniku rodników (reakcje kończące) zachodzą albo pomiędzy dwoma rodnikami:
R· + R· → R–R
lub w wyniku dysproporcjonacji:
2H3C–CH2· → H3C–CH3 + H2C=CH2
Karbeny i nitreny
Karbeny są wysoce reaktywnymi związkami o czasach życia poniżej 1 sekundy; są to pochodne karbenu (metylenu, CH2), o wzorze ogólnym CR1R2, zawierające atom węgla związany z dwiema grupami jednowartościowymi lub jedną grupą dwuwartościową. Cząsteczki karbenów są elektrycznie obojętne, zawierają atom węgla o sześciu elektronach walencyjnych. Karbeny mogą występować w dwóch stanach elektronowych: singletowym i trypletowym. Stan singletowy ma hybrydyzację sp² z nieobsadzonym orbitalem p niezawierającym się w płaszczyźnie wyznaczonej przez podstawniki R1.
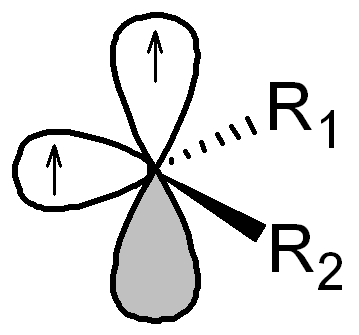 stan tripletowy
stan tripletowy
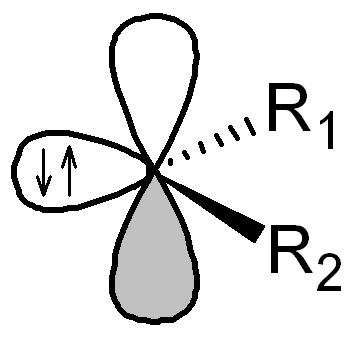 Stan singletowy
Stan singletowy
Niepodstawiony karben, czyli metylen, CH2 powstaje w wyniku naświetlania promieniowaniem UV np. diazometanu (CH2N2) lub ketenu (CH2=C=O). Pierwotnym produktem reakcji jest metylen singletowy (:CH2) ze sparowanymi wolnymi elektronami, który szybko przechodzi w stabilniejszy metylen trypletowy (•CH2•), w którym wolne elektrony nie są sparowane. Wyższa stabilność formy trypletowej nie jest regułą, np. dichlorokarben (:CCl2) występuje wyłącznie w stanie singletowym.
Azotowymi analogami karbenów są nitreny. W przypadku najprostszego nitrenu liniowa cząsteczka N–H ma atom azotu w hybrydyzacji sp, przy czym dwa z jego czterech elektronów stanowią wolną parę na orbitalu sp, a pozostałe dwa są zlokalizowane na zdegenerowanej parze orbitali p. Forma niskoenergetyczna jest tripletowa z niesparowanymi elektronami na każdym z orbitali p, a wyżej energetyczna jest stan singletowy z parą elektronową ma jednym z orbital p, i drugim pustym orbitalu p. Nitreny otrzymuje się przez termolize lub fotolize azydków lub w wyniku rozkładu izocyjanianów z uwolnieniem tlenku węgla.