 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
Pierwiastki powietrza i wody
Ta część poświęcona jest trzem pierwiastkom gazowym, których odkrycie stanowiło niezwykle ważne wydarzenie w dziejach osiemnastowiecznej chemii. Azot i tlen tworzą atmosferę ziemską, w której inne gazy występują w niewielkich ilościach. Wodór i tlen to składniki wody jednego z najbardziej zadziwiających związków chemicznych i jednocześnie bardzo rozpowszechnionej na ziemi substancji. Te trzy pierwiastki są podstawowymi składnikami związków organicznych i występują we wszystkich organizmach żywych.
Odkrycie wodoru, azotu i tlenu zajmuje specjalną pozycję w historii pierwiastków chemicznych. Zrozumienie prawdziwej natury tych substancji było złożonym, długotrwałym i pełnym sprzeczności procesem. Odkrywając gazowe produkty reakcji chemicznych (azot, wodór, tlen) naukowcy nie wiedzieli jeszcze, że mają do czynienia z nowymi pierwiastkami. Od czasów przedhistorycznych tylko jeden typ gazu – powietrze – był znany i pozostawał w sferze zainteresowania fizyki. Chemicy nie zajmowali się „powietrzem”. Gazowe produkty takich procesów jak fermentacja czy gnicie były traktowane jako różne odmiany powietrza. Pojęcie „gaz” pojawiło się dopiero z początkiem wieku XVII i zostało wprowadzone przez Johanna Baptista van Helmonta flamandzkiego lekarza, fizjologa i alchemika, odkrywcy dwutlenku węgla nazwanego przez niego „innego rodzaju powietrzem”. Słowo „gaz” van Helmont wywiódł z greckiego chaos. Spalając odważoną ilość 28,12 kg drewna (62 funty) uzyskał jedynie 0,45 kg (1 funt) popiołu, a gdzie reszta? Zastanawiając się nad tym problemem uznał, że pozostała część drewna podczas spalania przekształciła się w „ducha drewna” czyli spiritus silvester. Nazwał on tego nieznanego ducha gazem. Obecnie wiemy, że spiritus silvester van Helmonta, był dwutlenkiem węgla, ale na odkrycie jego natury trzeba było czekać kolejnych 100 lat, aż do czasu gdy szkocki chemik Joseph Black odkryje dwutlenek węgla na nowo. Stosowanie określenia „odkrycie nowych pierwiastków” nie przystaje do opisywanych tu czasów. W XVIII wieku obowiązywała teoria flogistonu, o której wspomnieliśmy wcześniej. Z drugiej strony wprowadzenie przez van Helmonta pojęcia stanu gazowego zapoczątkowało nową gałąź nauki „chemię pneumatyczną”, którą jej twórca rozwijał opierając się na własnych metodach i urządzeniach jakie miał w swoim laboratorium. Ta gałąź badań materii przetrwała wiek osiemnasty i była uprawiana jeszcze w początkach następnego wieku. Celem jaki przyświecał badaniom w tym zakresie było zrozumienie właściwości fizycznych powietrza i jego relacji do przebiegu procesów chemicznych.
Badania reakcji spalania prowadzone przez Lavoisiera doprowadziły do upadku teorii flogistonowej. Jednak poszukiwanie flogistonu przyczyniło się do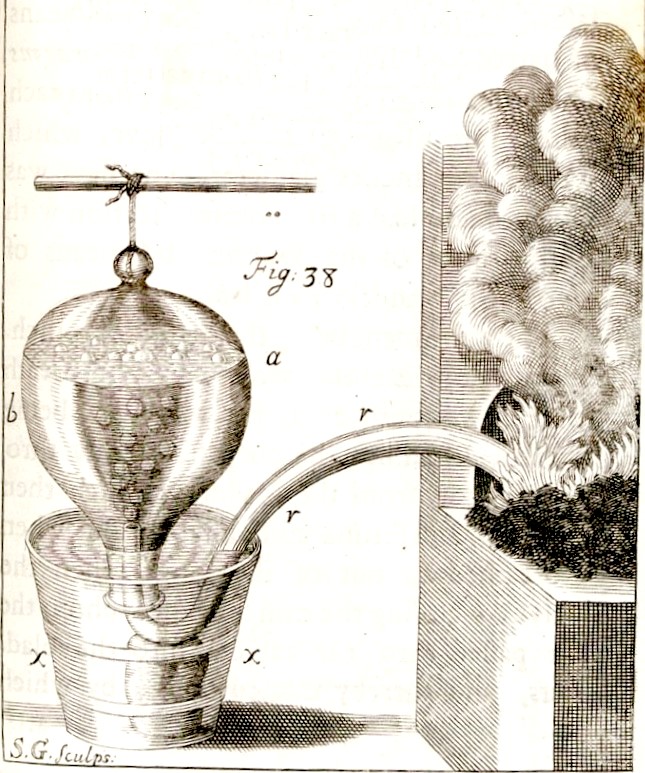 odkrycia wodoru, tlenu i azotu. Z drugiej strony eksperymenty w ramach chemii pneumatycznej równie istotnie przyczyniły się do odkrycia tych pierwiastków. Badania gazów przez długi czas były bardzo utrudnione chociażby ze względu na brak odpowiednich zbiorników, umożliwiających zbieranie, przechowywanie, ważenie i analizę produktów gazowych. Jako zbiorniki gazów wykorzystywano pęcherze zwierzęce. Sytuacja zmieniła się na początku XVIII wieku kiedy to Stefan Hales, angielski botanik, chemik, fizyk i wynalazca skonstruował „wannę pneumatyczną”. W urządzeniu tym naczynie, w którym zachodziła reakcja przebiegająca z wydzielaniem produktu gazowego było oddzielona od zbiornika, w którym gaz był gromadzony. Zbiornikiem było naczynie wypełnione wodą i zanurzone otworem w cieczy, do którego rurką doprowadzano gaz powstający w badanym procesie. Wynaleziony sposób wydaje się prosty i oczywisty, jednak przed Halesem nikt nie wpadł na ten pomysł.
odkrycia wodoru, tlenu i azotu. Z drugiej strony eksperymenty w ramach chemii pneumatycznej równie istotnie przyczyniły się do odkrycia tych pierwiastków. Badania gazów przez długi czas były bardzo utrudnione chociażby ze względu na brak odpowiednich zbiorników, umożliwiających zbieranie, przechowywanie, ważenie i analizę produktów gazowych. Jako zbiorniki gazów wykorzystywano pęcherze zwierzęce. Sytuacja zmieniła się na początku XVIII wieku kiedy to Stefan Hales, angielski botanik, chemik, fizyk i wynalazca skonstruował „wannę pneumatyczną”. W urządzeniu tym naczynie, w którym zachodziła reakcja przebiegająca z wydzielaniem produktu gazowego było oddzielona od zbiornika, w którym gaz był gromadzony. Zbiornikiem było naczynie wypełnione wodą i zanurzone otworem w cieczy, do którego rurką doprowadzano gaz powstający w badanym procesie. Wynaleziony sposób wydaje się prosty i oczywisty, jednak przed Halesem nikt nie wpadł na ten pomysł.
Badania prowadzone w ranach chemii pneumatycznej, takie jak van Helmonta, a zwłaszcza J. Blacka, który stwierdził, że substancje otrzymane w wyniku kalcynacji czy reakcji z kwasami można przeprowadzić z powrotem w substancje wyjściowe były przełomowe. Obecnie wiemy, że ówcześni eksperymentatorzy ogrzewając węglany czy podając je działaniu kwasów otrzymywali dwutlenek węgla i odpowiednio tlenek lub sól odpowiedniego metalu. Prowadząc reakcję odwrotną czyli tlenku czy soli z dwutlenkiem węgla na powrót otrzymywali węglany. Black odkrył, że masy substancji poddanej kalcynacji i otrzymanej w reakcji produktu kalcynacji z wydzielonym dwutlenkiem węgla były sobie równe.