 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Poziomy energetyczne atomów
Poziomy energetyczne atomów
W przybliżeniu nierelatywistycznym stany stacjonarne atomu wyznaczone są przez równanie Schrödingera dla układu elektronów poruszających się w kulombowskim polu jądra i oddziałujących ze sobą siłami elektrostatycznymi. Jeżeli pole zewnętrzne ma symetrię sferyczną to zachowany jest całkowity orbitalny moment pędu (L) układu cząstek, jak również i parzystość stanu. W związku z tym każdy stan stacjonarny atomu będzie charakteryzowany określoną wartością całkowitego momentu pędu, jak również, ze względu na oddziaływanie wymienne, całkowitą wartością spinu elektronów (S). Klasyfikacja stanów energetycznych atomu jest determinowana przez wartości wielkości L i S oraz parzystość stanu, przy czym same wartości całkowitego momentu pędu i spinu nie determinują jednoznacznie energii stanu. Każdy poziom energetyczny może być zdegenerowany odpowiednio do różnych możliwych kierunków w przestrzeni wektorów L i S. Krotności degeneracji ze względu na te kierunki wynoszą odpowiednio 2L + 1 i 2S + 1, a całkowita krotność zwyrodnienia jest równa iloczynowi (2L + 1)(2S + 1) dla stanu o danych L i S. Ponieważ elektromagnetyczne oddziaływanie elektronów charakteryzują efekty relatywistyczne to energia atomu zależy nie tylko od wielkości wektorów L i S lecz także od ich wzajemnego położenia. W takim razie orbitalny moment pędu i spin atomu, każdy z osobna nie jest zachowany, a zachowanie dotyczy całkowitego momentu pędu J = L + S. W związku z tym poziomy energetyczne atomu charakteryzują się wartościami J całkowitego momentu pędu. Jednak efekty relatywistyczne są względnie małe, i można je traktować jako zaburzenia. Pod wpływem takiego zaburzenia zdegenerowany poziom o danych L i S rozszczepia się na szereg bliskich sobie poziomów, różniących się wartościami całkowitego momentu pędu J. W pierwszym przybliżeniu bezwzględne wartości orbitalnego momentu pędu i spinu, ale nie ich kierunki, są zachowane co pozwala na charakteryzowanie poziomów energetycznych atomu wartościami L i S. . Wynikiem efektów relatywistycznych jest rozszczepienie się poziomu o danych wartościach L i S na szereg poziomów o różnych wartościach J, czyli pojawienie się struktury subtelnej poziomów. J przyjmuje wartości od L + S do |L – S|, zatem poziom o danych L i S rozszczepia się na 2S + 1, jeżeli L > S lub 2L + 1, gdy L < S, różnych poziomów. Każdy z tych poziomów jest zwyrodniały 2J + 1 razy ze względu na kierunek wektora J.
Atomowe poziomy energetyczne, czyli termy atomowe, oznacza się symbolami analogicznymi do tych stosowanych do oznaczania pojedynczych stanów cząstek o określony wartościach momentu pędu. Mamy więc stany o różnych wartościach całkowitego momentu pędu:
| L | = | 0 | 1 | 2 | 3 | 4 | 5 | ... |
| S | P | D | F | G | H | ... |
Po lewej stronie symboli termu, u góry, po stronie lewej, podaje się liczbę 2S + 1, czyli kotność termu, która określa liczbę składowych struktury subtelnej poziomu dla L ≥ S. U dołu, po stronie prawej zapisuje się wartość całkowitego momentu pędu J. W ten sposób symbole 2P1/2, 3P3/2 oznaczają odpowiednio stany o L = 1, S = 1/2 i J = 1/2, 3/2.
Stany elektronów w atomie
Atom o więcej niż jednym elektronie jest układem złożonym, w którym elektrony poruszające się w polu jądra oddziałują ze sobą. Ściśle mówiąc, w układzie takim można rozpatrywać tylko jego stan jako całości. Jednak, z dobrą dokładnością, można rozpatrywać stany każdego elektronu z osobna jako stany stacjonarne ruchu elektronu w polu o symetrii sferycznej wytworzonym przez jądro razem z pozostałymi elektronami. Pola takie będą różne w ogólnym przypadku dla każdego z elektronów w atomie, gdyż zależą ruch pojedynczego elektronu zależy od stanów wszystkich pozostałych elektronów. Pola tego rodzaju nazywane są polami samouzgodnionymi.
Pola samouzgodnione mają symetrię sferyczną, zatem każdy stan elektronu charakteryzuje się określoną wartością orbitalnego momentu pędu l. Stany pojedynczego elektronu o danym l numeruje się względem wzrastającej energii za pomocą głównej liczby kwantowej n, przyjmującej wartości n = l + 1, l + 2, ... .Taki wybór porządku numerowania przyjęto zgodnie z kolejnością dla atomu wodoru. jednak kolejność wzrastania energii dla atomów złożonych jest różna od atomu wodoru. Przykładowo stan o n = 5 i l = 0 leży niżej na skali energii niż stan o n = 4 i l = 2. Stany poszczególnych elektronów o różnych n i l oznacza się cyfrą równą wartości głównej liczby kwantowej oraz litery odpowiadającej wartości l. Przykładowo symbol 4d opisuje stan o n = 4 i l = 2. Rozkład elektronów w atomie w stanach różniących się wartościami l i n nazywa się konfiguracją elektronową. Wzajemne położenie poziomów o jednakowej konfiguracji lecz różnych L i S podlega regule Hunda, zgodnie z którą najmniejszą energię posiada term o największej możliwej przy danej konfiguracji elektronowej, wartości S i największej wartości L.
Oddziaływanie spin-orbita
Relatywistyczne człony w hamiltonianie atomu można podzielić na dwa rodzaje: liniowe i kwadratowe względem operatorów spinu elektronu. Pierwsze z nich odpowiadają oddziaływaniu własnych momentów magnetycznych elektronów z momentami magnetycznymi ruchu orbitalnego i określa się je jako oddziaływanie spin-orbita. Drugi rodzaj oddziaływań odpowiada wzajemnemu oddziaływaniu momentów magnetycznych elektronów ze sobą. Jest to oddziaływanie typu spin-spin. W rzeczywistości oddziaływanie spin orbita dla ciężkich atomów jest znacznie silniejsze niż oddziaływanie spin-spin. Jest to związane z zależnością oddziaływania spinowo-orbitalnego od liczby atomowej pierwiastka. Oddziaływanie spin-spin takiej zależności nie wykazuje, gdyż obejmuje bezpośrednie oddziaływanie elektronów pomiędzy sobą bez związku z polem jądra atomu. Operator oddziaływania spin-orbita ma postać;
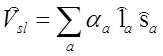 gdzie sumowanie odbywa się po wszystkich elektronach w atomie, αa jest funkcją współrzędnych spinu i momentu orbitalnego. Uśrednienie operatora po elektronowych stanach atomu o zadanych wielkościach L i S, czyli całkowitego orbitalnego momentu pędu i całkowitego spinu, ale nieokreślonych kierunkach, prowadzi do uzyskania operatora zaburzenia wyrażonego w wielkościach charakteryzujących cały atom, a nie poszczególne elektrony. Operator uśrednionego oddziaływania spin-orbita ma postać:
gdzie sumowanie odbywa się po wszystkich elektronach w atomie, αa jest funkcją współrzędnych spinu i momentu orbitalnego. Uśrednienie operatora po elektronowych stanach atomu o zadanych wielkościach L i S, czyli całkowitego orbitalnego momentu pędu i całkowitego spinu, ale nieokreślonych kierunkach, prowadzi do uzyskania operatora zaburzenia wyrażonego w wielkościach charakteryzujących cały atom, a nie poszczególne elektrony. Operator uśrednionego oddziaływania spin-orbita ma postać:
![]() gdzie stała A zależy od S i L a nie od całkowitego momentu pędu J. Obliczenie energii rozszczepienia wymaga teraz rozwiązania równania wiekowego zbudowanego z elementów macierzowych operatorów zawartych w równaniu. Jednak elementy diagonalne macierzy VLS są znane gdyż są one funkcjami falowymi stanów o określonych wartościach całkowitego momentu pędu J. W takim razie iloczyn operatorów LS można zastąpić jego wartościami własnymi uzyskując wyrażenie:
gdzie stała A zależy od S i L a nie od całkowitego momentu pędu J. Obliczenie energii rozszczepienia wymaga teraz rozwiązania równania wiekowego zbudowanego z elementów macierzowych operatorów zawartych w równaniu. Jednak elementy diagonalne macierzy VLS są znane gdyż są one funkcjami falowymi stanów o określonych wartościach całkowitego momentu pędu J. W takim razie iloczyn operatorów LS można zastąpić jego wartościami własnymi uzyskując wyrażenie:
LS = 1/2[J (J + 1) – L (L + 1) – S (S + 1)]
Wszystkie składowe multipletu mają te same wartości L i S, a ponieważ interesuje nas tylko wzajemny rozkład poziomów energetycznych, to energię rozszczepienia można zapisać w postaci:
1/2AJ (J + 1)
W ten sposób odstępy energetyczne między dwoma sąsiadującymi składowymi struktury subtelnej, opisanymi liczbami J i J – 1 są równe:
ΔEj, J–1 = AJ
Wzór ten wyraża regułę odległości Landego. Stała A może być dodatnia jak i ujemna. Dla A > 0 najniższym poziomem ze składowych multipletu jest poziom o najniższym możliwym J, czyli J = |L – S|. Gdy A < 0 najniżej leżący poziom ma wartość J = L + S. Podobne rozważania można przeprowadzić dla sprzężenia spin-spin. Istotnym jest to, że są one prawidłowe dla układu, w którym orbitalne momenty pędu elektronów sumują się dając w efekcie całkowity orbitalny moment pędu, a spiny całkowity spin. Taka sytuacja występuje gdy odległości poziomów struktury subtelnej są małe w porównaniu z odstępami między poziomami o różnych L i S. Przybliżenie to nosi nazwę sprzężenia Russela-Saundersa i jest właściwe dla lekkich atomów. W miarę zwiększania liczby atomowej rośnie oddziaływanie relatywistyczne i sprzężenie Russela-Saundersa przestaje mieć zastosowanie.
W przypadku gdy oddziaływanie relatywistyczne staje się duże w porównaniu do elektrostatycznego nie można mówić o oddzielnym orbitalnym momencie pędu i spinie. W takim przypadku pojedyncze elektrony charakteryzują się całkowitymi momentami pędu j, które sumują się w ogólny całkowity moment pędu J. W takim wypadku mamy do czynienia ze sprzężeniem j–j. Przy czym ten typ sprzężenia nie występuje w postaci czystej. Dla bardzo ciężkich atomów pierwiastków obserwuje się sprzężenia pośrednie pomiędzy L–S i j–j. Dodatkowym rodzajem sprzężenia, jakie można zaobserwować, jest sprzężenie wynikające z oddziaływania pomiędzy momentami magnetycznymi elektronów i jądra. Przy czym oddziaływanie to jest stosunkowo niewielkie ze względu na małe momenty magnetyczne jądra.