 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Grupa 7– Manganowce
Grupa 7– Manganowce
Mangan
Mangan jest srebrzystobiałym metalem przejściowym. Pod względem właściwości fizyczno-chemicznych mangan zbliżony jest do żelaza. Jest twardszy i bardziej kruchy. Na powietrzu pokrywa się chroniącą warstwą tlenków. Rozpuszcza się w kwasach. Z niemetalami najczęściej reaguje po podgrzaniu i gwałtownie. Nie reaguje z wodorem. Tworzy cztery odmiany alotropowe. Jest jednym z tak zwanych pierwiastków czystych tzn. występujących w postaci tylko jednego izotopu. W związkach występuje głównie na stopniach utlenienia: +2, +3, +4, +5, +6, +7. Mangan jest najbardziej, po żelazie, rozpowszechnionym pierwiastkiem ciężkim. Nie występuje w postaci wolnego pierwiastka poza meteorytami i tzw. konkrecjami manganowo-żelazowymi spotykanymi na dnie oceanów. Konkrekcje te będą prawdopodobnym źródłem manganu i innych metali w przyszłości. Zawartość w skorupie ziemskiej 0,085% wag. Techniczny mangan otrzymuje się poprzez prażenie jego rud i redukowanie glinem powstałego tlenku (Mn3O4) do wolnego manganu. Czysty mangan otrzymuje się w wyniku elektroredukcji (elektroliza + redukcja z materiałem elektrody) soli manganu(II) na katodzie rtęciowej. Lwią część produkowanego manganu wykorzystuje się w metalurgii do odtleniania żelaza i stali. Używany jest także do wytwarzania materiałów odpornych na zużycie (np. sejfy). Ze względu na odporność na wodę morską wykorzystywany jest do budowy np. śrub okrętowych. Ze stopów manganu produkuje się oporniki, których oporność w małym stopniu zależy od temperatury. Jako popularny manganian(VII) potasu (KMnO4) używany jest do dezynfekcji, jako utleniacz i w chemii analitycznej (manganometria). Tlenek manganu (IV) (MnO2) używany jest w bateriach i farbach.
Związki manganu:
- +2 stopień utlenienia
tlenek manganu(II) – MnO – otrzymuje się w postaci szarozielonego proszku w trakcie prażenia węglanu lub szczawianu manganu(II) w atmosferze beztlenowej. Można też go uzyskać w wyniku redukcji wyższych tlenków manganu wodorem. W wodzie rozpuszcza się trudno, natomiast łatwo ulga działaniu kwasów, przy czym tworzą się sole wykazujące bladoróżowe zabarwienie.
wodorotlenek manganu(II) – Mn(OH)2 – strąca się w postaci białego osadu po dodaniu do roztworu soli manganu(II) wodorotlenku litowca. Pod wpływem tlenu ulega utlenieniu do brunatnego uwodnionego tlenku manganu(IV).
chlorek manganu(II) – MnCl2 – bezwodny związek powstaje podczas ogrzewania tlenków manganu w strumieniu suchego chlorowodoru. Tworzy różowe kryształki rozpuszczalne w wodzie, topiące się w temperaturze 923K. Z roztworów wodnych wydziela się czterohydrat.
siarczan(VI) manganu(II) – MnSO4 – otrzymywany przez roztworzenie węglanu w kwasie siarkowym(VI). W stanie bezwodnym ma barwę białą. Uwodniony natomiast jest bladoróżowy.
fosforan(V) amonowo–manganowy(II) – NH4MnPO4 – strąca się z roztworów soli manganu(II), do których dodano chlorek amonu, amoniak i fosforan(V) sodu. Jest różowym ciałem stałym. W trakcie ogrzewania przechodzi w pirofosforan Mn2P2O7.
siarczek manganu(II) – MnS – cielistoróżowe ciało stałe strącające się pod działaniem siarczku amonowego na roztwór soli manganu(II). Łatwo roztwarza się w rozcieńczonych roztworach kwasów. Przechowywany pod powierzchnią cieczy, z której został strącony przechodzi w zieloną bardziej trwałą odmianę. Strącony ze stężonych roztworów octanu manganu(II) siarkowodorem pod zwiększonym ciśnieniem tworzy odmianę o barwie czerwonej. Łatwo ulega utlenieniu.
heksacyjanomanganian(II) potasu – K4[Mn(CN)6]·3H2O – ciemnoniebieskie kryształy wydzielające się po dodaniu krystalicznego cyjanku potasu do stężonego roztworu octanu manganu(II). Roztwory tego związku mają barwę żółtą. Pod działaniem tlenu atmosferycznego przechodzi w heksacyjanomanganian(III) potasu tworzący czerwone kryształy, a metaliczny magnez redukuje go do stopnia utlenienia +1:
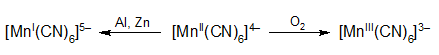
- +3 stopień utlenienia
tlenek manganu(III) – Mn2O3 – czarny proszek otrzymywany w wyniku ogrzewania tlenku manganu(IV) w powietrzu w temperaturze pomiędzy 800 a 1210K. W temperaturze 1300K traci tlen przechodząc w trwalszy Mn3O4.
uwodniony tlenek manganu(III) – MnO·OH – wydziela się z roztworów manganu(II) do których dodano chlorku amonu lub amoniaku, a następnie utleniono tlenem z powietrza.
siarczan(VI) manganu(III) – Mn2(SO4)3 – powstaje podczas ogrzewania MnO2 ze stężonym kwasem siarkowym(VI). Jest ciemnozielonym ciałem stałym tworzącym roztwory o zabarwieniu fioletowym. Z roztworami soli litowców tworzy sole podwójne o wzorze: M2ISO4·Mn2(SO4)3·24H2O.
fluorek manganu(III) – MnF3 – rubinowoczerwone ciało stałe otrzymywane w wyniku roztwarzania Mn2O3 w kwasie fluorowodorowym.
chlorek manganu(III) – MnCl3 – trwały w niskich temperaturach. Otrzymywany działaniem kwasu solnego na MnO2 w temperaturze 273K.
Chlorek i fluorek tworzą z fluorkami i chlorkami litowców związki o wzorach: M2IMnX5 i M2IMnX5·H2O.
-
+4 stopień utlenienia
tlenek manganu(IV) – MnO2 – w przyrodzie występuje jako minerał brausztyn (piroluzyt). Najczęściej otrzymywany w wyniku ogrzewania azotanu(V) manganu(II) w temperaturze 420-435K. Ciało stałe o zmiennej barwie od szarej do czarnej. Ogrzewany w temperaturze powyżej 800K rozkłada się z utworzeniem Mn2O3 i wolnego tlenu. W próżni taki rozkład następuje w niższych temperaturach. W przemyśle szklarskim stosowany do odbarwiania szkła. Proces ten polega na rozpuszczaniu tlenku manganu(IV) w stopionej masie szklanej, gdzie tworzą się krzemiany manganu(III) z równoczesnym utlenieniem drobnych ilości węgla i siarczków. Dodatkowo czerwonofioletowa barwa krzemianu manganu(III) stanowi dopełnienie zielonej barwy krzemianów żelaza(II), co maskuje zieloną barwę szkła.
uwodniony tlenek manganu(IV) – barwy brunatnej lub czarnej strąca się w wyniku utleniania roztworów soli manganu(II) chloranami(I) lub bromianami(I). Powstaje też w wyniku redukcji manganianu(VII) potasu w środowisku obojętnym i zasadowym.
Obydwa tlenki wykazują własności amfoteryczne. Sole Mn(IV) są nietrwałe dlatego też w wyniku reakcji między gorącym kwasem solnym i MnO2 wydziela się chlor:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
a w reakcji pomiędzy kwasem siarkowym(VI) i tlenkiem manganu(IV) wydziela się tlen:
MnO2 + H2SO4 → MnSO4 + ½O2 + H2O
Reakcja powstawania chloru była podstawą metody Weldona, w której otrzymywano ten pierwiastek na skalę techniczną. Tlenek manganu(IV) jest aktywny katalitycznie, szczególnie w reakcji rozkładu nadtlenku wodoru. W mieszaninie z tlenkiem miedzi przyspiesza utlenianie CO do dwutlenku węgla, co wykorzystuje się przy oczyszczaniu powietrza z tlenku węgla.
- +5 stopień utlenienia
Na tym stopniu utleniania mangan tworzy manganiany(V).
manganian(V) sodu – Na3MnO4 – powstaje w wyniku stapiania MnO2 z Na2O i NaNO2. Jednocześnie daje się go otrzymać w wyniku redukcji KMnO4 w środowisku zasadowym. Jest jasnoniebieskim ciałem stałym występującym w postaci dziesięciohydratu. W roztworach wodnych obojętnych i zakwaszonych ulega dysproporcjonacji z utworzeniem związków manganu(IV) i (VI):
2MnO43– + 2H2O → MnO42– + MnO2 + 4OH–
- +6 i +7 stopień utlenienia
Poprzez stapianie tlenków manganu z wodorotlenkami lub węglanami litowców w obecności powietrza otrzymuje się zielone manganiany(VI) M2IMnVIO4. Roztwory tych związków mają barwę zieloną, która po zakwaszeniu zmienia się na fioletową na skutek powstawania jonów MnO4–:
3MnVIO42– + 4H+→ 2MnVIIO4– + MnIVO2 + 2H2O
Wszystkie manganiany wykazują własności utleniające.
manganian(VII) potasu – KMnO4 – ciemnopurpurowe kryształy, których rozpuszczalność w wodzie sięga 6,5 g w 100 ml wody); roztwór ma intensywne różowofioletowe zabarwienie. Wykazuje silne działanie utleniające. Z tego względu roztworów tego związku nie można sączyć na bibule (utlenia celulozę).
W roztworach słabo zasadowych ulega redukcji do Mn(IV):
MnVIIO4– + 2H2O + 3e– → MnIVO2 + 4OH–
w roztworach silnie zasadowych powstaje Mn(VI):
MnVIIO4– + e –→ MnVIO42–
a w kwaśnych Mn(II):
MnVIIO4– + 8H+ + 5e– → Mn2+ + 4H2O
kwas manganowy(VII) – HMnO4 – znany tylko w roztworach wodnych, otrzymywanych w wyniku dodania do roztworu manganianu(VII) baru stechiometrycznej ilości kwasu siarkowego(VI) i odsączenia wydzielonego siarczanu(VI) baru. Jest mocnym kwasem. Jako bezwodnik tego kwasu występuje Mn2O7, tworzący ciemno zabarwioną ciecz w wyniku ostrożnego działania stężonym kwasem siarkowym(VI) na stały manganian(VII) potasowy. Ogrzewany rozkłada się na tlen i tlenek manganu(IV), a przy silniejszym ogrzewaniu wybucha.
| Konfiguracja elektronowa | Ar 3d54s2 |
| Masa atomowa | 54,93805 |
| Gęstość [kg·m–3] | 7440 (293K) |
| Główny stopień utlenienia | +2 (-3; -2; -1; 0; +1; +3; +4; +5; +6; +7) |
| Izotopy: | masa - zawartość - okres półrozpadu |
| 53Mn 54Mn 55Mn 56Mn |
52,941 - 0% - 2×106 lat 53,940 - 0% - 303 dni 54,938 - 100% - stabilny 0% - 2,576 godz. |
| Temperatura topnienia [K] | 1519K |
| Temperatura wrzenia [K] | 2235K |
| Promień atomowy [pm] | 124 |
| Powinowactwo elektronowe [kJ·mol–1] | <0 |
| Energia jonizacji [kJ·mol–1] | 717,4 Mn → Mn+ 1509 Mn+ → Mn2+ 3248,4 Mn2+ → Mn3+ |
| Elektroujemność (Pauling) | 1,55 |
Technet
Technet jest jednym z pierwiastków należących do bloku metali przejściowych. Wszystkie izotopy tego srebrzystoszarego metalu są promieniotwórcze. Nie występuje on w przyrodzie poza minimalnymi, śladowymi ilościami (w 1988 roku odkryto pewne ilości technetu w rudzie molibdenu w Kolorado) i jest pierwszym pierwiastkiem sztucznie wytworzonym przez człowieka. Istnieje wiele izotopów technetu o masach atomowych od 90 do 111, Najtrwalszy to jest 99Tc. Własnościami chemicznymi przypomina ren i ruten. W temperaturach bliskich zeru bezwzględnemu (ok. 8K) technet wykazuje własności nadprzewodzące. Tworzy związki głownie na +7, +6, +5 i +4 stopniu utlenienia. Praktycznie nie występuje w przyrodzie. Powstaje (99Tc) głównie dzięki reakcji rozszczepienia 235U. Nie znalazł dotychczas szerszego zastosowania. Interesującą wydaje się jego zdolność do absorbowania powolnych neutronów. Ze względu na promieniotwórczość, używany jest w niewielkich ilościach w medycynie. Znalazł zastosowanie jako źródło promieniowania beta do jonizowania lamp wyładowczych. Wykorzystywany jest także jako katalizator. Niewielkie domieszki technetu zwiększają odporność stali na działanie kwasów.
Związki technetu:
- +4 stopień utlenienia
tlenek technetu(IV) – TcO2 – powstaje podczas redukcji roztworów technetanów(VII) cynkiem i kwasem solnym w postaci uwodnionej TcO2·2H2O. Ogrzewany w próżni ulega odwodnieniu w temperaturze 473K.
siarczek technetu(IV) – TcS2 – jest produktem termicznego rozkładu siarczku technetu(VII). Występuje w formie bezpostaciowej i krystalicznej. Postać krystaliczną można otrzymać gdy proces rozkładu prowadzi się w temperaturze 1273K i w obecności siarki.
chlorek technetu(IV) – TcCl4 – powstaje w wyniku bezpośredniej syntezy z pierwiastków. Tworzy czerwone, paramagnetyczne kryształy. Rozpuszczony w kwasie solnym tworzy umiarkowanie trwały anion heksachlorotechnetanowy(IV) [TcCl6]2–.
heksafluorotechnetan(IV) potasu – K2[TcF6] – powstaje przez stapianie heksachloro- lub heksabromotechnetanów(IV) z wodorofluorkiem potasu. Można z niego otrzymać w wyniku wymiany jonowej wolny kwas.
heksachlorotechnetan(IV) potasu – K2[TcCl6] – otrzymuje się w wyniku redukcji technetanu(VII) potasu kwasem solnym w obecności jodku potasu. Sól ta jest nietrwała ulegając utlenieniu do jonu TcO4–. Działanie HBr lub HI na K2[TcCl6] prowadzi do otrzymania K2[TcBr6] i K2[TcI6].
- +5 stopień utlenienia
fluorek technetu(V) – TcF5 – powstaje jako produkt uboczny w procesie syntezy fluorku technetu(VI) w procesie bezpośredniej syntezy z pierwiastków. W wyniku reakcji TcF5 z fluorkami litowców w IF5 powstają heksafluorotechnetany(V).
tlenochlorek technetu(V) – TcOCl3 – powstaje obok innych związków podczas chlorowania TcO2. Tworzy brunatne kryształy sublimujące w temperaturze 1173K.
tlenobromek technetu(V) – TcOBr3 – powstaje analogicznie jak TcOCl3 obok innych związków podczas reakcji TcO2 z Br2 w temperaturze około 623K. Brunatne ciało stałe sublimujące w temperaturze 673K.
- +6 stopień utlenienia
Jony TcO42- są trwałe w roztworze wodnym tylko w środowisku silnie zasadowym. W innych warunkach dysproporcjonują:
3TcO42– + 2H2O → 2TcO4– + TcO2 + 4OH–
Związki technetu(VI) w roztworze wodnym łatwo utleniają się do technetu(VII).
Bezpośrednie fluorowanie technetu w reaktorze niklowym w temperaturze 673K prowadzi do powstania fluorku technetu(VI) TcF6, który występuje w postaci żółtozielonych kryształów o temperaturze topnienia 306K i wrzenia 328K.
chlorek technetu(V) –TcCl6 – powstaje w postaci zielonych kryształów podczas chlorowania technetu wolnym chlorem. W temperaturach wyższych od pokojowej rozkłada się na TcCl4 i Cl2.
- +7 stopień utlenienia
tlenek technetu(VII) – Tc2O7 – powstaje w wyniku spalenia technetu w atmosferze tlenu w temperaturze 773K. Jest żółtym, krystalicznym ciałem stałym o temperaturze topnienia 393K i wrzenia 584K.
kwas technetowy(VII) – HTcO4 – powstaje w wyniku rozpuszczenia tlenku techentu(VII) w wodzie. Z roztworów wodnych o zabarwieniu słabo różowym krystalizuje w postaci czerwonych igieł. Sole tego kwasu w kwasie solnym o stężeniu 2 do 4 mol·dm–3 reagują z siarkowodorem tworząc siarczek Tc2S7. Techentany(VII) rozpuszczone w etylenodiaminie ulegają reakcji z potasem z utworzeniem nonahydrydotechentanu(VII) potasu – K2[TcH9].
tlenofluorek technetu(VII) – TcO3F – jest produktem reakcji tlenku techentu(IV) z wolnym fluorem; żółta ciecz o temperaturze topnienia 291K i wrzenia 373K. Związek atakuje szkło pyreksowe dlatego musi być przechowywany w naczyniach z niklu. Pod działaniem wody hydrolizuje do kwasu techentowego(VII) i fluorowodoru.
| Konfiguracja elektronowa | Kr 4d55s2 |
| Masa atomowa | 98,906 |
| Gęstość [kg·m–3] | 11500 (293K) |
| Główne stopnie utlenienia | +4; +5; +7 (-1; 0; +6) |
| Izotopy: | masa - zawartość - okres półrozpadu |
| 97Tc 98Tc 99Tc |
0% - 2,6×106 lat 97,911 - 0% - 1,5×106 lat 98,90 - 0% - 2,12×105 lat |
| Temperatura topnienia [K] | 2477 |
| Temperatura wrzenia [K] | 4538 |
| Promień atomowy [pm] | 135,8 |
| Powinowactwo elektronowe [kJ·mol–1] | 96 |
| Energia jonizacji [kJ·mol–1] | 702 Tc → Tc+ 1472 Tc+ → Tc2+ 2850 Tc2+ → Tc3+ |
| Elektroujemność (Pauling) | 1,9 |
Ren
Ren jest rzadkim, srebrzystym metalem przejściowym. Jego istnienie i właściwości (podobne do manganu) przewidział w 1871 roku Dymitrij Iwanowicz Mendelejew. Metaliczny ren jest bardzo twardy. Pośród metali jedynie wolfram jest od tego pierwiastka trudniej topliwy. Tworzy związki głównie na +7, +6, +5, +4 i +3 stopniu utlenienia. Występuje tylko w postaci związków. Towarzyszy rudom molibdenu. Pod względem występowania w wierzchniej warstwie skorupy ziemskiej (litosfera, hydrosfera, atmosfera) zajmuje 79 miejsca (procenty wagowe). Używany jest do produkcji włókien żarzeniowych, elektrod spawalniczych, termopar. Znalazł zastosowanie także w kriogenice i w chemii jako katalizator.
Związki renu:
+3 stopień utlenienia
tlenek renu(III) – Re2O3 – uwodniony tlenek otrzymuje się przez dodanie ługu do roztworu chlorku renu(III). Woda bardzo łatwo utlenia go do tlenku renu(IV).
chlorek renu(III) – Re3Cl9 – ciemnofioletowe kryształy o temperaturze topnienia 530K i wrzenia 600K otrzymuje się przez termiczny rozkład ReCl5 w atmosferze azotu. W temperaturze powyżej 723K rozkłada się na ren i ReCl5.
bromek renu(III) – Re3Br9 – czerwonobrunatny związek otrzymywany przez termiczny rozkład ReBr5 lub Ag2[ReBr6].
jodek renu(III) – Re3I9 – czarny związek powstający w reakcji kwasu renowego(VII) ze stężonym HI i etanolem w podwyższonej temperaturze lub w wyniku termicznego rozkładu ReI4 w atmosferze jodu.
- +4 stopień utlenienia
tlenek renu(IV) – ReO2 – bezwodny tworzy czarne kryształy powstające podczas redukcji tlenku renu(VII) metalicznym renem lub wodorem w temperaturze 573K. W temperaturze ponad 1273K rozkłada się na ren i tlenek renu(VII). Uwodniony tlenek ReO2·2H2O powstaje podczas hydrolizy chlorku renu(V) lub działania reduktorów na reniany(VII).
siarczek renu(IV) – ReS2 – daje się otrzymać w wyniku bezpośredniej syntezy z pierwiastków lub przez termiczny rozkład siarczku renu(VII).
fluorek renu(IV) – ReF4 – żółtozielone kryształy o temperaturze topnienia 398K i wrzenia około 1026K, w temperaturach powyżej 573K sublimuje. Otrzymuje się go przez termiczny rozkład fluorku renu(V) w temperaturze około 423K lub w wyniku redukcji ReF5 renem w temperaturze 773K. Ulega hydrolizie z utworzeniem ReO2 i HF.
chlorek renu(IV) – ReCl4 – czarnobrunatne kryształy tworzące się podczas reakcji ReO2·2H2O z SOCl2 lub ogrzewania ReCl5 w mieszaninie CCl4 z 1,1,2,2-tetrachloroetanem. Składa się z cząsteczek Re3Cl12 na co wskazują pomiary podatności magnetycznej.
bromek renu(IV) – ReBr4 – ciemnoczerwone kryształy powstające w wyniku redukcji kwasu renowego(VII) za pomocą HBr lub rozpuszczenia tlenku renu(IV)
- +5 stopień utlenienia
tlenek renu(V) – Re2O5 – niebieski związek powstający podczas elektrolizy renianu(VII) w roztworze kwasu siarkowego(VI). w temperaturach powyżej 473K rozkłada się.
tlenek renu(V) – ReF5 – żółtozielone kryształy o temperaturze topnienia 321K i wrzenia 494K powstające w reakcji fluorku renu(VI) z WF6 i W(CO)6. W temperaturach ponad 413K dysproporcjonuje na ReF6 i ReF4.
chlorek renu(V) – ReCl5 – brunatne kryształy o temperaturze topnienia 533K i wrzenia około 633K powyżej temperatury 423K sublimuje. Powstaje w wyniku chlorowania proszku renu w temperaturze 773-973K.
tlenochlorek renu(V) – ReOCl3 – powstaje w reakcji ReCl5 z ReO2 lub w wyniku fotochemicznego rozkładu ReOCl4 pod działaniem światła o długości fali 350 nm.
bromek renu(V) – ReBr5 – zielononiebieskie ciało stałe powstające podczas przepuszczania par bromu rozcieńczonych azotem nad metalicznym renem w temperaturze 923K. Podczas ogrzewania rozkłada się na Re3Br9 i Br2.
- +6 stopień utlenienia
tlenek renu(VI) – ReO3 – czerwone kryształy o temperaturze topnienia 433K. Można otrzymać w wyniku pirolizy adduktu tlenku renu(VII) z 1,4-dioksanem. W temperaturach powyżej 573K ulega dysproporcjonacji:
3ReO3 → ReO2 + Re2O7
Analogicznie reaguje z wodorotlenkiem sodu dając renian(VII). Rozpuszcza się w kwasach utleniających i alkalicznym roztworze nadtlenku wodoru z utworzeniem renianów(VII). W wyniku stopnia z wodorotlenkami litowców w warunkach beztlenowych powstają reniany(VI) M2IReO4.
fluorek renu(VI) – ReF6 – bladożółte kryształy o temperaturze topnienia 292K i wrzenia 321K; powstaje podczas działania fluorem na metaliczny ren zastosowany w nadmiarze. Hydrolizuje do ReO2, HReO4 i HF.
tlenofluorek renu(VI) – ReOF4 – powstaje podczas reakcji fluorku renu(VI) z karbonylkami metali; niebieskie kryształy o temperaturze topnienia 381K i wrzenia 445K.
chlorek renu(VI) – ReCl6 – zielonobrunatne kryształy o temperaturze topnienia 295K. Powstaje w wyniku chlorowania silnie rozdrobnionego renu mieszaniną chloru i azotu w stosunku 1:1 w temperaturze 923K.
tlenochlorek renu(VI) – ReOCl4 – tworzy zielonobrunatne kryształy o temperaturze topnienia 303K i wrzenia 501K. Powstaje w wyniku reakcji chlorku renu(III) z tlenkiem renu(VII) lub podczas działania tlenu na chlorek renu(III).
tlenobromek renu(VI) – ReOBr4 – niebieski związek powstający podczas ogrzewania metalicznego renu w strumieniu tlenu i bromu. W temperaturach ponad 353K rozkłada się tlenotribromek renu(V).
+7 stopień utleniena
tlenek renu(VII) – Re2O7 – żółte kryształy o temperaturze topnienia 574K i wrzenia 635K. Powstaje w wyniku spalania renu w strumieniu tlenu w temperaturze 423K. Jest związkiem silnie higroskopijnym. Rozpuszcza się w wodzie z utworzeniem kwasu renowego(VII) HReO4, który nie został wydzielony z roztworu w stanie wolnym.
siarczek renu(VII) – Re2S7 – powstaje w reakcji Re2O7 z suchym siarkowodorem lub podczas wprowadzania siarkowodoru do roztworów renianów(VII). Działanie alkalicznym roztworem nadtlenku wodoru na siarczek renu(VII) prowadzi do utlenienia siarki i wydzielenia kwasu renowego(VII).
fluorek renu(VII) – ReF7 – bladoniebieskie, higroskopijne kryształy o temperaturze topnienia 321K powstające podczas działania fluorem na metaliczny ren w temperaturze 573K-673K.
tlenofluorek renu(VII) – ReOF5 – bezbarwne kryształy o temperaturze topnienia 314K i wrzenia 346K powstające podczas reakcji renianu(VII) potasu z fluorem w temperaturze 373K.
ditlenofluorek renu(VII) – ReO2F3 – żółte kryształy o temperaturze topnienia 363K i wrzenia 458K. Powstaje obok tlenopentafluorku renu(VII) w tych samych warunkach reakcji.
tritlenofluorek renu(VII) >– ReO3F – żółte kryształy o temperaturze topnienia 420K i wrzenia 437K; powstaje w wyniku działania fluorku jodu(V) na silnie rozdrobniony renian(VII) potasu.
tritlenochlorek renu(VII) – ReO3Cl – bezbarwna ciecz o temperaturze topnienia 278K i wrzenia 405K. Powstaje w wyniku chlorowania tlenku renu(VI) w temperaturze 433-463K. W zetknięciu z rtęcią, srebrem lub smarem ze szlifów rozkłada się z wydzieleniem tlenku renu(VI).
tritlenobromek renu(VII) – ReO3Br – bezbarwne kryształy o temperaturze topnienia 313K i wrzenia 436K. Powstaje w wyniku działania bromu na renian(VII) potasu, ReO3 lub Re2O7.
| Konfiguracja elektronowa | Xe]4f145d56s2 |
| Masa atomowa | 186,2 |
| Gęstość [kg·m–3] | 21020 (293K) |
| Główny stopień utlenienia | +3; +4; +5 (-3; -1; 0; +1; +2; +3; +6; +7) |
| Izotopy: | masa - zawartość - okres półrozpadu |
| 190Re 192Re 194Re 195Re |
184,9 - 37,4% - stabilny 0% - 88,9 godz. 186,9 - 62,6% - 4×1010 lat 0% - 16,7 godz. |
| Temperatura topnienia [K] | 3453 |
| Temperatura wrzenia [K] | 5900 |
| Promień atomowy [pm] | 137 |
| Promień jonowy [pm] Re+4 Re+7 |
77 67 |
| Powinowactwo elektronowe [kJ·mol–1] | 37 |
| Energia jonizacji [kJ·mol–1] | 760 Re → Re+ 1260 Re+ → Re2+ 2510 Re2+ → Re3+ 3640 Re3+ → Re4+ |
| Elektroujemność (Pauling) | 1,46 |