 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Elektrochemia
Elektrochemia
Humphry Davy urodził się w Penzance w 1778 roku. W 1795 r., wkrótce po śmierci ojca, został uczniem aptekarza i zaczął przygotowywać się do zawodu lekarza. W 1797 roku angielskie tłumaczenie dzieła Lavoisiera trafiło do rąk Davy’ego, który przeprowadził swoje eksperymenty wykorzystując prostą aparaturę stosowaną w operacjach chirurgicznych, a w następnym roku udał się do Clifton gdzie rozpoczął prace jako kierownik laboratorium utworzonego przez dr Thomasa Beddoesa w Instytucie Pneumatycznym, gdzie badano wpływ różnych nowo odkrytych gazów na ludzkie ciało. W ramach badań Davy zebrał materiały do swojej publikacji, Researches Chemical and Philosophical, chiefly con¬ cerning Nitrous Oxide or Dephlogisticated Nitrous Air and its Respiration, wydanej w 1800 roku. Opisuje w niej szereg analiz związków tlenu z azotem, metody syntezy niektórych substancji, w tym, odkrytego wcześniej przez Bertholleta w 1785 r., tlenku diazotu przez ogrzewanie azotanu(V) amonu i jego działanie na organizm ludzki. W kwietniu 1799 r. wdychał czysty tlenek diazotu i odkrył jego niezwykłe działanie fizjologiczne. Po okresie rekonwalescencji, który był wynikiem wdychania różnych gazów, zaczął, w 1800 r., badać nowo odkryty stos Volty nadal w Instytucie Pneumatycznym. Jednak nuż w styczniu 1801 r. pisze do swojej matki: „Być może słyszałaś o Royal Philosophical Institution, założonej przez hrabiego Rumforda i innych arystokratów. Jest to bardzo ceniona instytucja, która ma stać się miejscem skupiającym utalentowane osoby działające na rzecz powszechnego użytku. Hrabia Rumford zaproponował mi uczestnictwo w tym gronie.” W następnym miesiącu H. Davy został członkiem towarzystwa.
Benjamin Thompson (hrabia Rumford), znany jest głównie ze swoich badań nad ciepłem, które wykazały, że nie jest to twór materialny ale forma ruchu cząstek ciał, i który przedstawił jako pierwszy wartość mechanicznego równoważnika ciepła. Rumford odegrał kluczową rolę w założeniu w 1799 r. Royal Institution w Londynie, jednego z najbardziej znanych stowarzyszeń naukowych, które swoją początkową reputację zawdzięcza głównie H. Davy'emu i M. Faradayowi. Celem towarzystwa było „rozpowszechnianie wiedzy… o nowych, użytecznych wynalazkach oraz udoskonaleniach technicznych; a także prowadzenia nauczania, poprzez regularne kursy, wykłady filozoficzne i eksperymenty, wdrażanie nowych odkryć naukowych do doskonalenia sztuki i produkcji”. Pojawienie się w tym gronie Davy'ego ze swoim tlenku diazotu wzbudziło dodatkowe zainteresowanie wykładami, a nauka stała się modna. To właśnie Davy kształtował charakter Royal Institution. Powrócił do badań elektryczności, a 1806 r. w ramach wykładów bakeriańskich zaprezentował „On some Chemical Agencies of Electricity”, za który otrzymał nagrodę 3000 franków ufundowaną przez Napoleona, który uznał za najważniejsze badania naukowe tego roku prace nad elektrycznością. Wkrótce osiągnięcie to zostało przyćmione przez wykładem dla Towarzystwa Królewskiego wygłoszonym w listopadzie 1807 r., zatytułowanym „On some new phenomena of chemical changes produced by electricity, particularly the decomposition of the fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies.”
Odkrycie metali alkalicznych
Czytając dzieło Lavoisiera, Davy’ego musiało zastanowić stwierdzenie: „wydaje się, że tlen jest tworzy wiązanie łączące metale i kwasy; na tej podstawie przypuszczamy, że tlen jest zawarty we wszystkich substancjach o silnym powinowactwie do kwasów. Jest zatem bardzo prawdopodobne, że cztery silnie alkaliczne ziemie zawierają tlen... najprawdopodobniej mogą to być tlenki metali”. R. Kerr, który tłumaczył dzieło Lavoisiera, zasugerował, że „możemy założyć, że potaż jest… metaliczną substancją, w jakimś nieznanym dotąd połączeniu.” Lavoisier, chociaż podejrzewał, że potaż i soda nie były pierwiastkami, nie uważał ich za tlenki metali, ale (analogicznie do amoniaku) sądził, że mogą zawierać azot. Davy z początku uważał, że mogą zawierać fosfor lub siarkę w połączeniu z azotem. Pod koniec notatki z roku 1806 Davy przedstawia co najmniej trzy sugestie, a z jednej z nich wynika, że: „Jeśli związek chemiczny ma taki charakter jak przypuszczam, to niezależnie od tego jakkolwiek silna może być naturalna energia elektryczna elementów ciała, istnieje wszelkie prawdopodobieństwo ograniczenia ich siły; mając na uwadze, że moc naszych instrumentów wydaje się być zdolna do nieograniczonego wzrostu.” Możemy zatem „mieć nadzieję, że nowy sposób analizy może doprowadzić nas do odkrycia prawdziwych składników ciał”.
W 1807 roku Davy ogłosił dokonanie rozkładu alkaliów za pomocą elektryczności. „Potaż, wysuszony przez prażenie, jest nieprzewodzący, a jednak przekształcony w przewodnik przez niewielki dodatek wilgoci, który nie zmniejsza zauważalnie jego agregacji, łatwo w tym stanie rozpływa się i rozkłada pod wpływem silnych prądów elektrycznych. Mały kawałek czystego potażu, który przez kilka sekund był wystawiony na działanie atmosfery, aby nadać powierzchni przewodnictwo, umieszczono na platynowym dysku połączonym z ujemną stroną baterii (złożonej z 250 płyt cynkowych i miedzianych o wymiarach 6 na 4 cale) o dużej intensywności; drut platynowy, połączony z dodatnim biegunem, został umieszczony w kontakcie z górną powierzchnią zasady. Całość pozostawała otwarta na wpływy atmosferyczne. W tych okolicznościach szybko zaobserwowano topnienie potażu przy obydwu punktach styku z baterią. Na górnej powierzchni pojawiło się gwałtowne musowanie; na dolnej, lub ujemnej, powierzchni nie było widać powstawania płynu, natomiast pojawiły się małe kulki o metalicznym połysku, podobne do rtęci, z których jedne zapalały się jasnym płomieniem eksplodując natychmiast po utworzeniu, inne pozostając ulegały zmatowieniu, pokrywając się białym nalotem, który formował się na ich powierzchni. Te kuleczki, jak pokazały liczne eksperymenty, okazały się substancją, której poszukiwałem, i która jest szczególnie łatwopalną zasadą stanowiącą podstawę potażu.”
Odkrycia tego dokonano 6 października 1807 r.; sód został odkryty w podobny sposób kilka dni później. John Davy pisze, że gdy jego brat „zobaczył, jak maleńkie kulki potasu przedzierają się przez skorupę potażu i zapalają w kontakcie z atmosferą, nie mógł powstrzymać swojej radości - w ekstazie okrążał pokój, potrzebując czasu, aby ochłonąć na tyle by móc kontynuować eksperyment.” Zapis w notatniku Davy'ego kończy się stwierdzeniem: „Wspaniały eksperyment, dowodzący rozkładu potażu”.
W tekście z 1808 r. „Electrochemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia” opisał wytwarzanie niewiellkich ilości magnezu, wapnia, strontu i baru przez ogrzewanie, otrzymywanych elektrolitycznie, amalgamatów,. Ziemie trudno było rozłożyć, ponieważ nie można ich było stopić aby przewodziły prąd, ale kiedy „baryty, strontity i wapno, lekko zwilżone, poddano działaniu prądu dostarczonego przez żelazne przewodniki pod warstwą nafty. . . obficie wydzielał się łatwopalny gaz; a ziemie w punktach gdzie stykały się z ujemnymi metalowymi drutami stawały się ciemne z małymi punktami o metalicznym połysku.” Następnie stwierdzono, że obiecujące wyniki uzyskano przez elektrolizę mieszaniny barytu i tlenku rtęci(II), gdzie powstał amalgamat baru. Prace zostały zawieszone do czasu, gdy w maju 1808 r. gotowa była nowa bateria. Davy dowiedział się od J. Berzeliusa i M. M. Pontina, że udało im się zredukować wapno i baryt dzięki katodom rtęciowym pozostającym w kontakcie z nimi. Davy potwierdził to doniesienie stwierdzając, że sole rozpuszczalne łatwiej rozłożyć na drodze elektrochemicznej. Próby redukcji tlenku glinu, tlenku cyrkonu i berylu nie przynosiły sukcesu, ale te z udziałem amalgamatów były interesujące. Berzelius i Pontin poinformowali Davy'ego, że elektroda rtęciowa w kontakcie z roztworem amoniakalnym pęcznieje i zestala się. Davy stwierdził, że najwygodniejszym sposobem uzyskania „amalgamatu z amoniaku” było połączenie kulki rtęci, spoczywającej w zagłębieniu w kawałku wilgotnego salmiaku, z biegunem ujemnym a rozkładanej soli z biegunem dodatnim lub poprzez działanie amalgamatu potasu na wilgotny salmiak. „Nie można sobie wyobrazić, że substancja, która tworzy z rtęcią tak doskonały amalgamat, nie ma mieć charakteru metalicznego; i zgodnie z tym. ,. można ją nazwać amonem.”
W długim artykule z roku 1808 „An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed; with some general observations on chemical theory” opisał wyizolowanie boru przez elektrolizę wilgotnego kwasu borowego umieszczonego między powierzchniami elektrod platynowych, i przez wygrzewanie kwasu borowego z potasem w rurce wykonanej ze złota.
Badania chloru
Artykuł z 12 lipca 1810 r. nosi tytuł „Researches on the oxymuriatic acid, its nature and combinations ; and on the elements of the muriatic acid : with some experiments on sulphur and phosphorus, made in the Laboratory of the Royal Institution” Jest to krótki artykuł, ale o znaczeniu porównywalnym z tym dotyczącym metali alkalicznych. C. Scheele w 1774 r. uzyskał nowy gaz działając tlenkiem manganu(IV) na kwas solny, który został otrzymany z soli i kwasu siarkowego(VI). Uważał go za kwas solny minus flogiston, lub ponieważ uważał flogiston za taki sam jak wodór, jak kwas solny minus wodór. Z kolei Lavoisier i szkoła francuska uważali ten gaz za utleniony kwas solny. A. Lavoisier i A. F. Fourcroy podkreślili, że skład kwasu solnego z tlenu i nieznanego rodnika oraz „kwasu oksymuriatowego” z tego samego rodnika i większej ilości tlenu był hipotetyczny, ale Berthollet w 1785 roku próbował przedstawić dowody eksperymentalne, szczególnie że roztwór „kwas oksymuriatowy” w wodzie po wystawieniu na działanie światła wydziela tlen pozostawiając pozostawia roztwór kwasu solnego. J. Gay-Lussac i L. J. Thenard w latach 1809–1811 nie byli w stanie wykryć obecności tlenu w „kwasie oksymuriatowym”, przepuszczając go przez mocno rozgrzany węgiel drzewny. Stwierdzono, że suche „muriaty” (np. srebra) nie uległy rozkładowi z wydzielaniem „kwasu muriatowego” podgrzewane z tlenkiem boru (B2O3) i węglem, chyba że w obecności wody. Przepuszczając gazowy „kwas muriatowy” przez podgrzany tlenek ołowiu(II), uzyskali „muriat” ołowiu i wodę, i doszli do wniosku, że w suchym gazowym „kwasie muriatowym” jedną czwartą masy stanowi woda. Gay-Lussac i Thenard w 1809 r. powiedzieli, że ich eksperymenty można wyjaśnić przy założeniu, że „kwas oksymuriatowy” jest pierwiastkiem, ale „wydaje nam się, że nadal można wyniki tych eksperymentów wyjaśnić lepiej, traktując „kwas oksymuriatowy” jako związek chemiczny.” Davy podjął próby uzyskania „kwasu muriatowego” wolnego od wody. Suchy siarczan(VI) żelaza(II), tlenku fosforu(V) i bezwodnika borowego silnie ogrzewany z suchym chlorkiem wapnia w rurkach porcelanowych lub żelaznych, nie tworzył gazu, „chociaż po dodaniu odrobiny wilgoci do mieszaniny, kwas muriatowy powstawał w takich ilościach, że niemal wywoływał eksplozję rurki”. Przez destylację korozyjnego sublimatu (chlorek rtęci(II)) z fosforem uzyskano ciecz, a gdy fosfor spalono, w retorcie, w gazowym kwasie oksymuriatowym „w górnej części retorty zbierał się biały sublimat [PCl5], a po bokach szyi retorty spływał, klarowny jak woda, płyn [PCl3]. Gaz zawarty w retorcie wydawał się całkowicie pochłonięty.”
„Jednym z najbardziej niezwykłych faktów, które zaobserwowałem w tym temacie ... jest to, że węgiel drzewny, nawet rozpalony do białości w gazach kwasu oksymuriatowego lub muriatowego, za pomocą ogniwa Volty, nie powoduje żadnych zmian; jeżeli tylko został wcześniej uwolniony od wodoru i wilgoci przez intensywne wygrzewanie w próżni. Ten eksperyment, który kilkakrotnie powtórzyłem, wzbudził moje wątpliwości co do obecności tlenu w tej substancji”. Pod działaniem kwasu oksymuriatowego na cynę tworzy się ług Libaviusa [SnCl4]: „jeśli substancja ta jest połączeniem kwasu muriatowego i tlenku cyny, to tlenek cyny powinien zostać oddzielony od niego działaniem amoniaku ... otrzymano substancje stałą o matowym, białym kolorze; część tej substancji została podgrzana, aby stwierdzić, czy zawiera tlenek cyny; ale całość ulotniła się, wytwarzając gęste, ostre gryzące opary. ... utworzyłem znaczną ilość stałego związku kwasu oksymuriatowego i fosforu przez spalanie i nasyciłem go amoniakiem ... w energetycznej reakcji z wydzieleniem znacznych ilości ciepła, utworzył się biały proszek”. Gdyby składał się on z fosforanu i muriatu amoniaku, to ten ostatni powinien zostać uwolniony ciepłem reakcji, pozostawiając tylko kwas fosforowy, ale „ku memu wielkiemu zaskoczeniu ... nie był wcale lotny ani rozkładany w tej temperaturze, i… nie wydzielał żadnych substancji gazowych.” Na proszek nie działały zwykłe odczynniki: „Jedynymi procesami, w których wydawało się że zachodzi rozkład, były spalanie lub działanie hydratu potażu (KOH)”. „Z tej serii obserwacji jasno wynika, że pogląd Scheele'a (choć zaciemniony terminami pochodzącymi z niejasnej i nieuzasadnionej ogólnej teorii) na temat natury kwasów oksymuriatowych i muriatowych można uznać za wykaz faktów; podczas gdy pogląd przyjęty przez francuską szkołę chemii, który do czasu drobiazgowego zbadania wydaje się tak satysfakcjonujący, opiera się na obecnym stanie naszej wiedzy, na hipotetycznych podstawach.” „Wywołałem silne iskry elektryczne, które przez kilka godzin przechodziły przez gaz oksymuriatowy pomiędzy elektrodami platynowymi, ale wydawało się, że nie ulega on najmniejszej zmianie.” Tlen nie został wydzielony z jego związków z fosforem, siarką i cyną po wystawieniu na działanie prądu z baterii składającej się z 1000-2000 płyt. „Być może niewiele substancji jest uważane za mniej kwaśne niż kwas oksymuriatowy… Nie uważajmy tego za szczególną zasadę zakwaszania i rozpuszczania, tworzącą związki z substancjami palnymi, analogicznie do kwasów zawierających tlen lub tlenki. .? Zgodnie z tą ideą kwas muriatowy można uznać za zawierający wodór jako podstawę, a kwas oksymuriatowy jako zasadę zakwaszania.” Ze względu na swój kolor kwas oksymuriatowy został nazywany chlorem Davy'ego. Po pewnym sprzeciwie poglądy Davy'ego zostały ogólnie zaakceptowane, a chlor zajmuje miejsce na liście pierwiastków.
W 1811 i 1815 r. Davy opisał dwa związki chloru z tlenem, otrzymane przez działanie kwasu chlorowodorowego (muriatowego) i kwasu siarkowego(VI) na chloran(V) potasu. Pierwszy z nich, nazwany euchloriną, został zbadany przez L Pebala, który określił jego skład jako mieszaninę chloru i dwutlenku chloru, który był drugim związkiem. Związki chloru z fosforem i siarką zostały zbadane w 1810 r., a w 1813 r. Davy opisał eksperymenty ze związkiem chloru i azotu, odkrytym przez P. L. Dulonga w 1812 r., i uzyskanym w wyniku działania nadmiaru chloru na amoniak. Związek jest niestabilny ulegając wybuchowemu rozkładowi. W późniejszych etapach pracy nad tymi związkami Davy’emu po raz pierwszy asystował M. Faraday. W 1812 roku opublikował Davy pierwszą (i jedyną) część Elements of Chemical Philosophy, a w kwietniu 1813 r. rozpoczął pracę nad otrzymaniem fluoru. Kierując się sugestią A. Ampere’a, był w stanie przedstawić dowody na to, że fluor jest pierwiastkiem podobnym do chloru oraz, że „kwas fluorowy”, uzyskiwany przez działanie kwasu siarkowego(VI) na fluoryt, ma podobny skład do kwasu chlorowodorowego. Natomiast nie był w stanie wyizolować wolnego fluoru, pierwiastek ten został po raz pierwszy wydzielony przez H. Moissana w 1886 r.
Jod
H. Davy zrezygnował z profesury w Royal Institution w 1813 r., obejmując stanowisko honorowe i wyruszył w podróż na kontynent mając u boku M. Faradaya jako sekretarza i asystenta. Specjalne pozwolenie na podróż po Europie wydał Napoleon, który niewątpliwie miał wysoką opinię o Davy. W Paryżu 13 grudnia 1813 r. został wybrany na członka korespondenta Akademii Francuskiej. W listopadzie 1813 r. A. Ampere przedstawił Davy'emu niewielką ilość „substancji X” odkrytej w 1811 przez B. Courtoisa w wyciągu z popiołu wodorostów. W dniu wyboru Davy'ego na członka Akademii odczytano list do Cuviera, w którym Davy najpierw przeprasza za wkroczenie w dziedzinę, o której wiadomo, że J. Gay-Lussac jest zaangażowany, a następnie zwraca uwagę, że „substancja X” jest pierwiastkiem analogicznym do chloru. Zbadał charakter tego pierwiastka, otrzymał kilka jego związków (w tym jodan(V) potasu i jodek fosfoniowy) wykorzystując niewielkie, laboratorium, z którym podróżował, i zasugerował dla niego nazwę iodine. Badania nad jodem Gay-Lussaca i Davy'ego były prowadzone jednocześnie i trudno jest ustalić priorytet w odkryciu tego pierwiastka, szczegółowe publikacje obydwu autorów ukazały się w 1814 roku. Gay-Lussac był zirytowany tym, co uważał za wtargnięcie w swoją własną dziedzinę.
Z Francji Davy udał się do Włoch, a we Florencji on i Faraday użyli silnej soczewki znajdujące się w Accademia del Cimento, aby spalić diament w tlenie i pokazać, że ma taki sam skład jak węgiel drzewny. Zbadali starożytne barwniki z Rzymu i Pompei, i określili, że czerwienie to minia, ochry żelazowe i cynober, a błękit był głównie mieszanką kredy z błękitem egipskim (palone wapno, piasek i miedź); zielenie były głównie związkami miedzi, a purpura była pochodzenia organicznego, prawdopodobnie o składzie zbliżonym do tak zwanej purpury tyryjskiej, czyli dibromoindygo.
Badania nad płomieniem
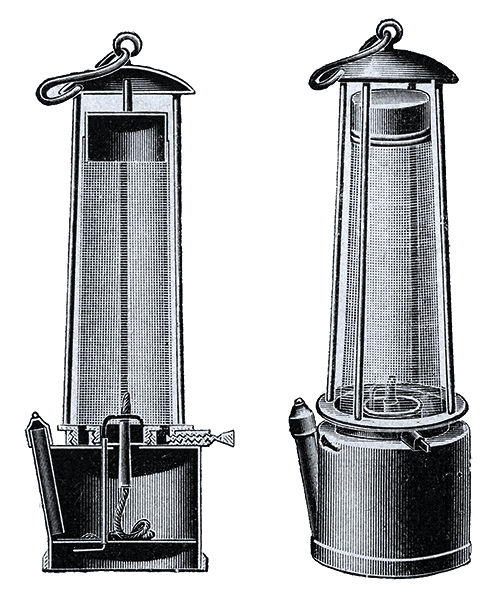 H. Davy wrócił do domu w kwietniu 1815 roku, a ogłoszenie przez Towarzystwo królewskie badań nad zapobieganiem wypadkom w kopalniach węgla (Society for preventing Accidents in Coal Mines), które pojawiło się po katastrofalnych eksplozjach w kopalniach, skłoniło Davy'ego do rozpoczęcia, w sierpniu tego roku, pracy nad zapewnieniem bezpieczeństwa w kopalniach przez konstrukcję odpowiedniej lampy dla górników. W ramach tych badań wykazał, że gazy łatwopalne charakteryzują się określonymi punktami zapłonu, a w szczególności metan, główny składnik gazu kopalnianego ma stosunkowo wysoką wartość punktu zapłonu. Stwierdził, że płomień można ugasić ochładzając mieszaninę gazów, a ponadto zastosowanie siatki osłaniającej płomień lampy ogranicza możliwość zainicjowania wybuchu rozpraszając ciepło płomienia i zapobiegając odiągnięciu punktu zapłonu przez gaz. Lampa Davy'ego składa się ze zwykłej lampy zamkniętej w cylindrze z drucianej siatki. Została ona przetestowana w 815 roku i do dziś pozostaje praktycznie w niezmienionej formie służąc do wykrywania metanu w atmosferze kopalni.
H. Davy wrócił do domu w kwietniu 1815 roku, a ogłoszenie przez Towarzystwo królewskie badań nad zapobieganiem wypadkom w kopalniach węgla (Society for preventing Accidents in Coal Mines), które pojawiło się po katastrofalnych eksplozjach w kopalniach, skłoniło Davy'ego do rozpoczęcia, w sierpniu tego roku, pracy nad zapewnieniem bezpieczeństwa w kopalniach przez konstrukcję odpowiedniej lampy dla górników. W ramach tych badań wykazał, że gazy łatwopalne charakteryzują się określonymi punktami zapłonu, a w szczególności metan, główny składnik gazu kopalnianego ma stosunkowo wysoką wartość punktu zapłonu. Stwierdził, że płomień można ugasić ochładzając mieszaninę gazów, a ponadto zastosowanie siatki osłaniającej płomień lampy ogranicza możliwość zainicjowania wybuchu rozpraszając ciepło płomienia i zapobiegając odiągnięciu punktu zapłonu przez gaz. Lampa Davy'ego składa się ze zwykłej lampy zamkniętej w cylindrze z drucianej siatki. Została ona przetestowana w 815 roku i do dziś pozostaje praktycznie w niezmienionej formie służąc do wykrywania metanu w atmosferze kopalni.
Łuk elektryczny został odkryty przez Davy'ego w 1812 r., wspomina punkt światła między punktami na elektrodach węglowych jako „tak żywy, że nawet światło słoneczne w porównaniu z nim wydawało się słabe”, a w 1821 r. uzyskał łuk długości 10 cm po rozładowaniu między węglowymi elektrodami podłączonymi do baterii złożonej z 2000 ogniw. W 1820 r. Davy został wybrany Prezesem Towarzystwa Królewskiego, ale zrezygnował z tego stanowiska w 1827 r., ze względu na stan zdrowia. Zmarł w Genewie w 1829 r.
Teoria elektrochemiczna
Powróćmy do elektrochemicznej teorii Davy'ego. Prace nad chemicznymi skutkami elektryczności rozpoczęto w 1800 r. ale wysunięta ówcześnie teoria nigdy nie została precyzyjnie sformułowana, a Faraday stwierdził, że „prawdopodobnie można opracować kilkanaście precyzyjnych schematów działania elektrochemicznego, różniących się zasadniczo od siebie, a jednak wszystkie zgadzają się z podanym tam stwierdzeniem” [tj. Davy’ego].
Davy wykazał, że ogniwo Volty złożone z dwóch metali i jednej cieczy można zastąpić jednym metalem i dwoma cieczami. Z dwóch metali, ten o większym powinowactwie do tlenu tworzy biegun dodatni w cieczy. Prąd elektryczny modyfikuje „chemiczne siły” materii, a w jednym fragmencie tekstu z 1806 roku sugeruje, że pomiary siły elektromotorycznej mogą służyć ustaleniu powinowactwa, jak to wiemy obecnie. Różnica potencjałów spowodowana kontaktem substancji jest porównywana z ich aktywnością chemiczną. Nawet substancje pozornie nierozpuszczalne, takie jak szkło, gdy zostaje zwilżone, może być rozkładane przez prąd, a kwasy mogą być transportowane przez roztwory alkaliczne, pod warunkiem, że nie ulegną wytrąceniu. Davy odrzuca teorię, że pojawienie się prądu powstaje przede wszystkim w wyniku działania chemicznego na tej podstawie, że prąd jest wytwarzany w wyniku zwykłego kontaktu substancji bez pojawienia się zmian chemicznych. Faraday uważał, że konieczna jest przemiana chemiczna, ale wydaje się, że pewne eksperymenty zadecydowały w tej materii na korzyść Volty i Davy'ego.
Davy pisze, że zmiany chemiczne i elektryczne „są pomyślane… jako odrębne zjawiska; ale wytwarzane przez tę samą moc, działając w jednym przypadku [elektrycznie] na masy, w drugim przypadku [chemicznie] na cząstki”. Źródłem siły elektromotorycznej jest kontakt, ale gdy metale zostają złączone, ładunki mają tendencję do neutralizacji, a przemiana chemiczna przywraca siłę elektromotoryczną. „Te same układy materii lub te same siły przyciągające, które rozdzielają ciała na naładowane dodatnio i ujemnie, tj. które czynią je elektrycznie przyciągającymi…. mogą również uczynić to samo z ich cząstkami, i w ten sposób umożliwić im łączenie się, gdy mają pełną swobodę ruchu ... Twierdzono, że przypuszczenie iż przemiany chemiczne były powodowane zmianami elektrycznymi jest dość zabawne; ale takie stwierdzenie jest dalekie od hipotezy, którą odważyłem się postawić.” Davy dodaje: „Niektórzy współcześni twierdzili, że istnieje płyn elektryczny z taką samą pewnością siebie, jak stwierdziliby istnienie wody. .. ale w duchu filozofii niemożliwe jest przyjęcie tak pochopnych uogólnień”.