 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Izomeria cis-trans
Izomeria cis-trans
Związki, w których rotacja wiązania jest ograniczona, mogą wykazywać izomerię cis-trans. Związki wykazujące tego typu izomerię nie powodują rotacji płaszczyzny światła spolaryzowanego (chyba że są również chiralne), a właściwości izomerów nie są identyczne. Dwa najważniejsze typy to izomeria wynikająca z obecności podwójnych wiązań oraz wynikająca z obecności pierścieni.
Izomeria cis-trans związana z wiązaniami podwójnymi
Wiadomo, że dwa atomy węgla w wiązaniu podwójnym C=C i cztery atomy bezpośrednio do nich przyłączone znajdują się w tej samej płaszczyźnie, co uniemożliwia obrót wokół wiązania podwójnego. Oznacza to, że w przypadku cząsteczki WXC=CYZ stereoizomeria występuje, gdy W≠X i Y≠Z. Istnieją dwa i tylko dwa izomery, każdy nakładający się na jego lustrzane odbicie, chyba że jeden z podstawników ma centrum stereogeniczne. Zauważmy, że przedstawione na rysunku wzory to diastereoizomery. Istnieją dwa sposoby nazwania takich izomerów.
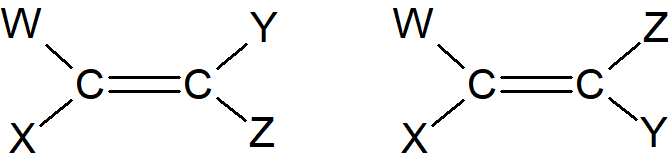
W starszej metodzie jeden izomer nazywa określa się jako cis, a drugi trans. Gdy W = Y, pierwszy z nich jest cis, a drugi to izomer trans. Niestety, nie ma łatwego sposobu na zastosowanie tej metody, gdy cztery podstawniki są różne. Nowsza metoda, którą można zastosować we wszystkich przypadkach, jest oparta na systemie Cahna–Ingolda–Preloga. Dwie grupy przy każdym atomie węgla są uszeregowane według reguł kolejności. Następnie ten izomer z dwiema wyższymi grupami po tej samej stronie podwójnego wiązania jest określany jako (Z) (od niemieckiego słowa zusammen oznaczającego razem); drugim jest izomer (E) (od entgegen czyli odwrotnie).
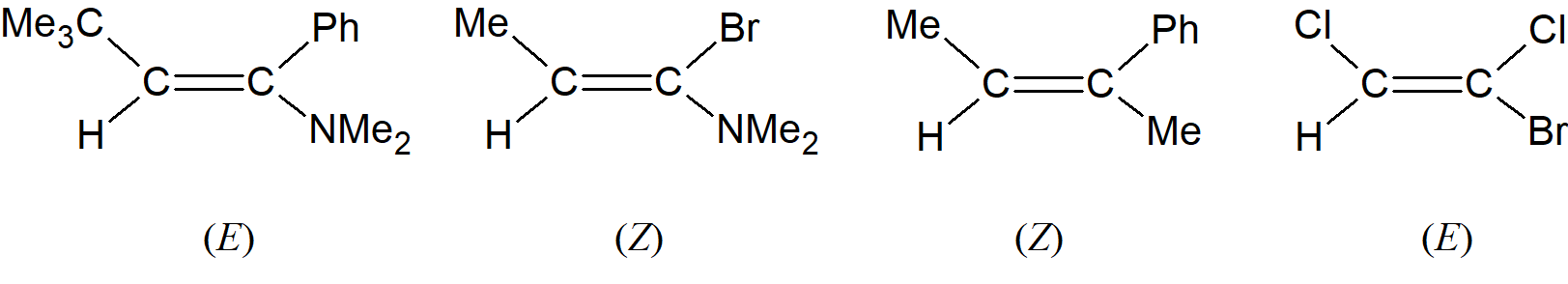
Zauważmy, że izomer (Z) niekoniecznie jest tym, który byłby izomerem cis w starszym systemie. Podobnie jak cis i trans, (E) i (Z) są używane jako przedrostki; przykładowo ostatni związek z przedstawionych powyżej nosi nazwę (E)-1-bromo-1,2-dichloroeten.
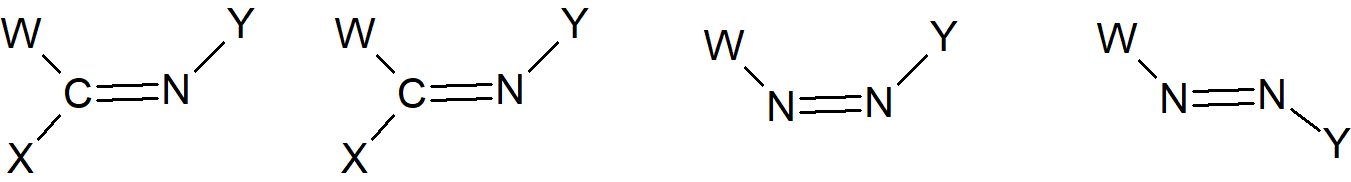
Ten typ izomerii jest również możliwy w przypadku obecności innych niż pomiędzy atomami węgla wiązań podwójnych, jak C=N, N=N lub C=S, chociaż w tych przypadkach występują tylko dwa lub trzy podstawniki przy atomach z podwójnym wiązaniem. W przypadku imin, oksymów i innych związków z ugrupowaniem C=N, jeśli W=Y, można nazwać używać przedrostów syn i anti, chociaż często stosowane są (E) i (Z). W związkach azowych, nie ma dwuznaczności. Pierwszy przedstawionych ze związków W–C=N–Y jest zawsze syn lub (Z) niezależnie od natury W i Y.
Jeśli w cząsteczce występuje więcej niż jedno wiązanie podwójne i jeśli przy każdym wiązaniu W≠X i Y≠Z, liczba izomerów w najbardziej ogólnym przypadku wynosi 2n, chociaż może być zmniejszona, jeśli niektóre podstawniki są takie same, jak w przypadku:
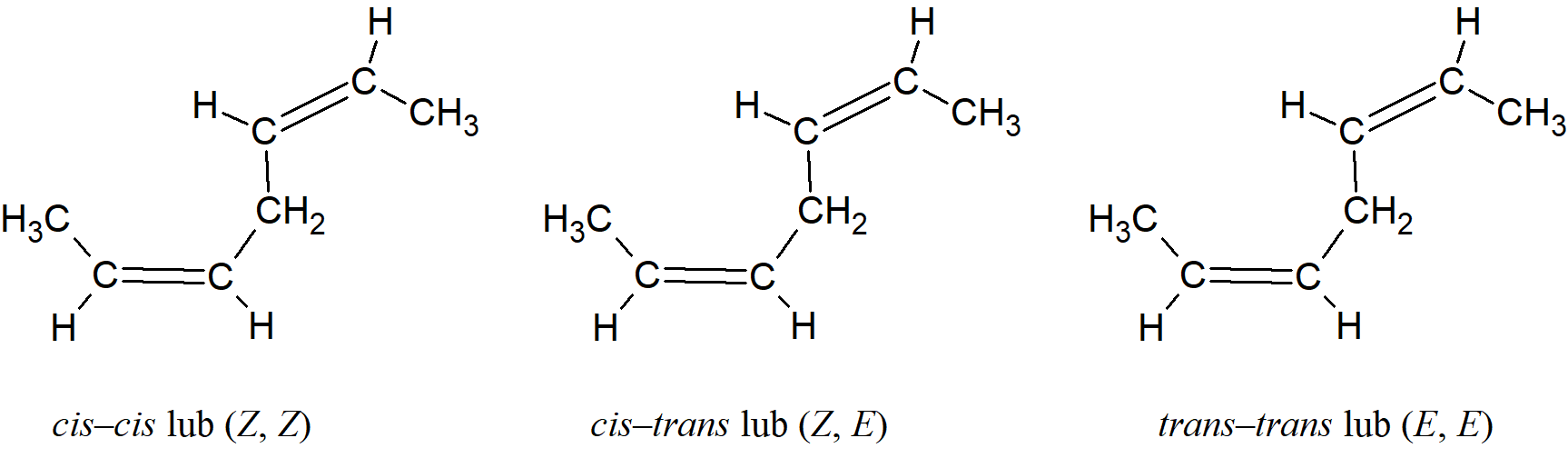
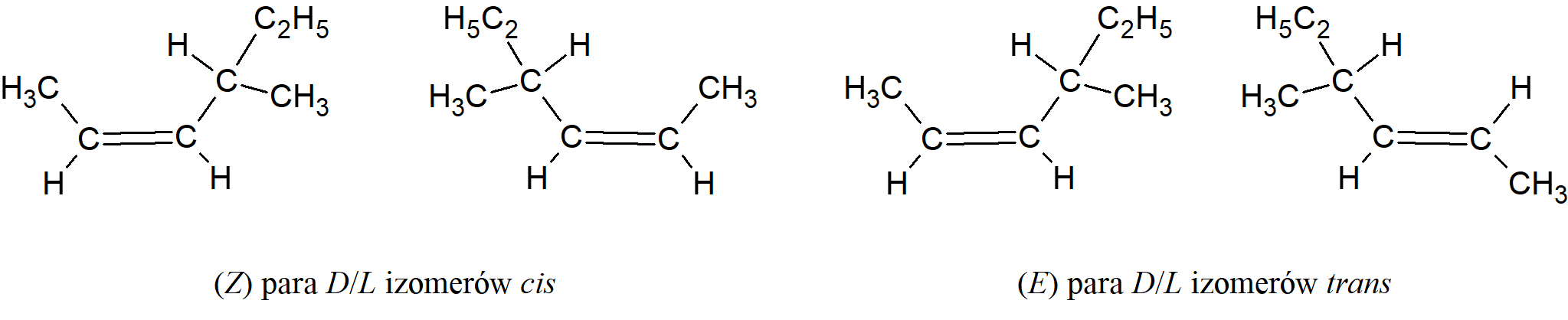
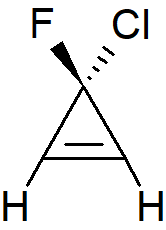
Gdy cząsteczka zawiera wiązanie podwójne i asymetryczny węgiel, istnieją cztery izomery, para enancjomerów cis i para trans:
Wiązania podwójne w cyklicznych alkenach od cyklopropenu do cykloheptenu nie mogą tworzyć układu trans. Jednak pierścień cyklooktenowy jest wystarczająco duży, aby umożliwić istnienie podwójnych wiązań w konfiguracji trans, a dla pierścieni większych niż 10– lub 11–członowe izomery trans są bardziej stabilne.
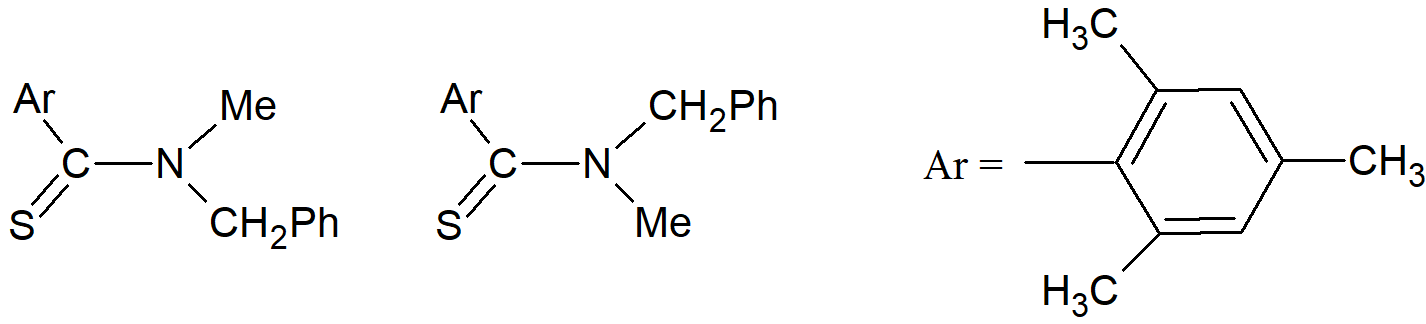
W kilku przypadkach rotacja wokół pojedynczego wiązania jest na tyle spowolniona, że izomery cis i trans mogą zostać wyizolowane. Jednym z przykładów jest N-metylo-N-benzylotiomesitylid, którego izomery są stabilne w stanie krystalicznym, ale ulegają wzajemnej przemianie z okresem półtrwania ~25 godzin w roztworze CDCl3 w temperaturze 50° C. Ten typ izomerii jest rzadki; występuje głównie w niektórych amidach i tioamidach, ponieważ rezonans nadaje pojedynczemu wiązaniu charakter podwójnego wiązania i spowalnia rotację.
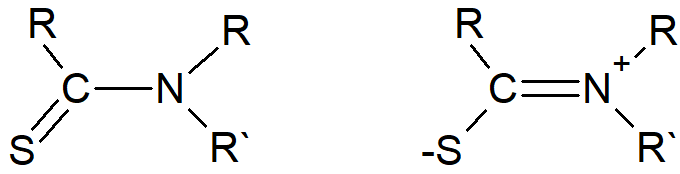
Istnieją również związki, w których możliwa jest prawie swobodna rotacja wokół tego, co formalnie jest wiązaniem podwójnym C=C. Związki te, zwane etylenami typu push-pull, mają dwie grupy odciągające elektrony na jednym węglu i dwie grupy elektronodonorowe na drugim.
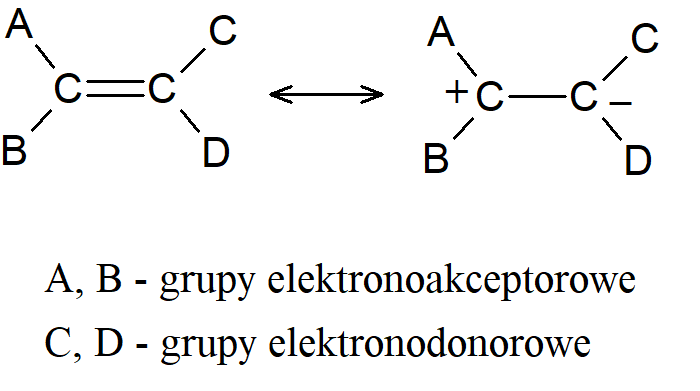
Udział dwujonowych form kanonicznych, takich jak ta pokazana, zmniejsza rząd wiązania formalnie podwójnego i umożliwia łatwiejszy obrót. Na przykład związek
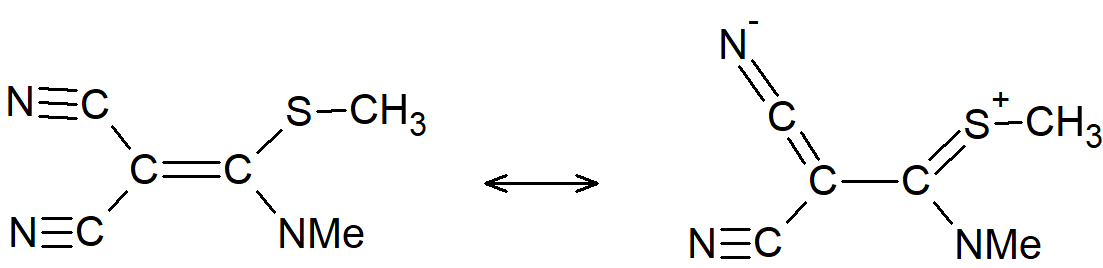
wykazuje barierę dla rotacji rzędu 13 kcal·mol–1 (55 kJ·mol–1), co jest niewielką wartością w porównaniu z typową 62–65 kcal·mol–1 (260–270 kJ·mol–1) charakterystyczną dla zwykłych alkenów.
Ponieważ są diastereomerami, izomery cis-trans zawsze różnią się właściwościami; różnice mogą wahać się od bardzo niewielkich do znacznych. Właściwości kwasu maleinowego są tak różne od właściwości kwasu fumarowego, że nie jest zaskakujące, iż mają one różne nazwy. Ponieważ na ogół mają one większą symetrię niż izomery cis, izomery trans w większości przypadków mają wyższe temperatury topnienia i niższe rozpuszczalności w rozpuszczalnikach. Izomer cis ma zwykle wyższe ciepło spalania, co wskazuje na niższą stabilność termochemiczną. Inne zauważalnie różne właściwości to gęstości, moc kwasów, temperatura wrzenia, Należy również zauważyć, że trans–alkeny są często bardziej stabilne niż cis–alkeny ze względu na zmniejszoną zawadę przestrzenną, ale nie zawsze tak jest. Wiadomo na przykład, że cis-1,2-difluoroeten jest bardziej stabilny termodynamicznie niż izomer trans. Wydaje się, że jest to spowodowane delokalizacją wolnych par elektronowych halogenów i konformacją antyperiplanarną sąsiednich wiązań.
Izomeria cis-trans związków jednopierścieniowych
Pomimo tego, że układy cykliczne o czterech i większej liczbie atomów węgla nie są generalnie płaskie potraktujemy je jako takie, ponieważ pozwala to na określenie prawidłowej liczby izomerów. Obecność pierścienia, podobnie jak w przypadku wiązania podwójnego, zapobiega rotacji. Izomery cis i trans są możliwe, jeśli w pierścieniu znajdują się dwa atomy węgla, z których każdy jest podstawiony dwoma różnymi grupami. Nie ma wymogu aby węgle te sąsiadowały ze sobą. Przykładowo:
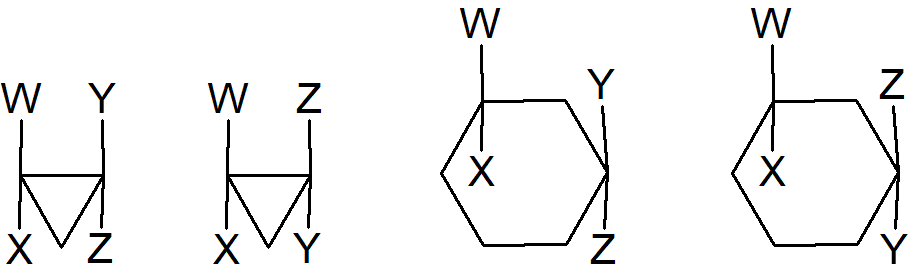
W niektórych przypadkach te dwa stereoizomery mogą się wzajemnie przekształcać. Na przykład w cyklopropanonach podstawionych cis i trans występuje odwracalna przemiana wzajemna, która faworyzuje bardziej stabilny izomer trans. Ta izomeryzacja związana jest z etapem rozerwania pierścienia i utworzeniem przejściowego układu oksyallilowego.
Podobnie jak w przypadku wiązań podwójnych, izomery cis i trans są możliwe pod warunkiem, że W może być równe Y i X może równać się Z, ale W nie może być równe X i Y nie może być równe Z. Istnieje ważna różnica w stosunku do wiązania podwójnego. Otóż podstawione węgle są sterogenne, co oznacza, że istnieją nie tylko dwa izomery. W najbardziej ogólnym przypadku, gdy W, X, Y i Z są różne, istnieją cztery izomery, ponieważ ani izomer cis, ani trans nie nakładają się na swoje lustrzane odbicia. Jest to prawdą niezależnie od rozmiaru pierścienia lub rodzaju węgla, z wyjątkiem pierścieni o parzystych ilościach węgli, gdy W, X, Y i Z znajdują się na przeciwległych węglach chiralność nie występuje. Przykładowo w
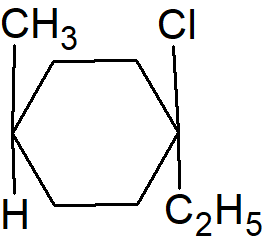
podstawione węgle nie są chiralne. Należy również zauważyć, że w takich związkach istnieje płaszczyzna symetrii. Gdy W=Y i X=Z, izomer cis zawsze nakłada się na swoje lustrzane odbicie, a zatem jest związkiem mezo, podczas gdy izomer trans składa się z pary D/L, z wyjątkiem przypadku opisanego powyżej. Znowu izomer cis ma płaszczyznę symetrii, podczas gdy trans takowej nie posiada.
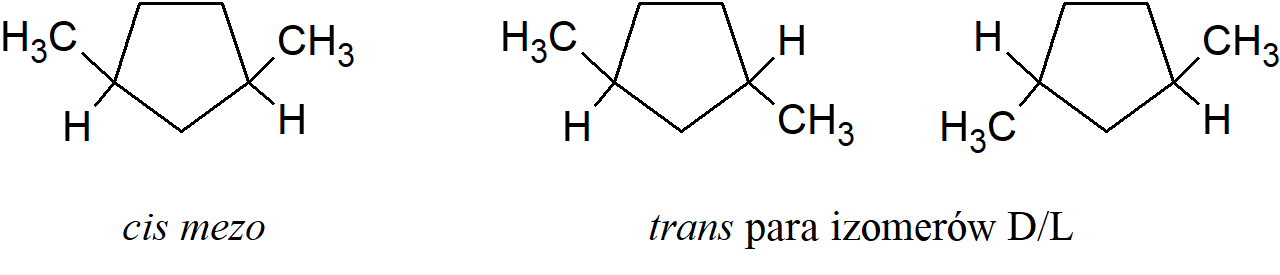
Cykliczne stereoizomery zawierające tylko dwa różnie podstawione atomy węgla są określane jako cis lub trans, symbole (Z, E) nie są stosowane dla związków cyklicznych. Jednak nazewnictwo cis-trans nie jest wystarczające dla związków z więcej niż dwoma różnie podstawionymi atomami. W przypadku tych związków stosowany jest system, w którym konfigurację każdej grupy podaje się w odniesieniu do grupy odniesienia, którą wybiera się jako grupę przyłączoną do członu pierścienia o najniższej numeracji z podstawnikiem powodującym izomerię cis-trans. Grupa odniesienia jest oznaczona symbolem r.
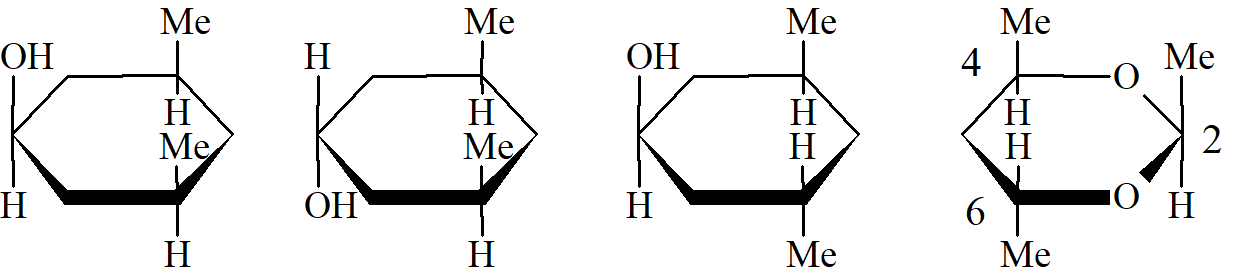
Trzy stereoizomery nazwane zgodnie z tym systemem to c-3,c-5-dimetylocykloheksan-r-1-ol, t-3,t-5-dimetylocykloheksan-r-1-ol i c-3,t-5-dimetylocykloheksan-r-1-ol. Ostatni przykład pokazuje zasadę, że gdy istnieją dwa równoważne sposoby obejścia pierścienia, wybiera się ścieżkę, która daje oznaczenie cis pierwszemu podstawnikowi po odnośniku. Innym przykładem jest r-2,c-4-dimetylo-t-6-etylo-1,3-dioksan.
Izomeria cis-trans alkanów policyklicznych
Układy bicykliczne to takie, w których dwa pierścienie mają dwa i tylko dwa wspólne atomy, i w tych wypadkach możemy wyróżnić jedynie izomerię cis lub trans, co widać na przykładzie dekaliny.

Jednakże, gdy pierścienie są wystarczająco małe, konfiguracja trans jest niemożliwa związek musi być izomerem cis. Najmniejsze trans izomer bicyklicznego węglowodoru alifatycznego jaki został otrzymany to trans-bicyklo[3.2.0]heptan zawierający pierścienie cztero– i pięcioczłonowy.
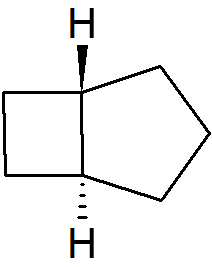
W przypadku układów bicyklo[2.2.0] znane są tylko izomery cis. Najmniejszym znanym układem trans zawierającym pierścień trójczłonowy jest bicyklo[4.1.0].
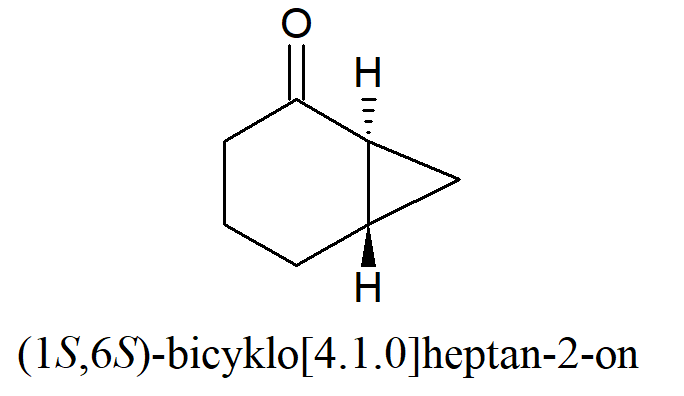
W przypadku gdy jeden pierścień jest trójczłonowy, a drugi ośmioczłonowy izomer trans jest bardziej stabilny niż odpowiadający mu izomer cis.
W bicyklicznych układach mostkowych dwa pierścienie mają więcej niż dwa wspólne atomy. W takich przypadkach może występować mniej niż 2n izomerów. Na przykład istnieją tylko dwa izomery kamfory (para enancjomerów), chociaż występują tu dwa chiralne atomy węgla. W obu przypadkach metyl i wodór przyjmują konfigurację cis.
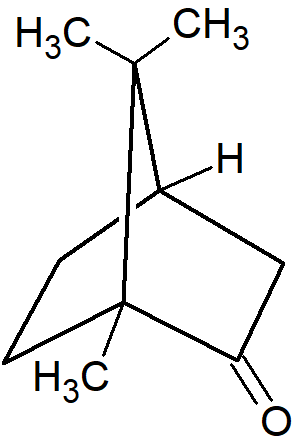
W tym przypadku para enancjomerów w konfiguracji trans jest niemożliwa Najmniejszym dotychczas przygotowanym mostkowym układem bicyklicznym, w którym występuje konfiguracja trans w obrębie mostka jest układ [4.3.1].
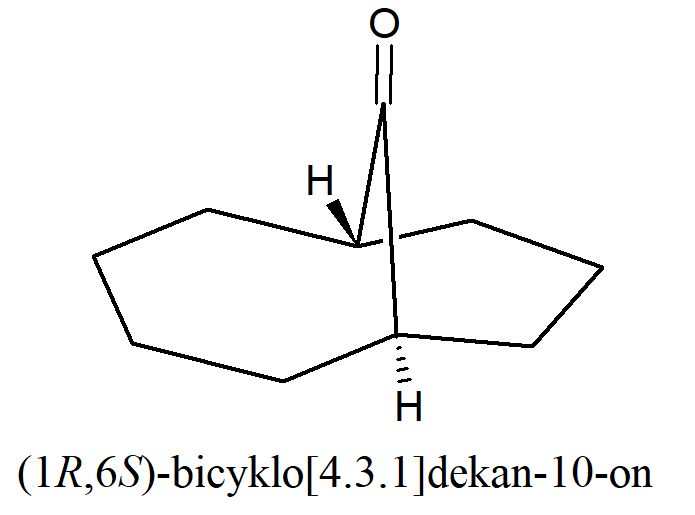
W tym przypadku występują cztery izomery ponieważ zarówno trans jak i cis są parami enancjomerów.
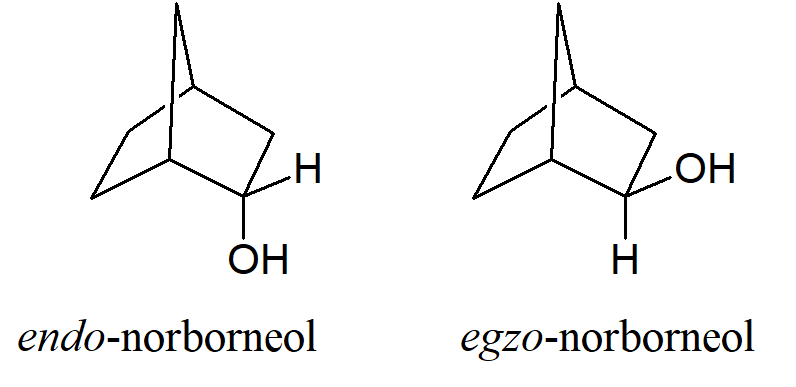
Kiedy w jednym z mostków układu bicyklicznego pojawia się podstawnik stosuje się przedrostki endo– i egzo–. Jeśli grupa (podstawnik) jest zorientowana w kierunku mostka o najwyższej numeracji, to otrzymuje deskryptor egzo–; jeśli jest skierowana w kierunku przeciwnym do mostka o najwyższej numeracji, otrzymuje deskryptor endo–.
Izomeria dośrodkowo-odśrodkowa
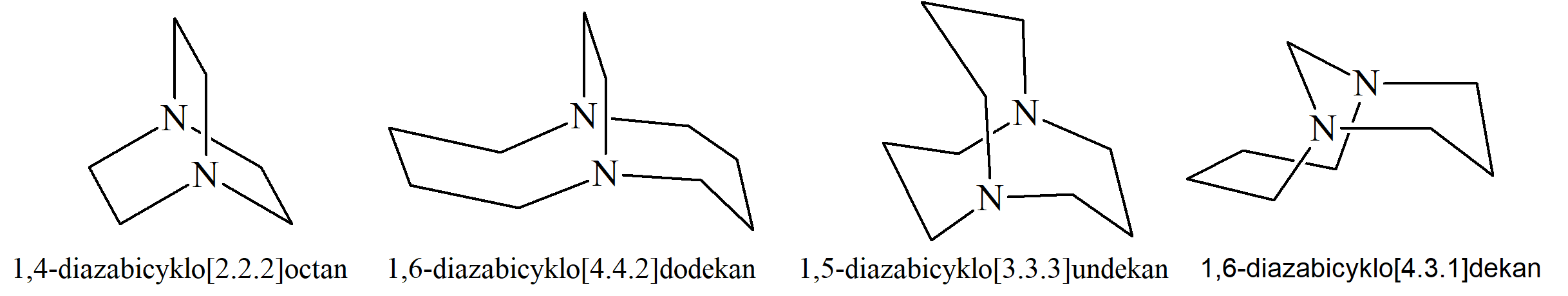
Inny typ stereoizomerii, zwany izomerią in – out (dośrodkowo-odśrodkowa), występuje w układach bicyklicznych mających mostki wystarczająco długie, aby możliwe było skierowanie wiązania bądź pary elektronów na atomie przyczółkowym na zewnątrz lub do wewnątrz struktury. Jeśli weźmiemy pod uwagę wolne pary elektronowe azotu to w 1,4-diazabicyklo[2.2.2]oktanie mamy konfigurację odśrodkowo-odśrodkową (out-out), 1,6-diazabicyklo[4.4.2]dodekanie konfigurację dośrodkowo-dośrodkową (in-in), w 1,5-diazabicyklo[3.3.3]undekanie atomy azotu są ułożone niemalże w płaszczyźnie, a w 1,9-diazabicyklo[4.3.1]dekanie mają konfigurację dośrodkowo-odśrodkową.
Atomy i grupy enancjotopowe i diastereotopowe
Wiele cząsteczek zawiera atomy lub grupy, które wydają się być równoważne, ale po dokładnym zbadaniu okazuje się, że są one w rzeczywistości różne. Można sprawdzić równoważność atomów zastępując każdy z nich po kolei jakimś innym atomem lub grupą. Jeśli nowe cząsteczki utworzone w tym procesie są identyczne, oryginalne atomy są równoważne; inaczej nie są. Konstytucyjnie identyczne atomy lub grupy w molekule, które są związane elementami symetrii tylko drugiego rodzaju (płaszczyzna symetrii, środek inwersji lub osie przemienne). Zamiana jednej z grup enancjotopowych na inną, prowadzi do jednego z enancjomerów. Analogicznie, jeśli kompleksowanie lub addycja do jednej z dwóch stron wyznaczonych przez podwójne wiązanie lub inną płaszczyznę molekularną prowadzi do chiralnego rodzaju, to takie dwie strony nazywamy enancjotopowymi.
W przypadku kwasu malonowego CH2(COOH)2, propanu CH2Me2 lub dowolnej innej cząsteczki postaci CH2Y2, zastąpienie którykolwiek z wodorów w grupie CH2 podstawnikiem Z prowadzi do identycznego związku. Zatem oba atomy wodoru grupy metylenowej są równoważne. Równoważne atomy i grupy nie muszą oczywiście znajdować się na tym samym atomie węgla. Na przykład wszystkie atomy chloru heksachlorobenzenu są równoważne, podobnie jak dwa atomy bromu w 1,3-dibromopropanie.
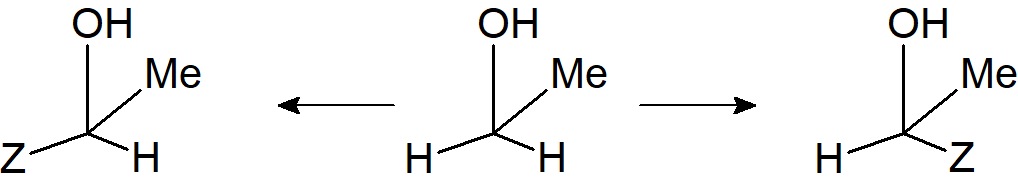
W przypadku etanolu CH2MeOH, jeśli jeden z wodorów grupy CH2 zastąpimy grupą Z, otrzymamy jeden enancjomer związku ZCHMeOH, podczas gdy zastąpienie drugiego wodoru daje drugi enancjomer. Ponieważ dwa związki powstające po zastąpieniu H przez Z nie są identyczne, ale enancjomeryczne, wodory w grupie CH2 nie są równoważne. W każdym symetrycznym środowisku oba atomy wodoru zachowują się tak samo, ale w środowisku niesymetrycznym mogą zachowywać się inaczej. Na przykład w reakcji z chiralnym odczynnikiem mogą być atakowane z różną szybkością. Ma to swoje najważniejsze konsekwencje w reakcjach enzymatycznych. Należy zauważyć, że atomy X lub grupy postaci CX2WY są zawsze enancjotopowe, jeśli ani W, ani Y nie są chiralne, chociaż atomy i grupy enancjotopowe można również znaleźć w innych cząsteczkach, na przykład atomach wodoru w 3-fluoro-3-chlorocyklopropenie. W tym przypadku podstawienie H przez grupę Z powoduje asymetrię atomu C-3, a podstawienie na C-1 daje enancjomer przeciwny do podstawienia na C-2.
Termin prochiralny jest używany dla związku lub grupy, która ma dwa enancjotopowe atomy lub grupy, na przykład CX2WY. Ten atom lub grupa X, której podstawienie prowadziłoby do związku o konformacji R, gdyby była preferowana w stosunku do drugiego, nazywana jest pro–(R). Drugi to pro–(S); przykładowo:
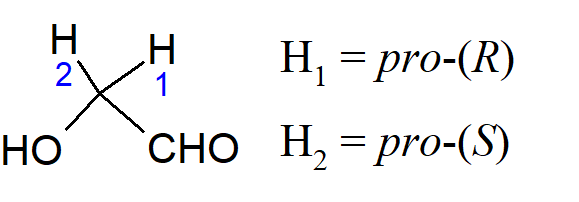
Gdy dwa atomy lub grupy w cząsteczce znajdują się w takich pozycjach, że zastąpienie każdego z nich grupą Z powoduje powstanie diastereomerów, atomy lub grupy nazywane są diastereotopami. Jako przykłady mogą służyć grupy CH2 2-chlorobutanu, chlorku winylu i chlorocyklopropanu oraz dwóch alkenylowych wodorów w 4-[chloro(fluoro)metyl]cyclopentenie.
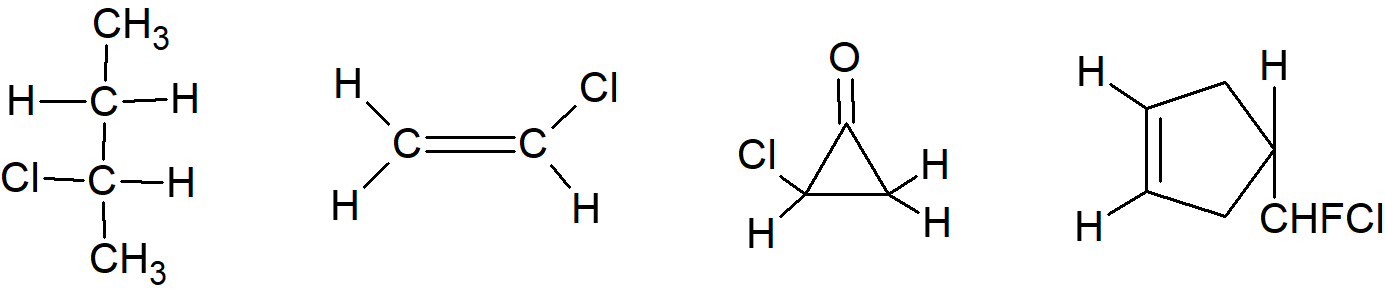 Diastereotopowe atomy i grupy zachowują się różnie w każdym środowisku, chiralnym lub achiralnym. Wodory w tych grupach reagują z różną szybkością z odczynnikami achiralnymi, ale istotną konsekwencją jest to, że w widmach NMR wodory diastereotopowe teoretycznie dają różne sygnały i ulegają wzajemnemu sprzężeniu. Kontrastuje to z równoważnymi lub enancjotopowymi wodorami, które są nie do odróżnienia na widmach NMR, z wyjątkiem przypadków, gdy stosuje się chiralne rozpuszczalniki, kiedy to enancjotopowe (ale nie równoważne) protony dają różne sygnały. W praktyce sygnały NMR z diastereotopowych protonów często okazują się nie do odróżnienia, ale dzieje się tak tylko dlatego, że są one położone bardzo blisko siebie. Należy zauważyć, że atomy X grupy CX2WY są diastereotopowe, jeśli albo W lub Y są chiralne.
Diastereotopowe atomy i grupy zachowują się różnie w każdym środowisku, chiralnym lub achiralnym. Wodory w tych grupach reagują z różną szybkością z odczynnikami achiralnymi, ale istotną konsekwencją jest to, że w widmach NMR wodory diastereotopowe teoretycznie dają różne sygnały i ulegają wzajemnemu sprzężeniu. Kontrastuje to z równoważnymi lub enancjotopowymi wodorami, które są nie do odróżnienia na widmach NMR, z wyjątkiem przypadków, gdy stosuje się chiralne rozpuszczalniki, kiedy to enancjotopowe (ale nie równoważne) protony dają różne sygnały. W praktyce sygnały NMR z diastereotopowych protonów często okazują się nie do odróżnienia, ale dzieje się tak tylko dlatego, że są one położone bardzo blisko siebie. Należy zauważyć, że atomy X grupy CX2WY są diastereotopowe, jeśli albo W lub Y są chiralne.
Z pojęciami enacjotopowych i diastereotopowych atomów czy grup wiąże się, użyty wcześniej, termin prochiralność, który jest używany w kilku znaczeniach. O prochiralności można mówić jako o właściwości geometrycznej achiralnego obiektu (lub przestrzennego rozmieszczenia atomów lub punktów), który może stać się chiralny w następstwie jednego kroku desymetryzacji, czyli przekształcenia obiektu, w którym następuje utrata jednego lub więcej elementów symetrii takich jak te, które wykluczają chiralność (płaszczyzna lustrzana, środek symetrii, osie przemienne). Achiralne indywiduum molekularne lub jego część rozważana odrębnie nazywana jest prochiralną, jeśli można ją uczynić chiralną przez wymianę występującego w niej atomu (lub achiralnej grupy) przez jakąkolwiek inną niż z nią związane. Achiralny obiekt, który może stać się chiralnym w dwóch krokach dyssymetryzacji jest czasami określany jako proprochiralny. Na przykład proprochiralny CH3-CO2H staje się prochiralny jako CH2D-CO2H i chiralny jako CHDT-CO2H.
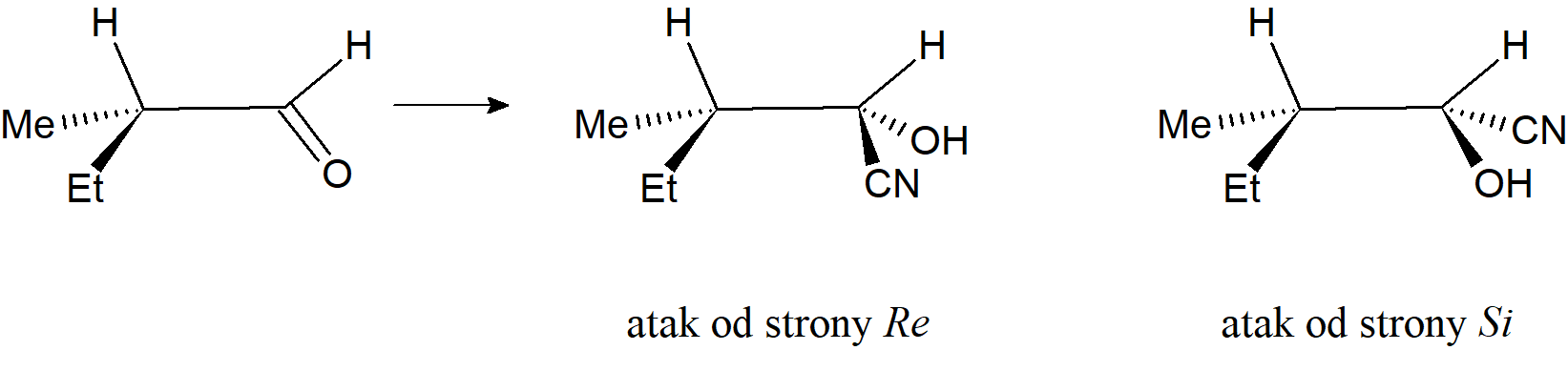
Termin prochiralność stosowany jest także do achiralnej molekuły lub indywiduum zawierającego układ trygonalny, który można uczynić chiralnym przez dodanie do trygonalnego układu innego atomu lub achiralnej grupy. Np. addycja atomów wodoru do jednej z enancjotopowych stron prochiralnego ketonu CH3CH2COCH3 daje jeden z enancjomerów chiralnego alkoholu CH3CH2CHOHCH3; addycja CN– do jednej z diastereotopowychstron grupy karbonylowej chiralnego aldehydu przemienia go w jeden z diastereoizomerów cyjanohydryny. Dwie strony układu trygonalnego mogą być określone jako Re i Si.
Termin prochiralny stosowany jest również do tetraedrycznego atomu achiralnej lub chiralnej molekuły, który jest związany z dwoma stereotopowymi grupami. Np. prochiralna molekuła CH3CH2OH może być przemieniona w chiralną molekułę CH3CHDOH przez wymianę izotopową jednego z dwóch enancjotopowych atomów wodoru grupy metylenowej. Atom węgla grupy metylenowej jest nazywany prochiralnym. Prochiralna molekuła HO2CCH2CHOHCH2CO2H może być przemieniona w chiralny produkt przez estryfikację jednej z dwóch enancjotopowych grup -CH2CO2H. Atom węgla grupy -CHOH jest nazywany prochiralnym. Chiralna molekuła CH3CHOHCH2CH3 może być przemieniona w jeden z diastereoizomerów molekuły CH3CHOHCHDCH3 przez wymianę izotopową jednego z dwóch diastereotopowychatomów wodoru grupy metylenowej. Atom węgla grupy metylenowej jest nazywany prochiralnym. Stereoheterotopowe grupy w tych wypadkach mogą być określone jako pro-R lub pro-S.