 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Berzelius, Hisinger, Faraday
Berzelius, Hisinger, Faraday
Podczas gdy Davy pracował w londyńskim Royal Institution, w 1803 r. pojawiła się notatka sygnowana przez J. J. Berzeliusa i W. Hisingera, w której opisano eksperymenty przeprowadzone w Sztokholmie, a dotyczące elektrolizy i przedstawiono następujące wnioski:
1. Związki chemiczne są rozkładane przez prąd elektryczny, a ich składniki gromadzą się na biegunach.
2. Ciała palne (wodór), zasady oraz ziemie i metale wędrują do bieguna ujemnego; tlen, kwasy i utlenione związki trafiają na biegun dodatni.
3. Stopień rozkładu jest proporcjonalny do powinowactwa i powierzchni biegunów. Jest on proporcjonalny do ilości energii elektrycznej i przewodności elektrycznej. (To stwierdzenie zostało znacznie zmodyfikowane w wyniku badań Faradaya.)
4. Zmiany chemiczne zachodzące podczas rozkładu zależą po pierwsze od powinowactwa składników do biegunów (metali), po drugie od powinowactwa składników względem siebie, a po trzecie od spójności utworzonych związków. (Ostatnie stwierdzenie odnosi się do prawa działania mas zaproponowanego przez Bertholleta i przyjętego przez Berzeliusa).
Michael Faraday urodził się w Newington Butts, Surrey, w 1791 roku. Pochodził z biednej rodziny i w wieku trzynastu lat zaczął pracować u introligatora. Wiele z naukowych książek jakie oddawano do oprawy zostały przez niego przeczytane, a jeden z klientów ofiarował mu bilet na wykłady H. Davy'ego w Royal Institution. M. Faraday przepisał notatki z wykładów i wysłał je Davy'ego z prośbą o zatrudnienie. H. Davy w 1813 r. zaangażował go jako asystenta w swoim laboratorium. Talenty Faradaya jako eksperymentatora wkrótce zapewniły mu awans, a dzięki wstawiennictwu Davy'ego został dyrektorem laboratorium w 1825 r., a w roku 1833 utworzono stanowisko profesorskie, które piastował do swojej śmierci w 1867 roku.
Większość prac Faradaya miało fundamentalne znaczenie dla fizyki, w tym szczególnie godne uwagi są jego odkrycia dotyczące indukcji elektromagnetycznej. Artykuły obejmujące te zagadnienia oraz dotyczące elektrolizy zostały zebrane w jego Experimental Researches in Electricity. Natomiast prace z zakresu chemii zostały przedstawione w Researches in Chemistry and Physics z roku 1859, i obejmują odkrycie „nadchlorku węgla” (C2Cl6) w 1821 roku, skraplania gazów (1823-45), benzenu z roku 1825 r., izomerycznych pochodnych sulfonowych naftalenu (1826) oraz wytwarzania złota koloidalnego (w tym opis „zjawiska Tyndalla”) opublikowany w 1857 r. Z punktu widzenia chemii najważniejszym osiągnięciem Faradaya było opracowanie zjawiska elektrolizy (1832–3). Faraday w 1832 r. wykazał, że masa substancji wydzielającej się na elektrodzie jest proporcjonalna do ładunku i czasu, czyli do ilości przepływającego prądu (Berzelius i Hisinger stwierdzili to samo ale nie podali zadowalających dowodów). W roku 1833 stwierdził, że masy substancji wydzielone z roztworów jednakową ilością ładunku są proporcjonalne do ich równoważników chemicznych. Nazwy elektroliza, elektrolit, anoda, katoda, anion i kation zostały opracowane dla Faradaya przez Williama Whewella. Teorię opisującą mechanizm przewodzenia prądu w roztworach zaproponował Th. von Grotthuss w 1805 roku.
Jöns Jacob Berzelius
Jöns Jacob Berzelius urodził się 20 sierpnia 1779 w Väversunda w Szwecji. Studiował na uniwersytecie w Uppsali, gdzie w roku 1802 został powołany na stanowisko asystenta profesora medycyny, farmacji i botaniki. W 1807 został profesorem na uniwersytecie sztokholmskim. W roku 1815 został profesorem chemii w nowym Chirugico-Medical Institute w Sztokholmie. W instytucie mógł jedynie wykładać, a swoje badania prowadził w niewielkim, skromnie wyposażonym laboratorium. W 1818 roku został stałym sekretarzem Akademii Sztokholmskiej, które to stanowisko pełnił do 1832 roku. W 1835 roku uzyskał tytuł barona nadany mu przez Karola XIV. Zmarł 7 sierpnia 1848 roku w Sztokholmie.
Jego badania eksperymentalne obejmowały wiele dziedzin. Dokonał wielu dokładnych oznaczeń mas atomowych, ulepszył metody analizy chemicznej i wykazał, że prawa proporcji stosuje się do substancji organicznych i minerałów. Odkrył cer w 1803 r., selen w 1817 r., tor w 1828 r.; badał związki wanadu i molibdenu, żelazocyjanki, tlenki azotu, halogenowe związku boru i krzemu, dwusiarczek węgla i wiele związków organicznych. Wprowadził do chemii pojęcia katalizy, izomerii i alotropii.
Badania Berzeliusa charakteryzowały wytrwałość, dokładność obserwacji i przejrzystość opisu, zdolność do systematyzacji oraz konserwatywne podejście, które spowodowało, że wytrwale trzymał się tego, co uważał za dobrze ugruntowane. Jego wiedza w zakresie wszystkich gałęzi chemii była dogłębna a ponadto był dobrym eksperymentatorem. F. Wohler piszał, że Berzelius zwykł komentować przeprowadzony na chybcika eksperyment: „Doktorze, das war geschwind aber schlecht!” (Doktorze, to było szybkie, ale złe). Być może największy wpływ na rozwój chemii wywarła ta część pracy Berzeliusa, która obejmowała jego teorię elektrochemiczną.
Podstawą elektrochemicznej teorii Berzeliusa był dualizm. Dla A. Lavoisiera tlen był centralnym elementem związku chemicznego: kwas był związkiem rodnika z tlenem. H. Davy rozszerzył to, pokazując, że zasada jest związkiem metalu z tlenem, a Berzelius uzupełnił dualistyczny system, zakładając, że we wszystkich przypadkach sól była związkiem kwasu (naprawdę bezwodnik kwasowy) z zasadą (naprawdę zasadowy tlenek):
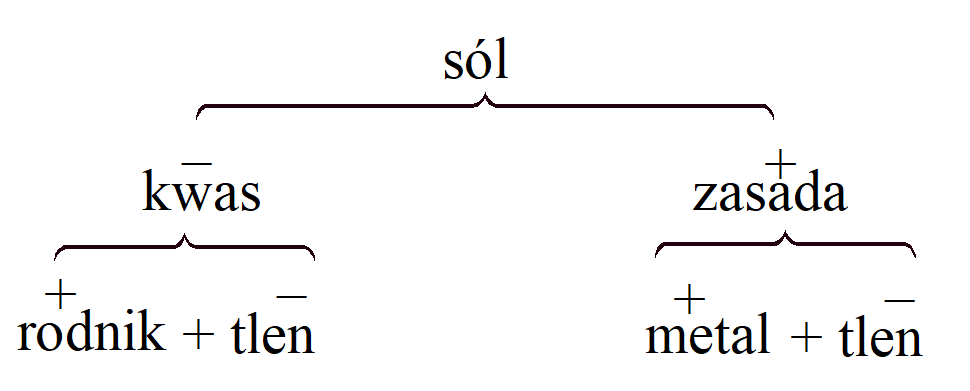
Berzelius zauważył, że podobny dualizm istnieje w przypadku elektryczności, a ponieważ jego praca z Hisingerem wykazała, że sole w roztworze są rozkładane przez prąd elektryczny na zasady, które docierają do bieguna ujemnego, a zatem wydają się przenosić ładunek dodatni i kwasy, które zdążają do bieguna dodatniego i wydają się przenosić ładunek ujemny, powyższa koncepcja została połączona z polaryzacją elektryczną. Zasady były elektrododatnimi tlenkami, kwasami elektroujemnymi tlenkami lub, jak wyraził to Berzelius, są nimi. odpowiednio substancje elektrododatnie i elektroujemne. Ta biegunowość została rozciągnięta na pierwiastki. Tlen był uważany za najbardziej elektroujemny pierwiastek, który w związku chemicznym był zawsze obdarzony ładunkiem ujemnym. Wszystkie pierwiastki można ułożyć w szereg z tlenem na jednym końcu i potasem (najbardziej elektrododatni pierwiastek) na drugim.
Teoria po raz pierwszy została opublikowana w Journal de Physique, którego głównym edytorem był J. C. de la Métherie, z października 1811 r . W System of Mineralogy Berzeliusa, przetłumaczonym na język angielski przez Johna Blacka w 1814 roku, stwierdzono, że teorię opublikowano w 1811 r. i nawiązano do symboli chemicznych używanych przez Berzeliusa, które, przedstawione w 1813 r., zastąpiły niewygodną, graficzną, symbolikę Daltona początkową literą lub literami tego, co Berzelius uważał za łacińskie nazwy pierwiastków. W teście autor zauważa, że podąża za Thomasem Thomsonem, który używał symboli A, S itp. w odniesieniu do tlenku glinu, krzemionki itp. przy podawaniu formuł minerałów. Berzelius oznaczał atomy tlenu i siarki kropkami i myślnikami nad symbolami innych pierwiastków; później wskazał dwa atomy („podwójna atonia”), przeciągając kreskę przez symbol atomu; przykładowo H2O = Ḧ (Berzelius liczbę atomów we wzorach związków zapisywał w indeksie górnym). Symbole praktycznie nie były używane w podręcznikach na początku wieku. Nie pojawiają się w podręcznikach Murraya ani w System Thomsona (wydanie 5, 1817). Znajdujemy je podane w załączniku do ostatniego wydaniu Williama Henry’ego Elements of Chemistry z roku 1829. E. Turnera Elements of Chemistry, wydanie 4 z roku 1833, zawiera wyjaśnienie symboli i używa ich wraz z równaniami chemicznymi, ale we wstępie autor zamieścił przeprosiny skierowane do czytelnika za ten lekkomyślny zabieg. Jednak już J. Liebig stosuje równania reakcji chemicznych, ale nie we wszystkich wypadkach. Natomiast symbole i równania są używane w podręczniku L Gmelina Handbuch der theoretischen Chemie wydanym po raz pierwszy w roku 1817.
W pierwszym wydaniu Theory of Chemical Proportions Berzeliusa, opublikowanej w języku szwedzkim w 1814 r., oraz w jego podręczniku teoria elektrochemiczna została szczegółowo wyjaśniona.
„Doświadczenie pokazuje, że ciepło jest wydzielane w każdej reakcji chemicznej, gdy jest ona prowadzona w warunkach pozwalających na dokładne obserwacje, i że dzięki wysyceniu silnych powinowactw temperatura często wzrasta do punktu żarzenia, podczas gdy wysycenie najsłabszych powinowactw skutkuje podniesieniem temperatury o kilka stopni.” Istnieją pewne szczególne przypadki: uwodnione tlenki chromu i cyrkonu po podgrzaniu nagle zaczynają się żarzyć, a one same stają się nierozpuszczalne w kwasach. Ciała mogą być również rozgrzewane za pomocą iskry elektrycznej lub prądu, i „powstaje pytanie, czy połączenie przeciwnych elektryczności nie jest przyczyną zapłonu związków chemicznych, jak również wyładowania elektrycznego”, szczególnie biorąc pod uwagę ścisłą relację między reakcjami chemicznymi i wyładowaniem elektrycznym ustalone przez Davy’ego. Wzrost temperatury zwiększa powinowactwo między miedzią a siarką; zwiększa także naelektryzowanie substancji, aż w pewnym momencie pojawia się żarzenie, zachodzi reakcja i znikają wszystkie ślady ładunków elektrycznych.
„W obecnym stanie naszej wiedzy najbardziej prawdopodobnym wyjaśnieniem spalania i zapłonu jest to, że w każdej reakcji chemicznej zachodzi neutralizacja przeciwnych ładunków, która wywołuje ogień w taki sam sposób, jak jest to wytwarzane w procesie rozładowania butli lejdejskiej, stosu elektrycznego i w przypadku pioruna, ale w tych ostatnich zjawiskach nie towarzyszy im reakcja chemiczna”.
Hipoteza ta jest formułowana ostrożnie, gdyż być może później zostanie zastąpiona inną, lepszą. Niektóre reakcje, pisze Berzelius, trudno wyjaśnić na gruncie tej teorii. Nadtlenek wodoru reaguje z tlenkiem srebra, oba związki ulegają rozkładowi z wydzieleniem dużej ilości ciepła, chociaż jak się wydaje nie następuje tu żadne połączenie atomów. Już w 1850 roku B. C. Brodie wykazał, że w procesie tym zachodzi chemiczne połączenie dwóch atomów tlenu, po jednym z każdej substancji, z wytworzeniem cząsteczki gazowego tlenu, co zgadzało się z teorią Berzeliusa:
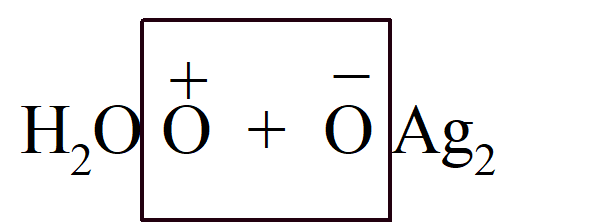
Według Berzeliusa elektroliza jest dokładnie odwrotnością syntezy chemicznej: utracone ładunki elektryczne są ponownie gromadzone w dwóch częściach związku, które pojawiają się w stanie swobodnym. Jego teoria różni się od teorii Davy'ego tym, że Davy założył, że substancje nabywają ładunki elektryczne tylko w kontakcie i że ładunki elektryczne uzyskane w ten sposób przez reagujące cząstki są przyczyną reakcji chemicznej, podczas gdy Berzelius założył, że cząstki zawsze mają ładunki elektryczne, które nadal istnieją w związku chemicznym. Trudność na jaką wskazuje Berzelius, to mianowicie fakt. że gdy dwa naładowane ciała wymieniają swoje ładunki, są one neutralizowane, i zanika przyciąganie pomiędzy ciałami, ale w związkach chemicznych ich składniki są mocno ze sobą połączone. To pokazuje, że atomy w związku chemicznym są nadal spolaryzowane. Innymi słowy związek chemiczny jest utrzymywany za sprawą polaryzacji, a nie przez pewną nadmierną siłę powinowactwa. Różne właściwości elektrochemiczne pierwiastków wynikają z przewagi dodatniego lub ujemnego ładunku elektrycznego w tym samym atomie, który zawiera oba ładunki (z wyjątkiem tlenu, który jest tylko ujemny); atom jest dipolem elektrycznym. Odkrycie Faradaya, że równoważniki chemiczne mają równe ładunki, stanowiło trudność dla teorii Berzeliusa, który utrzymywał, że wyniki Faradaya były niedokładne. W rzeczywistości Berzelius myślał raczej o potencjale niż o ilości energii elektrycznej i nie odróżniał jednego pojęcia od drugiego, był to powszechny błąd w jego czasach.
Pierwiastki można podzielić na dwie grupy, elektrododatnie i elektroujemne, zgodnie z ładunkami jakie przyjmują w związkach chemicznych, a ich układ według przyjmowanych ładunków jest szeregiem elektrochemicznym. Szereg skonstruowany przez Berzeliusa:
O, S, N, F, Cl, Br, I, Se, P, As, Cr, Mo, W, B, C, Sb, Te, Ta, Ti, Si, H; Au, Os, Ir, Pt, Rh, Pd, Hg, Ag, Cu, U, Bi, Sn, Pb, Cd, Co, Ni, Fe, Zn, Mn, Ce, Th, Zr, Al, Y, Be, Mg, Ca, Sr, Ba, Li, Na, K.
nie różni się zbytnio od obecnych tabel potencjałów elektrodowych.
W tym szeregu, który, jak pisze Berzelius, mogą wystąpić modyfikacje na podstawie dalszych eksperymentów, najbardziej elektroujemne pierwiastki znajdują się na początku, a najbardziej elektrododatnie na końcu. Wodór rozdziela dwie klasy pierwiastków. Kolejność pierwiastków w szeregu może się różnić w zależności od temperatury. Moc kwasu lub zasady jest tym większa, im bardziej wyraźny jest elektrochemiczny charakter rodnika. Słaba zasada może działać jak kwas w stosunku do silnej zasady (np. tlenek glinu i soda kaustyczna), a słaby kwas może wystąpić jako zasada w stosunku do silnego kwasu (np. kwas borowy i kwas siarkowy(VI)). Sole mogą być słabo dodatnie lub ujemne jako całość, a zatem łączyć się tworząc sole podwójne (np. ałun). Ten typ reakcji jest odmienny od podwójnego rozkładu ze względu na przyciąganie między ładunkami elektrycznymi oddzielnych atomów.
Teoria cząsteczkowa Berzeliusa
W ścisłym związku z jego teorią elektrochemiczną był jego system mas atomowych. Badanie mało znanej pracy Richtera na temat równoważników doprowadziło go do wniosku, że staranne analizy wybranej grupy związków powinny doprowadzić do określenia składu wielu innych połączeń chemicznych. Wyniki tych analiz potwierdziły również prawo stosunków wielokrotnych Daltona. Te dwa empiryczne prawa otrzymują satysfakcjonujące wyjaśnienie w teorii atomów Daltona. Było to w dużej mierze wynikiem obszernej i starannej pracy Berzeliusa (opublikowanej w latach 1811–12) nad składem soli itp., która została w wyniku tego ugruntowana, choć niektórzy z wielkich chemików tamtych czasów, np. Davy, nie zaakceptowali tej teorii.
Adaptując teorię do swoich celów Berzelius zastosował się do terminologii Daltona rozpatrywania atomów złożonych i uporządkował je w kolejności złożoności. Te pierwszego rzędu składają się z atomów elementarnych, ponieważ potas = potas + tlen; kwas siarkowy = siarka + tlen. Atomy złożone drugiego rzędu składają się z atomów pierwszego rzędu: siarczan potasu = potaż + kwas siarkowy. Atomy złożone trzeciego rzędu składają się z atomów drugiego rzędu, jako suchy ałun = siarczan glinu + siarczan potasu. Atomy złożone czwartego rzędu zawierają atomy trzeciego rzędu, jako ałun krystaliczny = suchy ałun + woda. Powinowactwo między składnikami atomów złożonych gwałtownie maleje wraz ze wzrostem ich rzędu: „stopnie powinowactwa, które wciąż istnieją w atomach trzeciego rzędu, są na ogół zbyt słabe, aby można je było dostrzec w pośpiesznych i niedokładnych eksperymentach laboratoryjnych … i zwykle manifestują się tylko w związkach powstających, gdy powoli i spokojnie przechodzą w stan stały, tj. w minerałach.”
Prawa rządzące tworzeniem cząsteczek związków Berzelius starał się pokazać empirycznie, zgodnie z zasadami Daltona. Nazwał to teorią ciałek. W 1818 pisze, że jeśli ilości tlenu wchłoniętego przez rodnik są w stosunku 1 do 1, tlenki można zapisać jako R + O i 2R + 3O, ale, jak niektórzy chemicy uważają, że siarka i żelazo posiadają nieznane niższe tlenki, to znane tlenki są tworzone jako R + 2O i R + 3O, co powoduje, że tlenki żelaza mają wzory FeO2 i FeO3. W 1826 r. zmienił wzory tych tlenków na FeO i Fe2O3. Berzelius sprzeciwiał się umieszczeniu cyfr w indeksach dolnych, co doprowadziło do kłótni się z Liebigiem, gdy ten ostatni wydrukował jeden z artykułów Berzeliusa w Annalen z indeksami dolnymi we wzorach związków. W 1826 r. Berzelius opracował serię możliwych kombinacji pierwiastków w taki sposób:
- A + B, 2B, 3B, ... granica prawdopodobnie wynosi 12B, ponieważ 12 jest największą liczbą kulek o takich samych wymiarach jakie mogą otaczać jedną z nich pozostając w kontakcie.
- 2A + 3B, 5B lub 7B. Znanych jest tylko kilka takich związków. Powstaje pytanie, czy 2A + 2B jest takie samo, jak A + B. W niektórych przypadkach można to ustalić na drodze eksperymentu.
- Proporcje, w których łączą się atomy złożone, to:
- A + B, 2B, 3B,. . . Jest to najczęstszy typ.
- 3A + 2B lub bardzo rzadko 3A + 4B.
- 5A + 2B, 3B, 4B, 4½B, 6B.
Izomorfizm
Jako użyteczne kryterium ustalania wzorów związków Berzelius odnosi się do prawa izomorfizmu E. Mitscherlicha: „ta sama liczba atomów, połączonych w ten sam sposób, wytwarza tę samą postać krystaliczną; postać krystaliczna jest niezależna od chemicznej natury atomów i zależy wyłącznie od ich liczby i sposobu łączenia.”
Eilhard Mitscherlich urodził się w 1794 roku w Oldenburgu i zmarł w Berlinie w 1863 roku. Był następcą M. Klaprotha na Uniwersytecie w Berlinie. Mitscherlich studiował początkowo języki orientalne, potem medycynę, a na końcu na chemię u Berzeliusa w Sztokholmie w roku 1819. Jego pierwszy artykuł na temat izomorfizmu (isoV, równy; morfe, kształt) został odczytany na zebraniu towarzystwa naukowego w roku 1819. W 1812 r. W. H. Wollaston odkrył niewielkie, ale wymierne różnice między kątami ścian kryształów kalcytu, dolomitu i pewnej rudy żelaza, które są izomorficzne, a przybliżony charakter jego prawa został później dopracowany przez Mitscherlicha, który. przeprowadził także (1833-5) ważne badania benzenu, uzyskując niektóre jego pochodne.
Pierwszymi przypadkami izomorfizmu badanymi przez Mitscherlicha były pary uwodnionych soli: Na2HPO4·12H2O i Na2HAsO4·2H2O; NaH2PO4·H2O i NaH2AsO4·H2O. „Każdy arsenian ma odpowiadający mu fosforan, skomponowany według tych samych proporcji, połączony z taką samą ilością wody i obdarzony tymi samymi właściwościami fizycznymi; w rzeczywistości dwie serie soli nie różnią się pod żadnym względem, z tym wyjątkiem, że rodnikiem kwasu w jednej serii jest fosfor, podczas gdy w drugiej jest to arsen.”
Izomeria
Berzelius w swoich tekstach odnosi się do związków izomerycznych, które definiuje jako związki mające ten sam skład chemiczny „i tę samą pojemność nasycenia”, ale o różnych właściwościach. Jako przykłady przytacza kwasy fosforowy, kwas piorunowy i kwas cyjanowy, dwa rodzaje kwasu cynowego i dwa kwasy winowe. Przypadek kwasu piorunowego i cyjanowego doprowadził do uznania zjawiska izomerii przez Berzeliusa. W 1823 roku F. Wohler przeanalizował kwas cyjanowy, a w roku 1824 J. Liebig przeanalizował kwas piorunowy, zarówno ich sole, jak i wyniki analiz były identyczne. Początkowo Berzelius przypuszczał, że popełniono jakiś błąd, ale późniejsze badania wykazały, że związki o tym samym składzie mogą mieć różne właściwości. W 1827 roku uznał istnienie tego zjawiska i nazwał go izomerią: „wydawałoby się, że prosty atomy, z których składają się substancje, mogą być ze sobą łączone na różne sposoby.” To wyraźnie początek teorii budowy związków chemicznych, a teoria atomowa okazała się niezbędna do wyjaśnienia nowych faktów. W 1833 r. Berzelius rozróżniał dwa przypadki izomerii: metameryzm, gdy oba związki zawierają tę samą liczbę atomów (kwasy piorunowy i cyjanowy), i polimeryzm, gdy względne liczby atomów są takie same, ale liczby bezwzględne są różne. Jako przykład tego ostatniego typu przedstawił w 1827 r. dwa różne gazy, etylen i gaz po raz pierwszy znaleziony przez Daltona w nafcie, a dokładniej zbadany przez Faradaya w 1825 r., który miał taki sam skład jak etyle, ale dwa razy większą gęstość (butylen). Faraday pisze: „Po raz pierwszy miały istnieć dwa związki gazowe, różniące się jedynie gęstością”. Berzelius zauważa, że w tych gazach „pojemność nasycenia” jest inna, z czego można wywnioskować, że przez ten termin rozumiał liczbę atomów w cząsteczce. W 1827 r. stwierdza, że gaz Faradaya zawiera dwa razy więcej atomów niż zawartych jest w etylenie, z czego jasno wynika, że w tym czasie uważał gęstość za kryterium względnych wag cząstek złożonych.
Stosunki objętościowe i masy atomowe
W swojej dyskusji na temat stosunków objętościowych, opartej na doświadczeniach Gay-Lussaca, J Berzelius stwierdza: „Doświadczenie pokazuje, że tak jak pierwiastki łączą się w konkretnych proporcjach wagowych, łączą się również w konkretnych proporcjach objętościowych, tak że jedna objętość pierwiastka łączy się z równą objętością lub 2, 3,4 lub więcej objętości innego pierwiastka w stanie gazowym. … Wielokrotności są absolutnie takie same w obu teoriach, a to, co nazywa się atomem (Daltona) w jednym, nazywa się objętością w drugim”. Oczywiste jest, że teoria jest ograniczona do pierwiastków, a Berzelius najwyraźniej miał na myśli krytyczne uwagi Daltona wobec hipotezy, że równe objętości gazów zawierają równą liczbę cząstek, co wydaje się wynikać z doświadczeń Gay-Lussaca. Jeżeli 1 objętość azotu zawiera n atomów, 1 objętość tlenu zawiera n atomów, a ponieważ łączą się one, dając 2 objętości tlenku azotu, to 1 objętość tlenku azotu może zawierać tylko ½ n cząsteczek. Trudność ta została wyjaśniona już w 1811 r. przez Avogadro, ale jego praca pozostała niezauważona. Berzelius odwołuje się do rozumowania Avogadro tylko w późniejszym wydaniu swojego traktatu, nie przywołując jego nazwiska. Za pomocą swojej teorii stosunków objętości Berzelius wywnioskował, że na przykład woda, kwas chlorowodorowy i amoniak to H2O, HC1 i NH3, ponieważ kombinacje między gazami elementarnymi występują w proporcjach 2: 1, 1:1 i 1:3. Należy zauważyć, że nie korzysta on z rozumowania Avogadro, a w szczególności nie zakłada, że wolne cząsteczki wodoru, tlenu, chloru i azotu to H2, O2, Cl2 i N2.
Berzelius zauważył, że „chociaż nasze wyniki dotyczące składu atomowego większości substancji są prawdopodobne, wyniki te są w większości przypadków tak niepewne, że istnieje, ale ograniczona, liczba związków, o których można z całą pewnością powiedzieć, ile proste atomy tworzą atom złożony.” Jedną z metod, która prowadzi do pewnych wyników, jest prawo objętości, a jego zakres zastosowania jest ograniczony do gazów. Gdy pierwiastek ma kilka stopni utlenienia, i stosunki tlenu dla danej masy drugiego pierwiastka wynoszą 1 i 2, związkami mogą być RO i RO2; jeśli stosunek wynosi 2 do 3, pierwszy związek może być RO, a drugi R2O3, lub mogą to być związki RO2 i RO3. Jeśli stosunek wynosi 3 do 4, mogą istnieć związki RO3 i RO4 lub R2O3 i RO2. Ale jeśli stosunek wynosi 3 do 5, możliwe są tylko R2O3 i R2O6 lub RO3 i RO5. Gdy elektrododatni tlenek łączy się z elektroujemnym tlenkiem, np. zasada z kwasem, zawartość tlenu tego ostatniego jest całkowitą wielokrotnością zawartości tlenu tego pierwszego, a liczba ta jest liczbą atomów tlenu w elektroujemnym tlenku. W ten sposób Berzelius w 1826 roku znalazł dwie typowe serie związków tlenu:
1. Seria azotowa: N2O, NO, N2O3, N2O5.
2. Seria siarkowa: SO, SO2, SO3.
Powyższa reguła podaje wzór CrO3 dla bezwodnika kwasu chromowego(VI), ponieważ w chromianach(VI) stosunek tlenu w kwasowym tlenku do tlenu w zasadowym wynosi 3: 1. Stosunek tlenu w bezwodniku chromowym do tlenu w tlenku chromowym wynosi 2 do 1, stąd tlenek to Cr2O3. Ponieważ są one izomorficzne z tlenkami żelaza i glinu, zatem ich wzory to Fe2O3 i A12O3. Ze stosunku tlenu tlenkach żelaza na +2 i +3 stopniu utlenienia wzór pierwszego musi wynosić FeO. Podobna sytuacja występuje z tlenkami miedzi, kobaltu, wapnia, ołowiu itp., które mają wzór RO. Analogie te zostały umiejętnie wykorzystane przez Berzeliusa i, jak łatwo zauważyć wszystkie powyższe formuły są obecnie w użyciu.
Ponieważ uważał, że wszystkie mocne zasady mają wzór RO, Berzelius napisał wzory potażu, sody i tlenku srebra jako KO, NaO i AgO. Wcześniej w swoich tabelach z 1814 i 1818 r. zapisał je jako KO2, NaO2 i AgO2. Po ogłoszeniu w 1819 r. prawa Dulonga i Petita o cieple atomowym dla pierwiastków w stanie stałym: „atomy wszystkich prostych ciał mają dokładnie taką samą pojemność cieplną” lub ciężar atomowy x ciepło właściwe = ciepło atomowe = stała, Berzelius zmniejszył o połowę liczby mas atomowych w celu dostosowania ich do prawa, ale nadal zapisywał tlenki potasu, sodu i srebra jako KO, NaO i AgO, chociaż takie wzory dawały masy atomowe dwa razy większe niż te wywodzące się z określonego ciepła molowego. Przed 1830 r. Berzelius sporządził tabelę mas atomowych identyczną praktycznie pod każdym względem (poza niewielkimi niedokładnościami w ustaleniach eksperymentalnych) z obecnie używaną. Do 1840 r. te masy atomowe zostały prawie całkowicie porzucone przez innych chemików, a zamiast tego zastosowano „równoważniki”.
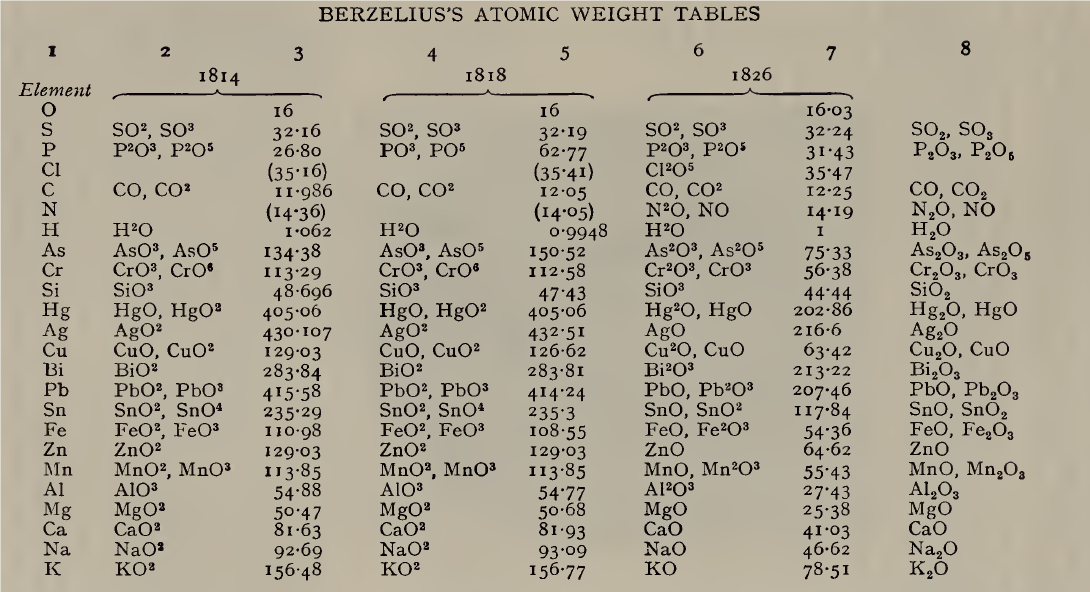 Kolumny 2, 4 i 6 podają wzory tlenków przyjęte przez Berzeliusa, kolumna 8 współczesne wzory tlenków; kolumny 3 i 5 zawierają masy atomowe przeliczone z wartości podanych przez Berzeliusa, który masę tlenu przyjął za równą 100, na masę tlenu równą 16; kolumna 7 podaje wartości Berzeliusa w jego alternatywnej skali gdzie masa wodoru równa jest 1.
Kolumny 2, 4 i 6 podają wzory tlenków przyjęte przez Berzeliusa, kolumna 8 współczesne wzory tlenków; kolumny 3 i 5 zawierają masy atomowe przeliczone z wartości podanych przez Berzeliusa, który masę tlenu przyjął za równą 100, na masę tlenu równą 16; kolumna 7 podaje wartości Berzeliusa w jego alternatywnej skali gdzie masa wodoru równa jest 1.
Pomimo ogólnej poprawności tabeli mas atomowych Berzeliusa chemicy uważali, że nie ma ogólnej metody, oprócz analogii i kombinacji wyników z różnych dziedzin badań, za pomocą których można wyznaczyć ciężar atomowy pierwiastka w sposób jednoznaczny. W 1826 r. Jean-Baptiste Dumas założył, że „gazy w podobnych okolicznościach składają się z cząsteczek lub atomów umieszczonych w tej samej odległości, co oznacza, że zawierają one tę samą liczbę w tej samej objętości”. W 1832 r. stwierdził natomiast, że gęstość pary siarki, fosforu, arsenu i rtęci dawała anomalne wyniki (nie wiedział, że cząsteczki par tych pierwiastków nie były jednakowe, S6, P4, As4, Hg), a następnie stwierdził, że „gazy, nawet jeśli są proste, nie zawierają w równych objętościach tej samej liczby atomów.” Praca Dumasa wstrząsnęła zaufaniem chemików do prawa objętości, które wydawało się najbardziej obiecującą metodą, a hipoteza Avogadro została całkowicie zaniedbana. Pomiędzy 1830 a 1840 rokiem wydawało się, że teoria atomowa zaczyna kończyć swoją przydatność, a wielu chemików, którzy nie dbali zbytnio o dyskusje teoretyczne, używało czegoś, co nazywano „równoważnikami” możliwymi do ustalenia w eksperymentach w odróżnieniu od ciężarów atomowych. Ta postawa została wzmocniona przez przyjęcie mas równoważnikowych przez Leopolda Gmelina w jego Handbook of Chemistry (tłumaczenie angielskie, 19 tomów, 1848-72): H = 1, O = 8, C = 6, S = 16 itd. ., wzory wody, potażu, kwasu azotowego itp., zapisane jako HO, KO, NO5. Trudność polegała jednak na tym, że kilka pierwiastków, np. żelazo, miało więcej niż jeden równoważnik, w związku z czym wybierano po prostu najmniejszą wartość.