 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Rozwój chemii nieorganicznej
Rozwój chemii nieorganicznej
Prawo okresowości
Rozwój chemii ogólnej w XX wieku wywodzi się z prawa okresowości, które ukazało zależności między pierwiastkami chemicznymi. Pierwsza wskazówka jaką była hipoteza Prouta, w międzyczasie została skompromitowana ponieważ dokładne ustalenia mas atomowych dokonane przez E. Turnera, F. Penneya, J-B. Dumasa J. Marignaca, a zwłaszcza przez J. Stasa z 1860 roku, wskazały, że tak naprawdę nie były to liczby całkowite, a niektóre z nich znacznie odbiegały od liczb całkowitych, np. Cl = 35,46. Dlatego Lothar Meyer powiedział w 1891 r.: „Hipoteza Prouta kusi swoją prostotą i przez pewien czas była pozytywnie przyjęta przez chemików, z wyjątkiem tych, którzy dokonali dokładnych badań masy atomowej”. W swoich badaniach Stas doszedł do wniosku, że „to tylko złudzenie, czysta hipoteza zdecydowanie sprzeczna z eksperymentem”, chociaż wyszedł od „prawie całkowitej pewności co do dokładności prawa Prouta”.
Badania Stasa miały na celu ustalenie proporcji pierwiastków poprzez analizę i syntezę związków, które można uzyskać w bardzo czystym stanie. Chociaż nominalnie przyjął tlen jako wzorzec, z masą atomową równą 16,000, wyznaczone przez niego wartości są w większości oparte na masie atomowej srebra i nie można ich bezpośrednio odnieść do tlenu. Rewizja wartości wyznaczonych przez Stasa przez amerykańskiego chemika Theodora Williama Richardsa (1868–1928) ujawniła małe, ale znaczące błędy. Ponadto metody fizykochemiczne stosowane przez P. Guye'a i innych, wykorzystujące graniczne gęstości gazów (tj. gęstości względne ekstrapolowane do zera absolutnego, kiedy hipoteza Avogadro ma ścisłe zastosowanie), pokazała również, że niektóre wartości Stasa były mniej dokładne niż przypuszczano. Odchylenia od hipotezy Prouta pozostały w mocy.
W 1817 i 1829 r. Johann Wolfgang Döbereiner (1780–1849), profesor w Jenie i nauczyciel chemii Goethego zauważył, że w niektórych grupach trzech pierwiastków, np. Ca, Sr, Ba, ciężar atomowy środkowego elementu był w przybliżeniu średnią z sumy mas pierwszego i trzeciego. Odkrycie to stało się znane jako triady Döbereinera. Chemicy, zwłaszcza Dumas, podjęli wiele prób odkrycia prawidłowości wiążących masy atomowe, ale bez powodzenia. W 1865 r. W. Odling ułożył pierwiastki w formie tabeli, która jest podobna do pierwszej tabeli Mendelejewa z 1869 r.
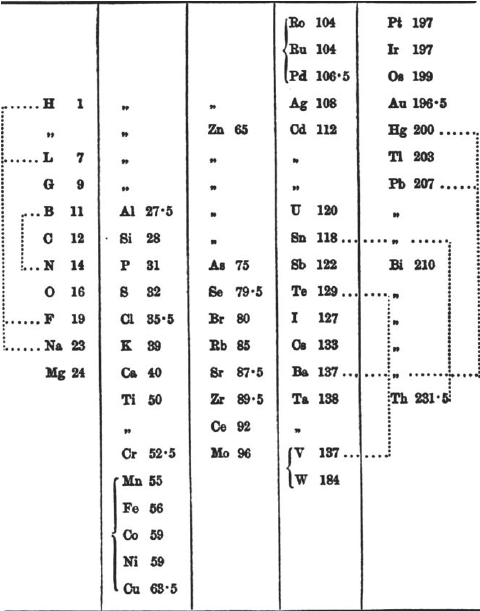 Tabela Williama Odlinga z 1864 roku.
Tabela Williama Odlinga z 1864 roku.
John Newlands sporządził tabelę pierwiastków ułożonych w taki sposób, że „ósmy pierwiastek, poczynając od danego, jest rodzajem powtórzenia pierwszego, jak ósma nuta w oktawie muzyki.” Nazwał tę zależność prawem oktaw. Kiedy Newlands przeczytał swój komunikat na spotkaniu London Chemical Society i przedstawił swoją tabelę, Carey Foster zapytał go, czy kiedykolwiek próbował klasyfikować pierwiastki w kolejności pierwszych liter ich nazw. W 1887 r. Newlands otrzymał Davy Medal of Royal Society.
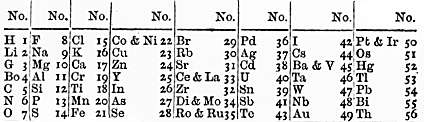 Tabela pierwiastków Nelandsa z 1865 roku
Tabela pierwiastków Nelandsa z 1865 roku
Newlands ułożył pierwiastki w kolejności ich mas atomowych numerując je kolejno poczynając od wodoru jako 1. Podkreślił również, że taka kolejność pierwiastków, a tym samym powtarzalność ich właściwości, jest możliwa do uzyskania tylko przy zastosowaniu nowych mas atomowych zaproponowanych przez S. Cannizzaro.
Prawo okresowości zostało zaproponowane prawie jednocześnie i całkowicie niezależnie przez Juliusa Lothara Meyera (1830–1895) w Niemczech i Dmitra Iwanowicza Mendelejewa w Rosji. Mendelejew urodził się w 1834 r. w Tobolsku na Syberii. Rodziną opiekowała się matka, która kierowała fabryką szkła. W 1848 r. wraz z synem przejechała tysiące mil do Moskwy, z pomysłem wprowadzenia go na uniwersytet, ale jako Sybirak nie miał możliwości rozpocząć tam studiów. Obydwoje udali się do St. Petersburga, gdzie w 1850 roku Mendelejew został przyjęty do kolegium nauczycielskiego. Jego matka zmarła w tym samym roku. W 1887 r. Mendelejew, dedykując swoją książkę o roztworach swojej matce, napisał: „Kształciła mnie przykładem, korygowała miłością i aby poświęcić syna nauce, opuściła Syberię wraz z nim, wydając ostatnie siły i środki.” W 1859 r. udał się do Heidelbergu gdzie spędził dwa lata pracując nad własnymi pomysłami, a w 1867 r., po odbyciu szeregu innych pobytów w ośrodkach naukowych Europy, został profesorem na uniwersytecie w Petersburgu, pozostając tam do 1890 r., kiedy z powodu sporu z władzami na tle jego liberalnych poglądów, opuścił uniwersytet. Zmarł w 1907 r.
Mendelejew opublikował, w Rosji, swój artykuł o prawie okresowości w kwietniu 1869 roku. Artykuł Lothara Meyera z grudnia 1869 r. został opublikowany w języku niemieckim w 1870 r., przy czym niedoskonały układ okresowy przedstawił w 1868 r., ale go nie opublikował. Chemicy po raz pierwszy zainteresowali się prawem okresowości, gdy przewidywania Mendelejewa dotyczące brakujących pierwiastków zostały potwierdzone przez odkrycia galu w 1875 r. i skandu w 1879 r. Jako istotny element podręczników prawo okresowości pojawiło się około 1895 roku, chociaż książka Mendelejewa, „Zasady chemii”, zawierająca opis prawa okresowości, ukazała się w języku rosyjskim w 1869 roku i została przetłumaczona na angielski. Prawo okresowości Mendelejew zawarł w sformułowaniu, „właściwości pierwiastków zależą w sposób periodyczny od ich mas atomowych”. Lothar Meyer w 1870 r. opublikował krzywą objętości atomów, na której wyraźnie wykazał okresową zależność właściwości ilościowej w funkcji masy atomowej; gdy masa atomowa stale rośnie, właściwość naprzemiennie rośnie i opada w określonych okresach pierwiastków. Mendelejew nadał temu ilościowemu wynikowi wymiar ogólny.
Prawo okresowości wyjaśniło szereg nieprzewidzianych wcześniej analogii między pierwiastkami i pobudziło badania chemii nieorganicznej, która została w pewnym stopniu zaniedbana w drugiej połowie XIX wieku ze względu na wielkie odkrycia w zakresie chemii organicznej. Istotne odkrycia w dziedzinie chemii nieorganicznej zostały przeprowadzone przez H. Roscoe w Manchesterze, B. Braunera w Pradze i H. Moissana w Paryżu. Ten ostatni zdołał wydzielić fluor, a także przeprowadził badania w wysokotemperaturowe przy użyciu pieca elektrycznego, dzięki czemu dokonał syntezy węglików metali. Węglik wapnia został uzyskany przez F. Wöhlera w 1862 r. w wyniku ogrzewania stopu cynku i wapnia węglem. Badania nad węglikami zostały opisane w książce Moissiana Le four électrique (Paryż, 1897), a ponadto w kilku tomach Traité de Chimie minérale.
Badania w zakresie chemii nieorganicznej zostały również rozszerzone o prace W. Crookesa odnośnie talu i pierwiastków ziem rzadkich oraz W. Ramsaya, poczynając od współpracy z Lordem Rayleighem przy odkryciu argonu w 1894 r. Chociaż skład atmosfery była analizowana przez wielu chemików, wcześniej nie podejrzewano, że zawiera ponad jeden procent pierwiastka obojętnego, a niektórzy chemicy początkowo byli skłonni sądzić, że argon jest tylko polimerem azotu, być może o wzorze N3. Odkrycie przez Ramsaya i M. Traversa innych gazów szlachetnych zmusiło badaczy do przyznania, że w atmosferze znajduje się kilka nowych pierwiastków.
Podsumowanie
Sir Henry Enfield Roscoe, urodzony w Londynie w 1833 r., studiował u T. Grahama i A. W. Williamsona, a od 1853 do 1857 r. u R. Bunsena w Heidelbergu, gdzie prowadził badania nad działaniem światła na mieszaniny wodoru i chloru tworząc podstawy fotochemii ilościowej. W latach 1857–1885 był profesorem w Manchesterze, gdzie był związany ze C. Schorlemmerem. W 1865 r. Roscoe wykazał, że wanad jest pierwiastkiem należącym do azotowców, a nie do grupy zawierającej siarkę, a jego najwyższym tlenkiem jest V2O5, a nie VO3, jak przypuszczał J. J. Berzelius. Miało to znaczenie później przy opracowaniu prawa okresowości Mendelejewa. Badania prowadzone przez Roscoe od 1863 roku przyczyniły się do opracowania metod analizy spektroskopowej. Zmarł w 1915 r. Roscoe’a zastąpił w Manchesterze Harold Baily Dixon (1852–1930). który przeprowadził badania płomienia, spalania i eksplozjami gazów. Dixon odkrył (1880 r.), że sucha mieszanina tlenku węgla i tlenu nie wybucha przy inicjacji iskrą elektryczną. Jego badania nad wpływem wody na przemiany chemiczne kontynuował Herbert Brereton Baker (1862–1935), profesor w Imperial College w South Kensington, który również badał tlenek azotu(III) (1907 r.) oraz wyznaczył masę atomową telluru (1907 r.).
Jean Servais Stas (1813–1891), profesor w Brukseli, początkowo pracował z Dumasem w dziedzinie chemii organicznej oraz nad ustaleniem mas atomowych węgla, wodoru i tlenu (1840 r.). Opracował bardzo dokładne metody oznaczania mas atomowych (1860–65) i przez wiele lat wartości wyznaczone przez niego były zdecydowanie najdokładniejsze.
Jean Charles Galissard de Marignac (1817–1894), profesor w Genewie, badał pierwiastki ziem rzadkich (od 1840 r.), odkrywając itr (1878 r.) i gadolin (1880 r.); badania nad izomorfizmem soli niobu, cyny i wolframu oraz fluorocynianów i fluokrzemianów (1858 i nast.) oraz fluorocyrkonianów (1860) pozwoliły mu na skorygowanie wartości mas atomowych. Odkrył kwas krzemowolframowy (1862 r.), pracował nad termochemią roztworów (1870 r.). W 1865 r. zasugerował, że odchylenia od hipotezy Prouta mogą wynikać z faktu iż pierwiastki składają się z mieszanin atomów o różnych masach (obecnie nazywanych izotopami).
Sir William Crookes (1832–1919), urodzony w Londynie, był przez pewien czas asystentem A. W. Hofmanna. Studiując widma pierwiastków ziem rzadkich odkrył tal (1861 r.); badał promienie katodowe wysuwając teorię, że składają się one z cząstek identycznych z protylem czyli podstawową materią pierwiastków (1886 r.). Crookes wykonał wiele prac o znaczeniu technicznym i był ekspertem analitykiem. Królewski Order Zasługi otrzymał w 1910 r., a w latach 1913–16 był Prezesem Towarzystwa Królewskiego.
Sir Thomas Edward Thorpe (1845–1925), profesor w Andersonian College, Glasgow (1870 r.), Leeds (1874 r.) i South Kensington (1885 r.), odkrył pentafluorek fosforu (1877 r.), fluorek fosforylu (z T. Hambly, 1889 r.) i fluorek tiofosforylu (z R. Rodger, 1888 r.); określił gęstość par kwasu fluorowodorowego (z Hambly, 1889); uzyskał P2O4 (1886 r.) i P4O6 (1890-1, z A. E. Tuttonem), badał temperatury krytyczne (z A. Rūckerem, 1884 r.) i lepkość cieczy (z R. Rodger, 1894 r.), dokonał dokładnego oznaczenia mas atomowych kilku pierwiastków.
Edward Divers (1837–1912), profesor w Japonii, pracował nad węglanem amonu i karbaminianem (1870 r.), odkrył sole kwasu diazotowego(I) (1871 r.), badał kwasy sulfonowe hydroksyloaminy (z T. Haga, 1900 r.).
Dimitr Iwanowicz Mendelejew (1834-1907), profesor w St. Petersburg w Rosji, przeprowadził szeroko zakrojone badania termicznej rozszerzalności cieczy (1861 r.), wyniki których pozwoliły mu na opracowanie idei temperatury krytycznej, bardziej szczegółowo zbadanej niezależnie przez Thomasa Andrewsa (1869 r.); jego najsłynniejszym wkładem w chemię było prawo okresowości (1869 r.), zapowiedziane przez J. A. R. Newlandsa (1864 r.) i przedstawione niezależnie, ale w mniejszym zakresie, przez Juliusa Lothara Meyera (1830-95), profesora w Karlsruhe i Tybindze, w 1870 roku. Mendelejew później badał właściwości roztworów oraz nad warunkami krytycznymi i ściśliwością gazów (1870–85).
Bohuslav Brauner (1855–1935), profesor w Pradze, był uczniem H. Roscoe’a, przeprowadził badania chemii telluru (1889 r.) i pierwiastków ziem rzadkich, w aspekcie prawa okresowości.
Sir William Ramsay (1852–1916), profesor University College w Londynie, rozpoczął swoje prace od chemii organicznej syntetyzując pirydynę (1877 r.). Wyznaczył (od 1885 r.) gęstość par substancji w różnych temperaturach i pod różnymi ciśnieniami (wraz z Sidneyem Youngiem, profesorem z Dublina), zastosował metodę napięcia powierzchniowego Eötvösa do wyznaczania ciężarów cząsteczkowych cieczy (1893 r.), odkrył gazy szlachetne (we współpracy z Lordem Rayleigh i profesorem M. Traversem) (1894-1908), pracował nad radioaktywnością i odkrył emanację radu i jego spontaniczną przemianę w hel (wraz z Frederickiem Soddy) (1904). Ramsay wysunął wczesną elektronową teorię wartościowości (1908-19).
Henri Moissan (1852-1907), profesor w Paryżu, badał tlenki metali (1879–83) i związki fluoru (1883 r.), wyizolował fluor (1886 r.), skonstruował piec elektryczny (1892 r.), użył go do otrzymania węglików metali i węgliku krzemu (1893-4), opracował metodę otrzymywania sztucznych diamentów (1893 r.), badał azotki metali (1895 r.), redukcję odpornych tlenków metali (1896 r.) i, we współpracy z profesorem S. Smilesem, wodorków krzemu (1902 r.).
Friedrich Raschig (1863–1928), przedstawił teorię reakcji w komorach katalitycznych do produkcji kwasu siarkowego (1887 i nast.), badał kwasy sulfonowe hydroksyloaminy (1887 r.), opracował metodę technicznej produkcji hydroksyloaminy (1887 r.), badał jodek azotu (1885 r.) i kwasy tionowe. Odkrył chloraminę (1907 r.) i opracował prostą metodę produkcji hydrazyny z amoniaku (1908 r.); opracował techniczną konwersję hydrazyny do kwasu hydrazonowego, którego sól ołowiowa (azydek ołowiu) wprowadzono jako detonator w Niemczech podczas wojny 1914-18. Raschig był autorytetem w dziedzinie technicznej produkcji fenolu. Jego badania (Schwefel- und Stickstoffstudien, 1924) cechuje duża oryginalność.
Alfred Werner (1866–1919), profesor w Zurychu, wysunął teorie dotyczące stereochemii azotu (z A. Hantzsch, 1890 r.) i związków kompleksowych (1893 r.; Neuere Anschauungen auf dem Gebiete der anorganischen Chemie, 1905 r.), wprowadzając ważną idea liczby koordynacyjnej. Uzyskane optycznie czynne substancje, których aktywność wynikała z obecności innych niż węgiel pierwiastków (1911 r.). Idee Wernera leżą u podstaw współczesnej chemii nieorganicznej, ponieważ zerwały z teoriami budowy opartymi na badaniach związków węgla i przygotowały drogę do elektronowej teorii wartościowości.
Theodore William Richards (1868–1928), profesor z Harvardu, rozpoczął pracę nad masami atomowymi w 1883 r. Około 1903 r. z pomiarów fizykochemicznych stało się jasne, że niektóre wartości Stasa były mniej dokładne niż przypuszczano, a ponieważ podstawowym pierwiastkiem na którym oparł się Stas było srebro (nie tlen), Richards i jego uczniowie w 1904 r. zmienili niektóre dane Stasa, obniżając wartość srebra z 107,03 do 107,88. Richards przeprowadził również badania dotyczące izotopów ołowiu, termochemii (np. ciepła zobojętniania, 1905 r.) i elektrochemii (1897 r.) oraz objętości atomowych i ściśliwości pierwiastków (1901-4).
Alfred Stock (1876–1946), profesor w Berlinie, badał rozkład wodorku antymonu (1904 r.), siarczków fosforu (1906 r.), a zwłaszcza wodorków boru i krzemu (1912 r.).
Otto Ruff (1871–1939) badał siarczek azotu (1903 r.), wiele fluorków metali i niemetali, dopracował metody otrzymywania sztucznych diamentów (1917).