 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Widma elektronowe związków koordynacyjnych metali przejściowych
Widma elektronowe związków koordynacyjnych metali przejściowych
Związki koordynacyjne metali przejściowych bardzo często są barwne, czyli absorbują światło z zakresu widzialnego. Absorpcja promieniowania elektromagnetycznego z zakresu bliskiej podczerwieni, widzialnego i ultrafioletu powoduje zmianę stanu elektronowego cząsteczki absorbującej. W przypadku związku koordynacyjnego metalu przejściowego pasma pojawiające się na absorpcyjnym widmie elektronowym w zakresie widzialnym są związane ze zmianą konfiguracji elektronowej (wzbudzeniem) atomu centralnego. Widma elektronowe zazwyczaj bada się w zakresie od 200 do 1100 nm (od bliskiego nadfioletu do bliskiej podczerwieni). W przypadku związków koordynacyjnych niektórych metali przejściowych istotne przejścia elektronowe występują przy dłuższych falach. Obszar ten obejmuje przejścia pomiędzy poziomami słabo wiążącymi i słabo antywiążącymi, wiążącymi i niewiążącymi oraz niewiążącymi i antywiążacymi. I tak mamy przejścia pomiędzy rozszczepionymi w polu krystalicznym (polu ligandów) poziomami d atomu centralnego, przejścia związane z przeniesieniem ładunku odpowiednio od ligandów do metalu i od atomu centralnego do ligandów. Najwyżej energetyczne przejścia elektronowe odpowiadają przejściom w obrębie ligandów, na przykład przejściom π→π* w obszarze wiązań wielokrotnych ligandów. W zakresie wyższych energii, odpowiadających długościom fal poniżej 180 nm, związki koordynacyjne są nieprzezroczyste ze względu na przejścia elektronowe pomiędzy silnie wiążącymi i silnie antywiążącymi poziomami cząsteczek związku. Z drugiej strony przy niskich energiach, czyli w zakresie bliskiej podczerwieni (powyżej 1100 nm) przejścia elektronowe są przesłaniane przez drgania cząsteczek.
Analizując absorpcyjne widma elektronowe związków koordynacyjnych możemy wnioskować o charakterze danego pasma nie tylko na podstawie położenia jego maksimum (zakres widziany czy ultrafiolet), lecz także na podstawie intensywności pasma. „Moc” przejścia elektronowego możemy ocenić na podstawie wartości molowego współczynnika absorpcji (e) występującego w równaniu opisującym ten proces: A=ε•c•l, gdzie c oznacza stężenie, l długość drogi optycznej. Wartość ε jest na tyle istotna, że efekty związane z przejściem elektronowym można oszacować następująco podając jej wartość:
| elektryczne przejścia dipolowe (Δl=±1) | 105 |
| sprzężenia wibronowe (nieadiabatyczne) | 102 |
| sprzężenia spinowo-rbitalne (DS≠0) | < 1 |
Zgodnie z zagadnieniami dotyczącymi miedzy innymi reguł wyboru możemy określić natężenie przejścia jako proporcjonalne do wielkości prawdopodobieństwa przejścia wyrażonego poprzez:
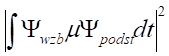
W związku z tym symetria funkcji opisujących stan wzbudzony i podstawowy oraz symetria operatora przejścia (μ) mogą wskazywać na to czy jego natężenie będzie zerowe czy też różne od zera. Operator przejścia jest funkcją współrzędnych x, y, z i odpowiada reprezentacji nieprzywiedlnej t1u w geometrii oktaedrycznej i reprezentacji p w geometrii kulistej. Biorąc pod uwagę teorię pola krystalicznego jedynym rodzajem przejść elektronowych, na które zwraca się uwagę są przejścia pomiędzy rozszczepionymi orbitalami d atomu centralnego. Szerzej widma w zakresie UV-Vis rozpatruje się w teorii pola ligandów.
Rozpatrzmy przejście elektronowe w oktaedrycznym polu ligandów dla związku koordynacyjnego o konfiguracji atomu centralnego d1. W takim wypadku prawdopodobieństwo przejścia jest równe zeru, gdyż funkcje wzbudzona (ψ*) i podstawowa (ψ) mają symetrie typu g. Operator μ ma symetrię typu u, więc g×u×g,=u, co pokazuje, że przejście to jest zabronione. Mimo tego związki metali 3d-elektronowych jak [Ti(H2O)6]+ są barwne. Promieniowanie elektromagnetyczne nie tylko powoduje wzbudzenie elektronów, równocześnie wzbudzane są oscylacje cząsteczki, które zmieniają symetrię funkcji wzbudzonej z g na u. Teraz funkcja podcałkowa nie jest równa zeru i moment przejścia nie jest zerowy. Sprzężenie elektronowe i wibracyjne (oddziaływanie pomiędzy przejściem elektronowym a drganiem cząsteczki) prowadzące do pozornego naruszenia reguł wyboru, zwane jest sprzężeniem wibronowym. Ten rodzaj przejścia elektronowego jest obwarowany warunkiem, zgodnie z którym orbitale biorące w nim udział muszą podlegać wzajemnym wpływom. Innymi słowy nie mogą być one całkowicie niewiążące; muszą zawierać pewien „dodatek” orbitali ligandów. Niesie to ze sobą pewną kolejną cechę obserwowaną na widmach UV-Vis związków koordynacyjnych. Otóż pasma te są poszerzone w stosunku do ostrych linii na widmach atomowych. Te ostatnie ściśle spełniają zasadę Δl=±1, a ponadto widma elektronowe lantanowców potwierdzają tę regułę, gdyż orbitale 4f są praktycznie niewiążące i przejścia f→f są mniej intensywne i zdecydowanie węższe niż d→d.
Poza wspomnianą regułą wyboru istnieje kolejna, znacznie bardzie rygorystyczna. Otóż zmiana spinu wyrażona poprzez ΔS=0 jest przestrzegana bardziej konsekwentnie, gdyż nie istnieje sprzężenie wibronowe, które naruszałoby tę regułę. Jeśli przypatrzymy się diagramom Tanabe-Sugano to dla wyskospinowych związków koordynacyjnych o konfiguracji atomu centralnego d5 nie można oczekiwać przejść typu t2g→eg w polach krystalicznych o symetrii okataedrycznej. Jednak związki te, jak na przykład sole Mn2+, wykazują blado różowe zabarwienie. Innymi słowy przejścia d→d są obserwowane, a ich obecność wynika ze sprzężenia spinowo-orbitalnego pomiędzy atomową liczbą kwantową L, a atomową liczbą S; jeżeli takie sprzężenie zachodzi, (sprzężenie Russella-Sandersa) to reguła zabraniająca zmiany spinu (ΔS=0) nie musi być spełniona. Pojęcie sprzężenia Russella-Sandersa zostało omówione gdzie indziej jednak warto przeanalizować jego wpływ na widma elektronowe dla lepszego zrozumienia braku ścisłego przestrzegania reguły zabraniającej przejść elektronowych w obrębie podpowłoki. Otóż, funkcje falowe jak zakłada się w pierwszym przybliżeniu są typu orbitalnego lub spinowego. Tu istotny jest spójnik „lub”. W rzeczywistości mamy do czynienia z oddziaływaniem spinowo–orbitalnym powodowanym przez sprzężenie magnetyczne, które łączy orbitalne i spinowe momenty magnetyczne elektronów. W rzeczywistości oznacza to, że magnetyzm sprzęga spinowy i orbitalny moment pędu, co skutkuje tym, że żadna funkcja spinowa i orbitalna nie są stałe w czasie. Inaczej mówiąc sprzężenie to powoduje zatrzymanie spinu pojedynczego elektronu i momentu orbitalnego do czasu aż nie ustabilizuje się moment orbitalny elektronów jako całości. Oddziaływanie Russela–Sandersa wskazuje na rozpatrywanie całkowitego momentu magnetycznego jako wartości stałej. Dla pojedynczego elektronu możemy to zapisać jako: j = l + s, a dla grupy elektronów: J = L+S. W związku z oddziaływaniem elektronów oznaczenie termu, na przykład 3F wskazuje nie tylko na stałą spinową i orbitalną (S=1; L=3), lecz również na występowanie mieszaniny termów o różnej multipletowości. W związku z tym term 3F możemy opisać jako mieszaninę termów o różnej multipletowości, czyli przykładowo w postaci `3X`=3X + a1Y; `4Q`=4Q + b2Y itd. Współczynniki a i b zależą od efektywności sprzężenia, a parametrem określającym tę efektywność jest wartość stałej λ (ζ dla pojedynczego elektronu). Jeżeli wartość parametru λ jest bliska zeru to zarazem współczynniki a i b również zmierzają do zera.
Porównując te sprzężenia spinowo-orbitalnego z wielkościami rozszczepienia w polu krystalicznym dla jonów centralnych pierwszego i następnych szeregów metali przejściowych widać, że wartości stałej sprzężenia spinowo-orbitalnego są małe w porównaniu do efektów odpychania elektronów czy pola krystalicznego. Mimo to nie są one równe zero i wyrażenie na moment przejścia pomiędzy termami o różnej multipletowości, uwzględniając mieszanie momentów orbitalnego i spinowego, można zapisać następująco:
<`3X`|er|`1W`> = <3X + a1Y|er|1W + a3Z> = <3X|er|1W> + ab<1Y|er|3Z> + a<1Y|er|1W> + b<3X|er|3Z>
Pierwsze dwa termy są oczywiście równe zero ze względu na spinową regułę wyboru. Jednak dwa ostatnie nie zerują się i dlatego przejścia spinowo wzbronione są obserwowane. Jednak, ze względu na małą wartość sprzężenia spinowo-orbitalnego dla jonów centralnych czwartego okresu przejścia spinowo zabronione są mało intensywne.
Kolejne reguły rządzące przejściami elektronowymi zabraniają przejść typu d→d, które jednak obserwujemy w przypadku związków koordynacyjnych metali przejściowych. Łamanie reguły Laporte`a, zabraniającej przejść typu g→g i u→u zostało wcześniej wspomniane dla związków koordynacyjnych o geometrii tetraedrycznej. Oczywiście dla symetrii Td brak jest środka symetrii, co powinno prowadzić do bardzo intensywnych przejść związanych z wpływem pola krystalicznego. Co prawda przejścia typu d→d w związkach o geometrii tetraedrycznej są znacznie intensywniejsze w porównaniu do obserwowanych w przypadku cząsteczek związków koordynacyjnych o geometrii oktaedrycznej, jednak ich intensywność jest znacznie niższa niż przejść całkowicie dozwolonych. Fakt ten tłumaczy się następująco: pomimo, że w cząsteczkach o geometrii tetraedrycznej brak jest środka symetrii to orbitale d pozostają centrosymetryczne, co w połączeniu z parzystością operatora momentu przejścia nakłada ograniczenia związane tak z symetrią jak i momentem orbitalnym (Δl=±1). Mimo to brak środka symetrii powoduje, że orbitale p oraz dxy, dxz, dyz tworzą term T2, co wskazuje na udział orbitali typu p w poziomie t2 związków o geometrii tetraedru, a co za tym idzie wyrażenie na moment przejścia zawiera nie czyste orbitale d lecz hybrydę zawierającą również pewien udział orbitali typu p. Możemy zapisać, posługując się notacją wprowadzoną przy mieszaniu momentów spinowego z orbitalnym wyrażenie na moment przejścia jako:
<`d`|er|`d1`> = <d + cp|er|d1 + c1p1> = <d|er|d1> + cc1<p|er|p1> + c<p|er|d1> + c1<d|er|p1>
Analogicznie jak poprzednio dwa pierwsze wyrażenia są równe zero, na mocy reguły Laporte`a, natomiast dwa ostatnie opisują przejścia dozwolone ze względu na symetrię i regułę orbitalną. Współczynniki mieszania c i c1 nie są zerowe dla związków koordynacyjnych nie posiadających środka symetrii. Ponieważ intensywność przejść d→d jest znacznie niższa niż przejść spinowo dozwolonych to można wnioskować, że udział orbitali typu p w przejściach elektronowych jest niewielki. Należy nadmienić, że rozpatrywane orbitale p wskazują na wpływ ligandów na pole krystaliczne.
Dla związków koordynacyjnych o geometrii oktaedrycznej lub płaskiego kwadratu, posiadających środek symetrii, reguła Laporta musi być spełniona w sposób restrykcyjny. Dlatego przejścia w obrębie orbitali d nie powinny być obserwowane. Dla tych przypadków wyjaśnienie ich występowania jest inne. Otóż cząsteczka związku koordynacyjnego, jak i każdego innego, drga. Część drgań powoduje zniesienie środka symetrii w wyniku zmian długości wiązań metal-ligand, a w konsekwencji możliwe staje się mieszanie orbitali typu d i p i przejścia w polu krystalicznym mogą występować (wspomniane powyżej sprzężenia wibronowe). Należy jeszcze uwzględnić szybkość drgań zmieniających symetrię cząsteczki, gdyż zmiany długości wiązań są naprzemienne (skrócenie-wydłużenie) to znaczy drganie umożliwiające mieszanie orbitali typu dz + pz może być poprzedzone procesem odwrotnym dz - pz. Jednak czas w jakim następuje zmiana długości wiązania wynosi około 10-13 sekundy, czyli jest znacznie dłuższy od czasu wzbudzenia elektronowego (10-18 s). Dodatkowo podczas rejestrowania widma absorpcyjnego wzbudzeniu ulega nie pojedyncza cząsteczka lecz stosunkowo duży ich zbiór, co pozwala na rejestrowanie całego zakresu drgań. Z drugiej strony naruszenie reguły parzystości w przypadku związków koordynacyjnych wykazujących środek symetrii, jako zależne od drgań cząsteczki jest uzależnione od czynnika dynamicznego w odróżnieniu od cząsteczek o symetrii tetraedrycznej i dlatego intensywność pasm d→d jest około sto razy niższa.
W niektórych przypadkach pasmo d→d jest znacznie intensywniejsze niż wskazują na to przedstawione powyżej rozważania dotyczące reguł wyboru. Taka sytuacja występuje przykładowo dla [CoCl4]2-
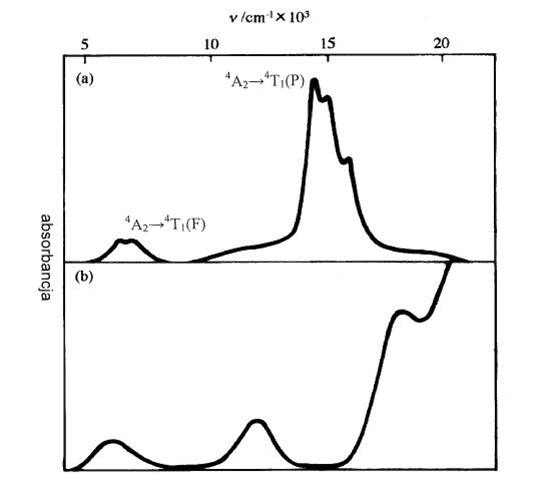
Kobalt w tetrachlorokobaltanie(II) ma konfigurację d7 i w związku z tym oczekiwane są trzy przejścia spinowo dozwolone 4A2→4T2(F), 4A2→4T1(F) oraz 4A2→4T1(P) obserwowane przy długościach fal odpowiednio 3500, 7000 i 14000 cm-1 czyli w zakresie bliskiej podczerwieni (2857, 1429 nm) i światła widzialnego (714 nm). Złożony charakter pasma przy 14000 cm-1 wynika ze sprzężenia spinowo-orbitalnego odgrywającego rolę dla termu 4T1(P) i pojawiających się tutaj przejść spinowo zabronionych pomiędzy termem kwartetowym 4A2 i dubletowym 2G. Istotną sprawą jest intensywność przejść spinowo zabronionych, która jest jak widać z rysunku 9.8 porównywalna z intensywnością przejść dozwolonych regułą spinową. Inne przejścia spinowo zabronione mają zgodnie z oczekiwaniem bardzo niską intensywność. Wyjaśnienie takiego stanu rzeczy opiera się na sprzężeniu spinowo-orbitalnym i podanym wyżej wyrażeniu na moment przejścia pomiędzy termami o różnej multipletowości, uwzględniającym mieszanie momentów orbitalnego i spinowego. Stopień oddziaływania termów o różnej multipletowości jest proporcjonalny do wielkości sprzężenia Russela-Sandersa, która dla metali przejściowych 3d jest stosunkowo niewielka. Z drugiej strony jest również odwrotnie proporcjonalna do różnicy energii pomiędzy oddziaływującymi termami. W przypadku jonu [CoCl4]2- termy kwartetowy i dubletowy mają bardzo zbliżone energie. W związku z tym sprzężenie spinowo-orbitalne powoduje bardzo duże wymieszanie stanów kwartetowego i dubletowego przez co spinowo wzbronione przejścia uzyskują znaczną intensywność. Tak więc charakter obserwowanych przejść elektronowych można opisać jako połączenie spinowo dozwolonego 4A2→4T1(P) oraz spinowo zabronionego przejścia typu 4A2→2X(2G). Dolny fragment rysunku 9.5 przedstawia sytuację w której pasmo d→d występuje blisko (na skali energii) spinowo dozwolonych przejść przeniesienia ładunku. W tym przypadku obydwa przejścia mogą ze sobą oddziaływać powodując znaczny wzrost intensywności pasma d→d kosztem pasma przeniesienia ładunku. Ponieważ pasma wynikające z przeniesienia ładunku są bardzo intensywne, to nawet niewielkie oddziaływanie pasm przeniesienia ładunku z pasmami odpowiadającymi przejściom w polu krystalicznym powoduje znaczny wzrost intensywności przejść d→d.
W przypadku wielu związków koordynacyjnych kobaltu, jak również w przypadku innych metali, mamy czasami do czynienia z sytuacją odwrotną do przedstawionej powyżej. Otóż przejścia spinowo dozwolone wykazują znacznie niższą intensywność niż oczekiwana. Taką sytuację spotyka się często w przypadku związków kobaltu(II) o geometrii oktaedrycznej
![Widmo [Co(H2O)6]2+ wykazujące niska intensywność pasma 4T1g→4A2g Widmo [Co(H2O)6]2+ wykazujące niska intensywność pasma 4T1g→4A2g](../../attachments/Image/fig2.png?template=generic) Widmo [Co(H2O)6]2+ wykazujące niska intensywność pasma 4T1g→4A2g
Widmo [Co(H2O)6]2+ wykazujące niska intensywność pasma 4T1g→4A2g
Dla trzech spinowo dozwolonych przejść 4T1g(F)→4T2g, 4T1g(F)→4A2g i 4T1g(F)→4T1g(P) pasmo odpowiadające przejściu pomiędzy termami 4T1g(F) i 4A2g wykazuje bardzo niską intensywność. Wyjaśnienie takiego stanu wymaga przeanalizowania diagramu Tanabe-Sugano dla konfiguracji d7, a szczególnie rozpatrzeniu w jaki sposób termy: 4T1g(F) w słabym polu krystalicznym korelują z konfiguracją t2g5eg2 w silnym polu ligandów, 4T2g(F) i 4T1g(P) z t2g4eg3 oraz 4A2g z konfiguracją t2g3eg4. Poniżej przedstawiono diagram korelacyjny termów kwartetowych dla konfiguracji d7.
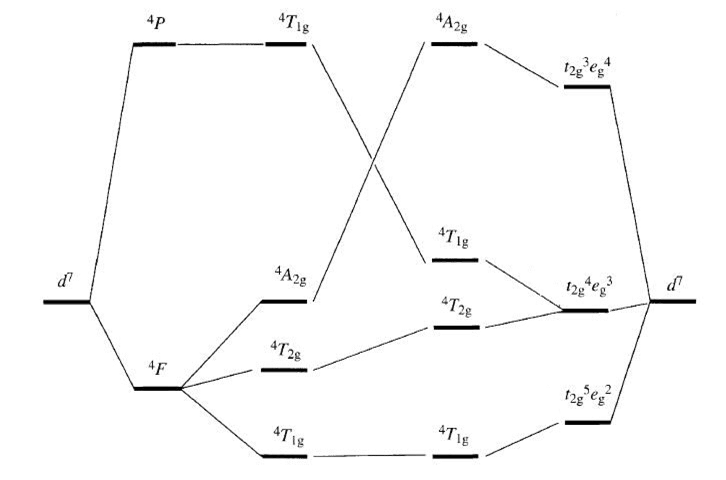 W silnym polu krystalicznym przejścia 4T1g(F)→4T2g i 4T1g(F)→4T1g(P) związane są ze wzbudzeniem jednego elektronu z poziomu t2g na eg natomiast przejściu pomiędzy termami 4T1g(F) i 4A2g odpowiada wzbudzenie dwóch elektronów pomiędzy poziomami t2g i eg. Ponieważ wzbudzenie dwóch elektronów jest mniej prawdopodobne niż przejście jednoelektronowe to i intensywność tego pasma jest znacznie niższa. Oczywiście, że w rzeczywistości przejście 4T1g(F)→4A2g nie jest czystym przypadkiem wzbudzenia dwuelektronowego i w związku z tym pasma te są obserwowane.
W silnym polu krystalicznym przejścia 4T1g(F)→4T2g i 4T1g(F)→4T1g(P) związane są ze wzbudzeniem jednego elektronu z poziomu t2g na eg natomiast przejściu pomiędzy termami 4T1g(F) i 4A2g odpowiada wzbudzenie dwóch elektronów pomiędzy poziomami t2g i eg. Ponieważ wzbudzenie dwóch elektronów jest mniej prawdopodobne niż przejście jednoelektronowe to i intensywność tego pasma jest znacznie niższa. Oczywiście, że w rzeczywistości przejście 4T1g(F)→4A2g nie jest czystym przypadkiem wzbudzenia dwuelektronowego i w związku z tym pasma te są obserwowane.
Rejestrując absorpcyjne widma elektronowe w różnych temperaturach, można zauważyć występowanie przesunięcia maksimum w kierunku wyższych energii, przy jednoczesnym obniżaniu szerokości połówkowej pasma w trakcie obniżania temperatury. Jest to zrozumiałe biorąc pod uwagę boltzmanowski rozkład stanów oscylacyjnych cząsteczek. W wyniku wzbudzenia elektronowego cząsteczka przechodzi ze stanu podstawowego do stanu wzbudzonego, ale w przypadku cząsteczek o wyższych stanach oscylacyjnych niż podstawowy wymagana do wzbudzenia energia promieniowania elektromagnetycznego jest niższa, niż w przypadku cząsteczek znajdujących się w oscylacyjnym stanie podstawowym. I odwrotnie w niskich temperaturach „liczba” cząsteczek na wyższych stanach oscylacyjnych jest niższa i energia wzbudzenia elektronowego jest wyższa, dlatego maksimum na widmie absorpcyjnym przesuwa się w kierunku fal krótszych. Ogólna reguła, mówi że intensywność pasm d→d w związkach mających środek symetrii obniża się podczas zmniejszania temperatury, w której prowadzony jest pomiar. Natomiast zjawisko to nie występuje w przypadku związków koordynacyjnych nie posiadających środka symetrii.
Energie termów w oktaedrycznym polu ligandów można określić za pomocą parametrów Racah i parametru rozszczepienia 10Dq (Δ).
| dn | konfiguracja | Term | Energia termu |
| d2 | t22 |
3T1 1E 1T2 1A2 |
7,5B – 3Dq – 0,5(225B2 + 100Dq2 +180Dq)1/2 –8Dq + 9B + 2C – 6B2/10Dq –8Dq + 9B + 2C – 12B2/10Dq –8Dq + 18B + 5C – 108B2/10Dq |
| t21e1 |
3T2 3T1 |
2Dq 7,5B – 3Dq + 0,5(225B2 + 100Dq2 +180DqB)1/2 |
|
| e2 | 3A2 | 12Dq | |
| d3 | t23 |
4A2 2E 2T1 2T2 |
–12Dq –12Dq + 9B + 8C – 50B2/10Dq –12Dq + 9B + 3C – 24B2/10Dq –12Dq + 15B + 5C – 176B2/10Dq |
| t22e1 |
4T2 4T1 |
–2Dq 7,5B + 3Dq +12(225B2 + 100Dq2 –180DqB)1/2 |
|
| t21e2 | 4T1 | 7,5B + 3Dq –12(225B2 + 100Dq2 –180DqB)1/2 | |
| d4 | t24 |
3T1 1E 1T2 1A1 |
–16Dq + 6B + 5C – 64B2/10Dq –16Dq + 12B + 7C – 82B2/10Dq –16Dq + 12B + 7C – 208B2/10Dq –16Dq + 21B + 10C – 436B2/10Dq |
| t23e1 | 5E | –6Dq | |
| t22e2 | 5T2 | 4Dq | |
| d5 | t25 | 2T2 | –20Dq + 15B + 10C –140B2/10Dq |
| t24e1 |
4T1 4T2 |
–10Dq + 18B + 6C –26B2/10Dq –10Dq + 18B + 6C –38B2/10Dq |
|
| t23e2 |
6A1 4A1 4E 4T2 4E 4T1 4A2 |
0 10B + 5C 10B + 5C 13B + 5C 17B + 5C 19B + 7C 22B + 7C |
|
| d6 | t26 | 1A1 | –24Dq + 5B + 8C –120B2/10Dq |
| t25e1 |
3T1 3T2 1T1 1T2 |
–14Dq + 5B + 5C – 70B2/10Dq –14Dq + 13B + 5C – 106B2/10Dq –14Dq + 5B + 7C – 34B2/10Dq –14Dq + 21B + 7C – 118B2/10Dq |
|
| t24e2 | 5T2 | –4Dq | |
| t23e3 | 5E | 6Dq | |
| d7 | t26e1 | 2E | –18Dq + 7B + 4C – 60B2/10Dq |
| t25e2 | 4T1 | 7,5B – 3Dq – 0,5(225B2 + 100Dq2 –180DqB)1/2 | |
| t24e3 |
4T2 4T1 |
2Dq 7,5B – 3Dq + (225B2 + 100Dq2 –180DqB)1/2 |
|
| t23e4 | 4A2 | 12Dq | |
| d8 | t26e2 |
3A2 1E 1A1 |
–12Dq –12Dq + 8B + 2C – 6B2/10Dq –12Dq + 16B + 4C – 108B2/10Dq |
| t25e3 |
3T2 3T1 1T2 1T1 |
–2Dq 7,5B + 3Dq – 0,5(225B2 + 100Dq2 –180DqB)1/2 –2Dq + 8B + 2C – 12B2/10Dq –2Dq + 12B + 2C |
|
| t24e4 | 3T1 | 7,5B + 8Dq + 0,5(225B2 + 100Dq2 –180DqB)1/2 |
Układy f-elektronowe
Przejścia f→f są mniej intensywne i zdecydowanie węższe niż d→d gdyż orbitale 4f są praktycznie niewiążące, a ich oddziaływanie z ligandami jest znikome. Pewien obrazowy pogląd można przedstawić rozkładając operator Hamiltona opisujący poziomy energetyczne w związkach koordynacyjnych metali d- i f-elektronowych na trzy czynniki związane odpowiednio z polem ligandów HLF, oddziaływaniem pomiędzy elektronami (HER) i sprzężeniem spinowo-orbitalnym (HLS). W takim przypadku ogólnie możemy zapisać wyrażenie na hamiltonian w postaci: H= HLF + HER + HLS oraz oszacować wpływ poszczególnych czynników dla różnych układów. Dla pierwszego i drugiego szeregu metali przejściowych czyli pierwiastków 3d i 4d-elektronowych udział czynników związanych z polem ligandów i wzajemnym oddziaływaniem elektronów jest porównywalny i wyższy od wpływu sprzężenia Russela-Sandersa, co można zapisać następująco: HLF ≈ HER > HLS. Dla pierwiastków 5d-elektronowych wszystkie trzy czynniki mają zbliżony wpływ na energię termów w związku koordynacyjnym (HLF ≈ HER ≈ HLS). W przypadku lantanowców człon związany ze wzajemnym oddziaływaniem elektronów ma decydujące znaczenie: HER > HLS > HLF. W przypadku związków koordynacyjnych aktynowców mamy sytuację analogiczną do związków lantanowców jednak wartości poszczególnych udziałów są zbliżone do siebie (HER ≥ HLS ≥ HLF).
Zgodnie ze schematem rozszczepienia orbitali f przejścia pomiędzy nimi możemy opisać stosując dwa parametry, zamiast jednego (10Dq) jak to miało miejsce w przypadku orbitali d, w polu krystalicznym o symetrii oktaedrycznej,


Poziom t1u tworzą orbitale fz(5z2-r2), fx(5x2-r2), fy(5y2-r2), t2u: fz(x2-y2), fx(y2-z2), fy(z2-x2), a poziom a2u zawiera orbital fxyz. Energie tych poziomów wynoszą odpowiednio 6Dq+20Fr, -2Dq-36Fr oraz -12Dq+48Fr. Obniżenie symetrii powoduje dalsza zmianę degeneracji orbitali f, a tym samym pojawienie się szeregu dodatkowych parametrów. Termy podstawowe w przypadku izolowanych jonów metali f-elektronowych są następujące: f1, f13 – 2F5/2,7/2, f2, f12 – 3H4,6, f3, f11 – 4I9/2,15/2, f4, f10 – 5I4,8, f5, f9 – 6H5/2,15/2, f6, f8 – 7F0,6, f7 – 8S7/2. Ponieważ oddziaływanie elektronów (n-1)f (ekranowanych przez elektrony zajmujące orbitale ns i np) z ligandami jest słabe, to wpływ pola krystalicznego można traktować jako zaburzenie przy rozpatrywaniu poziomów energetycznych jonów metali f-elektronowych. Jednak wzajemne oddziaływanie elektronów (n-1)f i nd jest na tyle duże, że jego wpływ, powodujący znaczne zwiększenie parametru rozszczepienia, należy uwzględnić przy rozpatrywaniu zmiany degeneracji podpowłoki nd. Przykładowo dla jonu Ce3+ w tetragonalnym polu krystalicznym wartość parametru 10Dq dla orbitali d można oszacować na około 30 000 cm-1.
Przejścia elektronowe w obrębie podpowłoki f są oczywiście zabronione regułą Laporta jednak oddziaływanie promieniowania elektromagnetycznego z elektronami jonu centralnego nie ogranicza się do składowej związanej z oddziaływaniem z dipolem elektrycznym (zabronionym regułą parzystości) ale obejmuje również zmiany dipola magnetycznego i kwadrupola elektrycznego. Te dwa ostatnie oddziaływania są dozwolone regułą parzystości. Nie wnikając w szczegółowe rozważania modeli wyjaśniających zadziwiająco dużą liczbę pasm na widmach lantanowców możemy wskazać dwa z nich jako najbardziej poglądowe. Modele te zakładają zniesienie zakazu wynikającego z reguły Laporta poprzez wymieszanie stanów elektronowych wynikających z konfiguracji elektronów (n-1)f ze stanami pochodzącymi z poziomu nd. Postuluje się dwa mechanizmy powodujące mieszanie tych termów. W tzw. „modelu statycznym” jest ono wynikiem oddziaływania potencjału pola krystalicznego, a „model dynamiczny” zakłada wpływ drgań sieci krystalicznej o odpowiedniej parzystości, na możliwość oddziaływania termów. Wzajemne oddziaływanie poziomów (n-1)f i nd ma jeszcze jedną istotną konsekwencję związaną ze stanami spinowymi. Dla konfiguracji f9 mamy możliwe dwa stany wzbudzone różniące się multipletowością jak pokazano na poniższym schemacie.

Różnice energetyczne pomiędzy stanami nisko- i wysokospinowymi dla jonów lantanowców na +3 stopniu utlenienia są zależne od rodzaju pierwiastka, ale największe wartości osiągają dla konfiguracji f8. Przykładowo: Tb3+ (4f8) 7990 cm-1; Dy3+ (4f9) 7380 cm-1; Ho3+ (4f10) 3460 cm-1; Er3+ (4f11) 3330 cm-1; Tm3+ (4f12) 2070 cm-1; Yb3+ (4f13) 1500 cm-1; Lu3+ (4f14) 800 cm-1.
Mimo, że wpływ pola ligandów na elektrony f jest niewielki (większy jest dla aktynowców niż dla lantanowców) to istnieje grupa przejść elektronowych wykazująca zdecydowanie silną zależność od konfiguracji sfery koordynacyjnej. Przejścia tego typu spełniają następujące reguły wyboru |ΔS|=0, |ΔL|≤2 i |ΔJ|≤2,
| Jon | Przejście elektronowe | Długość fali [cm-1] ([nm]) |
| Nd3+ | 4I9/2 → 4G5/2 | 17300 (586) |
| Sm3+ | 6H5/2 → 4F1/2; 4F3/2 | 6400 (1562) |
| Eu3+ |
7F1 → 5D1 7F0 → 5D2 7F2 → 5D0 |
18700 (535) 21500 (465) 16300 (613) |
| Dy3+ |
6H15/2 → 6F11/2 |
7700 (1299) |
| Ho3+ |
5I8 → 5G6 5I8 → 3H6 |
22100 (451) 27700 (361) |
| Er3+ |
4I15/2 → 2H11/2 4I15/2 → 4G11/2 |
19200 (521) 26400 (378) |
Pomimo że, rozszczepienie pasm pochodzące od pola ligandów jest trudne do zarejestrowania dla jonów metali f-elektronowych to oszacowano efekt nefeloauksetyczny dla tych jonów wynoszący około 4% co w porównaniu z 10-40% w przypadku jonów metali 3d-elektronowych jasno pokazuje znikomy wpływ pola ligandów na elektrony f. Istotnym zjawiskiem w przypadku lantanowców jest ich zdolność do luminescencji związana z dezaktywacją stanów wzbudzonych, przebiegającą często przez długożyjące stany pośrednie. Jednym z powodów utrudnionej, a przez to długotrwałej dezaktywacji stanów wzbudzonych jest różna multipletowość blisko leżących termów. Przykładem może być jon Pr3+ gdzie dezaktywacja stanu wzbudzonego 3P może zachodzić bezpośrednio do podstawowego stanu 3H lub przebiegać przez długożyjący pośredni stan singletowy 1D.
Zjawisko luminescencji dotyczy nie tylko związków koordynacyjnych metali f-elektronowych. Jest ono obserwowane również w przypadku d-elektronowych metali przejściowych, a stany emisyjne związków koordynacyjnych zostały zebrane w klasy związane z charakterem wzbudzenia. Pierwszą grupę stanowią zjawiska emisyjne związane z przejściami d→d i f→f czyli zachodzącymi w obrębie metalu (jonu) centralnego, powodowane wzbudzeniem w obrębie pola ligandów. Druga, bardzo szeroko reprezentowana, grupa związana jest z przeniesieniem ładunku od metalu do liganda (MLCT). Luminescencja tego typu jest obserwowana najczęściej dla niskospinowych związków koordynacyjnych metali o konfiguracjach d6, d8 i d10 z ligandami posiadającymi niskoenergetyczne orbitale akceptorowe p*. Kolejny typ przejść elektronowych związanych z promienistą dezaktywacją stanu wzbudzonego czyli przeniesienie ładunku od liganda do metalu (LMCT). Jest to proces najczęściej obserwowany w przypadku związków metali na wyższych stopniach utlenienia z silnymi s-donorowymi ligandami takimi jak fluorowce, amidki, imidki czy karbaniony. Związki takie wykazują stosunkowo niskoenergetyczne przejścia LMCT, które są jednak często związane z dysocjacją liganda. Ten typ luminescencji jest obserwowany przykładowo dla cyklopentadienylowych i imidowych związków koordynacyjnych skandu(III) i talu(V). Kolejną grupę luminescencyjnych związków stanowią bimetaliczne związki koordynacyjne. Emisja jest obserwowana dla dwujądrowych związków koordynacyjnych o konfiguracji atomów centralnych d10-d10, d8-d8, d7-d7 i d4-d4. Intersującym zjawiskiem jest wzrost rzędu wiązania metal-metal w stanie wzbudzonym. Przykładem mogą być związki platyny(II), w których rząd wiązania Pt(II)-Pt(II) w stanie podstawowym wynosi zero (układ d10; konfiguracja stanu podstawowego (sdz*)2(spz)0) czyli wiązanie de facto nie wystepuje, a w stanie wzbudzonym wzrasta do ½ (konfiguracja (sdz*)1(spz)1). Ostatnią grupę stanowią zjawiska emisji związane ze wzbudzeniem zachodzącym w obrębie i pomiędzy ligandami. Na emisję związaną ze wzbudzonymi stanami zlokalizowanymi w ligandach ma wpływ obecność jonu metalu. Często wzbudzone stany emisyjne liganda nie odpowiadają pod względem energii stanom wzbudzonym związku koordynacyjnego, co powoduje wygaszenie emisji przez bezpromieniste przejścia na niżej energetyczne stany zlokalizowane na metalu lub procesy przeniesienia ładunku. W przypadku słabego oddziaływania elektronowego liganda z jonem centralnym lub gdy jon centralny nie wykazuje niskoenergetycznych stanów wzbudzonych np. związki koordynacyjne glinu(III) lub cynku(II) fluorescencja ligandów wynikająca z singletowych stanów wzbudzonych jest obserwowana. Związki koordynacyjne metali czwartego i piatego okresu przez większe oddziaływanie z ligandami (oddziaływanie spinowo-orbitalne; efekt nefeloauksetyczny) zwiększają intensywność fluorescencji ligandów.