Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Syntezy związków heterocyklicznych
Syntezy związków heterocyklicznych
Najczęściej stosowanym procesem jest addycja nukleofila do węgla karbonylowego (lub bardziej reaktywnego węgla z O-protonowanego karbonylku). Gdy reakcja prowadzi do utworzenia wiązania C – C, nukleofilem jest węgiel β – anionu enolowego lub enolu czy enaminy. Jeśli proces ma prowadzić do powstania wiązania C – heteroatom, wówczas nukleofilem jest odpowiedni heteroatom, anionowy ( -X−) lub obojętny (-XH):
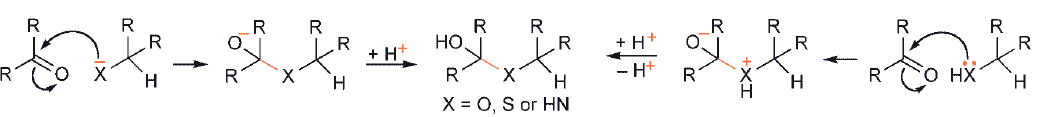
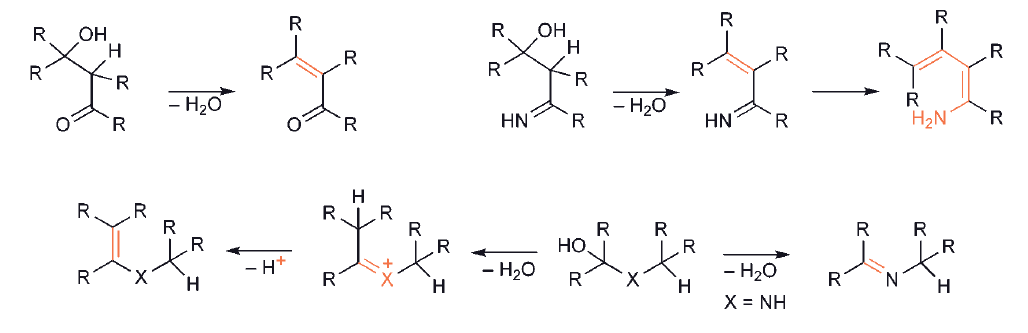
We wszystkich przypadkach następująca utrata wody powoduje powstanie wiązania podwójnego C – C lub C – heteroatom, tj. tworzenia produktu kondensacji aldolowej lub tworzenia iminy lub enaminy.
Do syntezy pięcioczłonowych heterocykli wymagane są prekursory z dwiema grupami karbonylowymi w pozycjach 1,4, a więc 1,4 – diketony reagujące z amoniakiem lub aminami pierwszorzędowymi tworzą 2,5-dipodstawione pirole; dwa następujące po sobie addycje heteroatomu do karbonylowego atomu węgla i utrata dwóch cząsteczek wody tworzą pierścień aromatyczny, chociaż dokładna kolejność tych etapów nie jest pewna.
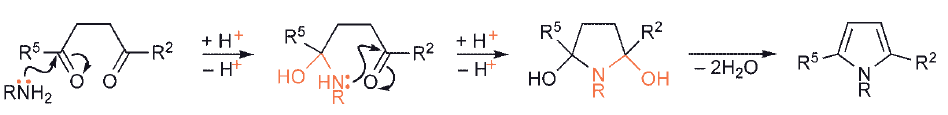
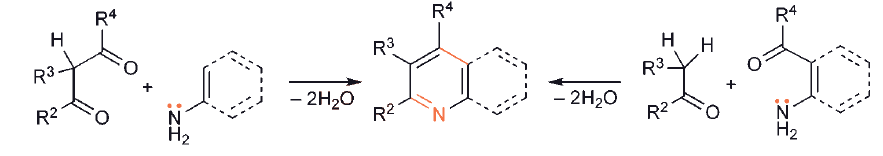
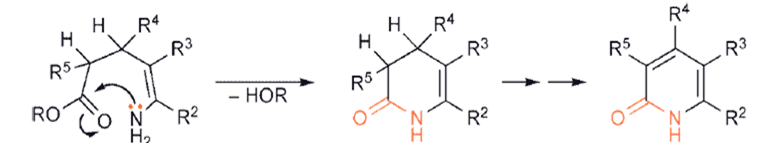
W przypadku pierścieni sześcioczłonowych prekursor 1,5-dikarbonylowy musi zawierać wiązanie podwójne C – C, aby doprowadzić bezpośrednio do układu aromatycznego.
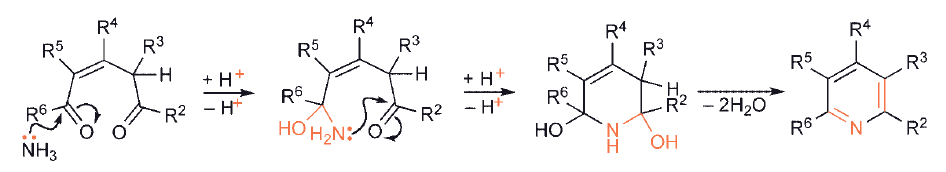
Zastosowanie nasyconego związku 1,5-dikarbonylowego nie prowadzi bezpośrednio do aromatycznej pirydyny, chociaż łatwo jest odwodornić dihydro-heterocykl.
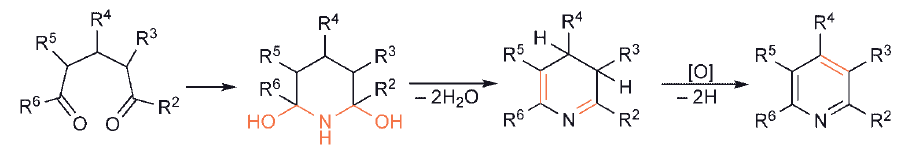
W drugim typie syntez, wymagającej utworzenia zarówno połączeń C–C, jak i C– heteroatom, jeden substrat musi zawierać enol/enolan/enaminę lub jego odpowiednik, podczas gdy drugi oczywiście musi mieć odpowiednie centra elektrofilowe.
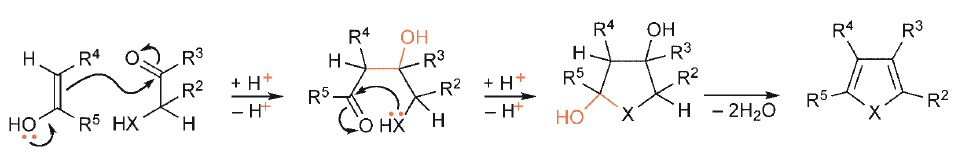
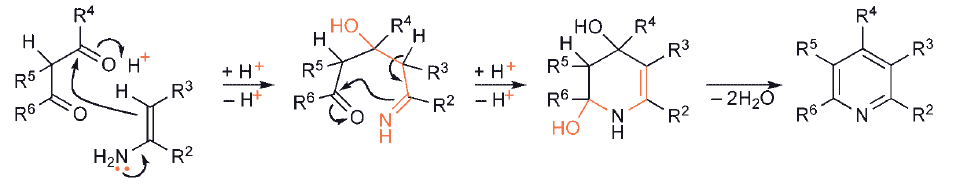
Zastosowanie zamiast związku karbnylowego ester kwasowy otrzymuje się produkt zawierający tlen przy tym węglu połączonym z heteroatomem. Podobnie, jeśli zamiast grupy karbonylowej jako centrum elektrofilowego stosuje się grupę nitrylową, to powstały heterocykl zawiera grupę aminową na tym węglu.
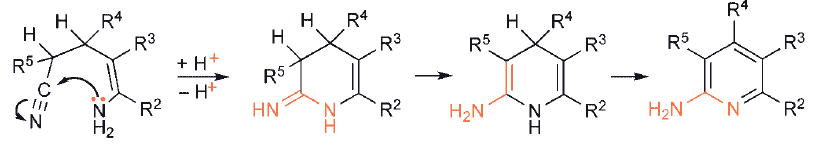
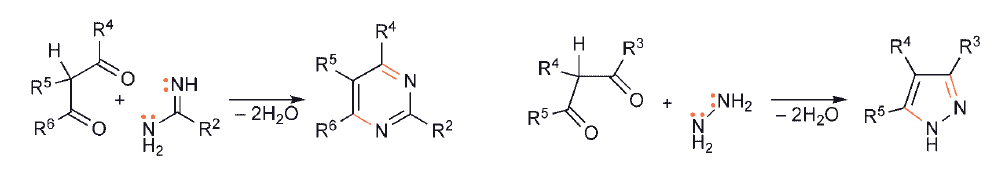
W przypadku syntez pirymidyn i pirazoli wykorzystywane są dwa centra nukleofilowe.
W przypadku syntezy benzoheterocykli fenole mogą pełnić rolę enoli a aniliny reagują w sposób analogiczny do enamin.