 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Grupa 16 – Tlenowce
Grupa 16 – Tlenowce
Tellur i polon zostały omówione na osobnej podstronie.
Tlen
Tlen jest bezbarwnym, bezwonnym, pozbawionym smaku, gazowym pierwiastkiem. Jest jednym z najbardziej rozpowszechnionych pierwiastków na Ziemi. W fazie płynnej i stałej ma bladoniebieskie zabarwienie. W naturze, w wolnej postaci, występuje jako paramagnetyczny gaz o dwuatomowej cząsteczce. Tworzy także trój- (trujący ozon) i czteroatomowe cząsteczki. Znane są trzy trwałe izotopy tlenu.
Charakterystyczną cechą tlenu jest to, że tworzy on związki z praktycznie wszystkimi pierwiastkami (także z niektórymi gazami szlachetnymi) - chyba najbardziej znany to woda. Egzotermiczne reakcje z tlenem nazwane są utlenianiem i spalaniem. W normalnych temperaturach cząsteczka tlenu jest stosunkowo bierna, dlatego do zapoczątkowania reakcji potrzebna jest pewna energia. Reakcja utleniania jest podstawowym źródłem energii organizmów zwierzęcych. Prawie wszystkie organizmy żywe na naszej planecie potrzebują tlenu, wolnego lub w związkach, do życia. Tlen jest najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej. Jest drugim po azocie składnikiem powietrza stanowiąc 20,9% objętości i 23,2% jego masy. Oceany zawierają około 88%, a litosfera około 47% tego pierwiastka. Przemysłowo tlen otrzymuje się ze skroplonego powietrza poprzez destylację frakcyjną (ok. 99% produkowanego tlenu) lub przez elektrolizę wody. W warunkach laboratoryjnych uzyskuje się go najczęściej poprzez ogrzewanie azotanu(V) potasu lub chloranu(V) potasu z tlenkiem manganu(IV) jako katalizatorem.
Duże ilości tlenu zużywane są do wytwarzania wysokich temperatur w palnikach do spawania, cięcia i topienia trudno topliwych metali. W fazie ciekłej jest stosowany jako utleniacz paliwa rakietowego.
| Konfiguracja elektronowa | He 2s2p4 | |
| Masa atomowa | 15.999 | |
| Gęstość [kg·m–3] | 1429 (273K) | |
| Główny stopień utlenienia | +2 (-1) | |
| Izotopy: | masa - zawartość | |
| 16O 17O 18O |
15,994 - 99,76% 16.999 - 0.038% 17.999 - 0.200% |
|
| Temperatura topnienia [K] | 54,1 | |
| Temperatura wrzenia [K] | 90,2 | |
| Promień atomowy [pm] | 22; 123 (O2-) | |
| Powinowactwo elektronowe [kJ·mol–1] | 141 | |
| Energia jonizacji [kJ·mol–1] | 1313,9 O → O+ + e– 3388,2 O+ → O2+ + e– 5300,3 O2+ → O3+ + e– |
|
| Elektroujemność (Pauling) | 3,44 | |
| Energia wiązań kowalencyjnych [kJ·mol–1] | O-O O = O N - O |
146 498 200 |
Siarka
Siarka jest pozbawionym smaku, zapachu, żółtawym niemetalicznym pierwiastkiem. Pierwiastek ten wymieniany jest w dziełach starożytności i w Biblii.
Z powodu łatwopalności uznawano ją w alchemii za niezbędny składnik procesu spalania. Siarka wykazuje silną tendencję do tworzenia łańcuchów oraz pierścieni. Jej pary są często kilku (8, 6, 4, 2) atomowe i dopiero w wyższych temperaturach rozpadają się na pojedyncze atomy. Siarka występuje w wielu odmianach alotropowych, jest nierozpuszczalna w wodzie, ale krystaliczne formy są rozpuszczalne w siarczku węgla (CS2). Bardzo ciekawe efekty obserwuje się podczas topnienia i krzepnięcia tego niemetalu. Podczas tych przemian fazowych siarka przechodzi przez kilka odmian alotropowych o różnych właściwościach, a po stopieniu krzepnie inną drogą, nie będącą dokładnym odwróceniem procesu topnienia.
Pierwiastek ten występuje na kilku stopniach utlenienia (-2, +4, +6) i tworzy wiele związków o praktycznym znaczeniu.Najważniejsze z nich to bezbarwny, toksyczny, o charakterystycznym zapachu zgniłych jaj siarkowodór (H2S), kwas siarkowy(VI) (H2SO4), kwas tiosiarkowy (H2S2O3), ich sole, tlenki siarki (SO3, SO2) i siarczki.
Tlenki siarki, uwalniane w procesie spalania węgla i pochodnych ropy, są wielkim zagrożeniem dla środowiska naturalnego. Z wodą zawartą w powietrzu tworzą kwasy siarkowe, które opadają na ziemię w postaci tzw. kwaśnego deszczu, niszcząc rośliny i przyspieszając erozję budynków.
Pierwiastek ten występuje w przyrodzie zarówno w związkach (siarczki, siarczany), jak i w stanie wolnym. Ponieważ jest ważnym składnikiem białek roślinnych i zwierzęcych, występuje w paliwach kopalnych będących pokładami obumarłych tkanek (węgiel kamienny - S, ropa naftowa - H2S). Jedne z największych złóż siarki znajdują się w Polsce, w okolicach Tarnobrzegu. Występuje także w meteorach. Zawartość w skorupie ziemskiej - 0,026% wagowego.
Występującą w przyrodzie siarkę wydobywa się albo przez metody odkrywkowe, lub też poprzez wytopienie jej z wydobytej skały. Inną metodą jest wytopienie siarki jeszcze pod ziemią za pomocą przegrzanej pary wodnej i wytłoczenie jej sprężonym powietrzem. Duże znaczenie ma także pozyskiwanie siarki z siarkowodoru, występującego w paliwach gazowych. Siarkę można także otrzymać z dwutlenku siarki redukując ją np. tlenkiem węgla lub koksem.
Wielkie ilości siarki i jej związków wykorzystuje się do produkcji dwusiarczku węgla i kwasu siarkowego(VI). Używana jest do wulkanizacji kauczuku (nadawanie elastyczności), jako składnik zapałek, ogni sztucznych i prochu. Bardzo ważna jest także dla wszystkich organizmów żywych jako składnik białek. Wykorzystywana jest również do produkcji barwników, jako specjalistyczny cement i do leczenia chorób skóry. Kwas siarkowy(VI) (H2S04) to jeden z podstawowych surowców przemysłu chemicznego, znajduje zastosowanie m.in. w syntezie innych związków (utleniacz) oraz jako stężony roztwór wodny, do osuszania gazów (wiązanie pary wodnej). Siarkowodór, silny reduktor, używany jest w chemii analitycznej. Halogenki siarki -dekafluorek (S2F10) i tetrafluorek siarki (SF4) są środkami fluorującymi. Dwutlenek siarki stosowany jest do odkażania.
Związki siarki:
dwusiarczek węgla – CS2 – bezbarwna lub żółtawa ciecz o temperaturze wrzenia 46,3oC, ruchliwa, łatwo palna - temperatura zapłonu poniżej 0oC. W stanie czystym nie posiada zapachu. Zanieczyszczony charakteryzuje się bardzo nieprzyjemnym zapachem. Otrzymuje się go przez przepuszczanie par siarki nad rozżarzonym węglem w temperaturze 800-1000oC. Inną metodą jest reakcja pomiędzy metanem i parami siarki w temperaturze 500-600oC.. Znajduje zastosowanie do otrzymywania jedwabiu wiskozowego i czterochlorku węgla, w procesach ekstrakcji tłuszczów i żywic oraz jako rozpuszczalnik.
siarkowodór – H2S – najprostszy związek siarki z wodorem. Bezbarwny gaz o temperaturze wrzenia -60oC i bardzo przykrej woni. Trujący 1mg siarkowodoru w 1 dm3 powietrza powoduje zgon. W wodzie rozpuszcza się dając roztwór kwaśny; tworzy sole - siarczki. Siarkowodór i jego sole mają własności redukujące. Występuje w przyrodzie jako produkt gnicia ciał białkowych zawierających siarkę i w niektórych wodach mineralnych. Otrzymywany działaniem kwasów nie utleniających na siarczki. Znajduje zastosowanie jako reduktor, w analizie chemicznej jako odczynnik grupowy przy analizie kationów, w syntezie organicznej.
ditlenek siarki – SO2 – powstaje w procesie spalania siarki na powietrzu. W laboratoriach otrzymywany w reakcji kwasu siarkowego z wodorosiarczynem sodu:
NaHSO3 + H2SO4 → SO2 + H2O + NaHSO4
Na skalę techniczną otrzymuje się go w wyniku prażenia pirytu lub blendy cynkowej:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
W skali przemysłowej znaczenie ma też proces redukcji anhydrytu węglem:
2CaSO4 + C → 2CaO + 2SO2 + CO2
W warunkach normalnych dwutlenek siarki jest gazem o charakterystycznym drażniącym zapachu. Daje się łatwo skroplić z utworzeniem bezbarwnej cieczy o temperaturze wrzenia 263,13K i krzepnącej w temperaturze 197,67K. W stanie ciekłym jest dobrym rozpuszczalnikiem związków nieorganicznych, które dysocjują w roztworze SO2. W wodzie rozpuszcza się dając roztwór o odczynie kwaśnym.
tlenek siarki(VI) – SO3 – związek ten nie może być otrzymany w wyniku bezpośredniego spalenia siarki w tlenie czy powietrzu. Wynika to z faktu, że równowaga tej reakcji jest przesunięta w lewo w wyższych temperaturach. Natomiast w temperaturach niezbyt wysokich szybkość reakcji jest bardzo mała. Dlatego do otrzymywania SO3 stosuje się katalizatory (V2O5). Do celów laboratoryjnych można go otrzymać w wyniku odwodnienia kwasu siarkowego(VI) pięciotlenkiem fosforu:
H2SO4 + P2O5 → SO3 + 2HPO3
lub przez ogrzewanie disiarczanu(VI) potasowego (pirosiarczanu):
K2S2O7 → K2SO4 + SO3
W stanie gazowym występuje w postaci pojedynczych cząsteczek. Skrapla się w temperaturze 317,7K, a krzepnie w 292,1K. Jako ciało stałe przypomina wyglądem lód. W tym stanie cząsteczki SO3 łączą się w cykliczne trimery (SO3)3 odmiana g. W obecności śladów wody powstaje odmiana ß-SO3 tworząca iglaste kryształki, w których występują polimeryczne łańcuchy o różnej długości. Istnieje jeszcze odmiana a o podobnej budowie. Stały trójtlenek siarki wykazuje w temperaturze pokojowej dużą lotność, a jego pary tworzą w zetknięciu z wilgocią mgłę kwasu siarkowego. Jest związkiem o dużej aktywności chemicznej przejawiających własności utleniające. Z wodą tworzy kwas siarkowy(VI).
kwasy siarkowe – siarka tworzy liczne kwasy tlenowe różniące się trwałością. Część z nich jest znana tylko w postaci soli:
kwas ditionowy – H2S2O4 – nie występuje w stanie wolnym. Znane są tylko jego sole, które powstają w czasie redukcji wodorosiarczynów w roztworach wodnych amalgamatem sodowym, kwasem mrówkowym lub pyłem cynkowym. Można je także otrzymać w procesie redukcji katodowej wodorosiarczanów(IV). Ditionin sodu jest bardzo silnym reduktorem.
OH | O=S-S=O | OH
kwas siarkowy(IV) – H2SO3 – wodne roztwory ditlenku siarki wykazują odczyn kwaśny, co jest spowodowane powstawaniem kwasu siarkowego(IV). Czystego kwasu nie da się wyodrębnić. Jest kwasem dwuprotonowym tworzącym dwa szeregi soli, sole obojętne i wodorosole. Tak jego sole jak i sam kwas wykazują własności redukujące.
OH | O=S-OH
kwas siarkowy(VI) – H2SO4 – otrzymywanie tego kwasu w skali technicznej polega na utlenianiu SO2 do SO3 i pochłanianiu tego ostatniego w wodzie. Jednak reakcja utleniania tlenku siarki(VI)i jest procesem egzotermicznym, co powoduje, że jej równowaga jest przesunięta w lewo. Stosuje się więc katalizatory tego procesu. Dawniej jako katalizator wykorzystywano platynę, którą obecnie zastąpił V2O5 zmieszany z KVO3 naniesiony na ziemię okrzemkową. W stosowanej wcześniej metodzie komorowej katalizatorem procesu utleniania były tlenki azotu. Gazy opuszczające warstwę katalizatora są pochłaniane w roztworze kwasu siarkowego(VI) w wyniku czego powstaje H2S2O7. Dopiero ten kwas rozcieńczony wodą daje kwas siarkowy(VI). Czysty kwas siarkowy(VI) jest bezbarwną, oleistą cieczą, bez zapachu o gęstości 1,84 g·cm–3. Tworzy azeotrop o stężeniu 98,3%, wrzący w temperaturze 611K. Z wodą miesza się w każdym stosunku, a proces rozcieńczania jest silnie egzotermiczny. Stężony kwas siarkowy(VI) jest silnie higroskopijny. Wykazuje tak silną skłonność do wiązania wody, że niektóre substancje organiczne (węglowodany) ulegają w kontakcie z nim zwęgleniu. Wykazuje własności utleniające roztwarzając w podwyższonej temperaturze niektóre metale szlachetne (Cu, Hg) i niemetale (S, C) a sam redukując się do tlenku siarki(IV).
Jest mocnym kwasem dwuprotonowym. Dysocjacja na pierwszym stopniu jest niemal 100%, a drugi stopień dysocjacji jest stosunkowo niewielki (kilkuprocentowy).
OH | O=S=O | OH
kwas tiosiarkowy – H2S2O3 – w stanie bezwodnym został otrzymany w reakcji chlorowodoru z tiosiarczanem sodu prowadzonej w eterze dietylowym w temperaturze 195K. Czysty kwas jest bardzo nietrwały. Ulega rozkładowi w temperaturze poniżej 273K na siarkowodór i tlenek siarki(VI).
OH | S=S=O | OH
kwas nadtlenosiarkowy – kwas Caro H2SO5 – białe ciało stałe, silnie higroskopijne. Wykazuje własności utleniające. W obecności wody hydrolizuje na kwas siarkowy(VI) i nadtlenek wodoru.
OH | O=S=O | O | OH
kwas nadtlenodisiarkowy – H2S2O8 – otrzymuje się poprzez elektrolityczne utlenianie kwasu siarkowego(VI) na elektrodach platynowych. W analogiczny sposób uzyskuje się sole tego kwasu. Jest bezbarwnym ciałem stałym, trwałym pod nieobecność wilgoci. Kwas i jego sole są silnymi środkami utleniającymi. W roztworach wodnych hydrolizuje do kwasu Caro i kwasu siarkowego(VI).
OH | O=S=O | O | O | O=S=O | OH
kwas ditionoowy – H2S2O6 – znany jest tylko w postaci rozcieńczonych roztworów i soli. Roztwory tego kwasu (jego sole) otrzymuje się w procesie utleniania siarczanów(IV) tlenkiem manganu(IV) w roztworze wodnym. Jest on pierwszym przedstawicielem szeregu kwasów politionowych o ogólnym wzorze H2SnO6. Kwasy politionowe (n - prawdopodobnie może dochodzić do 60) znane są tylko w roztworze i w postaci soli. Mieszanina tych kwasów powstaje w wyniku działania siarkowodoru na wodny roztwór tlenku siarki(IV).
OH | O=S=O | O=S=O | OH
halogenki siarki
fluorek siarki(VI) – SF6 - bezbarwny, bezwonny gaz o temperaturze topnienia 210K i wrzenia 222K powstaje w wyniku bezpośredniej syntezy z pierwiastków. Jest bierny chemicznie do tego stopnia, że nie reaguje ze stopionymi wodorotlenkami litowców i wodorem. Dopiero w temperaturze 523K reaguje ze stopionym sodem. Ze względu na bierność chemiczną stosuje się go w generatorach wysokiego napięcia jako izolator gazowy.
dekafluorek disiarki(VI) – S2F10 – powstaje jajko produkt uboczny w reakcji siarki z fluorem. Bezbarwna ciecz o temperaturze wrzenia 302K i krzepnięcia 219K. Nie jest specjalnie aktywny chemicznie, nie ulega hydrolizie w obecności wodorotlenków litowców. W wyższych temperaturach rozpada się z utworzeniem rodników SF5· i F·.
chlorek pentafluorosiarki(VI) – SF5Cl – bezbarwny gaz o temperaturze wrzenia 254K i topnienia 209K. Otrzymuje się go w reakcji SF4 z Cl2 w obecności CsF w temperaturze 373-448K. Ulega hydrolizie.
fluorek siarki(IV) – SF4 – bezbarwny gaz o temperaturze wrzenia 233K i topnienia 152K. Otrzymywany w reakcji fluorku sodu z dichlorkiem siarki w acetonitrylu w temperaturze 343-353K. Bardzo reaktywny związek ulegający pod działaniem wody natychmiastowej hydrolizie do tlenku siarki(IV) i HF.
chlorek siarki(IV) – SCl4 – trwały tylko w niskich temperaturach . Tworzy jasnożółte kryształy topiące się w temperaturze 243K i rozkładające na SCl2 i Cl2 z których powstaje w temperaturze 193K. Pod działaniem wody natychmiast hydrolizuje do tlenku siarki(IV) i HCl. Z chlorkami będącymi kwasami Lewisa tworzy związki trichlorosulfoniowe [SCl3]+.
chlorek siarki(II) – SCl2 – ciemnoczerwona ciecz o temperaturze wrzenia 332K i topnienia 193K. Powstaje z pierwiastków. W pokojowej temperaturze rozkłada się na chlor i S2Cl2.
difluorek disiarki – S2F2 - temperatura topnienia 108K, wrzenia 263K. Powstaje w reakcji S2Cl2 z KF w temperaturze 413-418K. Atomy fluoru w tym związku są połączone z jednym atomem siarki S=SF2. W wyniku wprowadzenia AgF2 do stopionej siarki i oziębieniu ciekłym powietrzem gazów otrzymuje się FSSF o temperaturze topnienia 140K i wrzenia 272K. Przy wzroście temperatury przekształca się on w bardziej trwały S=SF2.
dichlorek disiarki – S2Cl2 – pomarańczowa ciecz o temperaturze wrzenia 411K i topnienia 193K. Powstaje podczas przepuszczania chloru nad stopioną siarką.
dibromek disiarki – S2Br2 - jest nietrwałą, ciemnoczerwoną cieczą o temperaturze topnienia 227K.
fluorek sulfonylu – SO2F2 – bezbarwny gaz o temperaturze wrzenia 221K i topnienia 153K. powstaje podczas termicznego (773K) rozkładu Ba(SO3F)2.
chlorek sulfonylu - SO2Cl2 – bezbarwna ciecz o temperaturze wrzenia 342K i topnienia 219K. Powstaje w reakcji SO2 z chlorem w obecności światła. W wodzie hydrolizuje z utworzeniem kwasu siarkowego(VI) i HCl.
fluorek peroksodisulfonylu – S2O6F2 – powstaje w reakcji SO3 z fluorem; temperatura wrzenia 340K, topnienia 222K.
fluorek tionylu – SOF2 – bezbarwny gaz o temperaturze wrzenia 243K i topnienia 163K. Powstaje w wyniku wymiany chlor-fluor pomiędzy chlorkiem tionylu a SbF3 w obecności chlorku antymonu(V).
chlorek tionylu – SOCl2 – bezbarwna ciecz o temperaturze wrzenia 348K i topnienia 169K. Powyżej temperatury wrzenia rozkłada się na tlenek siarki(IV), chlor i dichlorek disiarki. Otrzymuje się go w reakcji SO2 z PCl5. Pod działaniem wody hydrolizuje do tlenku siarki(IV) i HCl.
bromek tionylu – SOBr2 – pomarańczowoczerwona ciecz łatwo ulegająca rozkładowi. Powstaje w wyniku działania HBr na chlorek tionylu.
| Konfiguracja elektronowa | Ne 3s23p4 | |
| Masa atomowa | 32,066 | |
| Gęstość [kg·m–3] | 2070 (293K) | |
| Główny stopień utlenienia | +6 (-2; -1; 0; +1; +2; +3; +4; +5) | |
| Izotopy: | masa - zawartość - okres półrozpadu | |
| 32S 33S 34S 35S 36S |
31,972 - 95,02% - stabilna 32,971 - 0,75% - stabilna 33,968 - 4,21% - stabilna 34,969 - 0% - 87,9 dni 35,967 - 0,02% - stabilna |
|
| Temperatura topnienia [K] | 385,95 (odmiana alfa); 392 (beta); 393 (gamma) | |
| Temperatura wrzenia [K] | 717,8K | |
| Promień atomowy [pm] | 104 | |
| Powinowactwo elektronowe [kJ·mol–1] | 200,4 | |
| Energia jonizacji [kJ·mol–1] | 999,6 S -> S+ 2251 S+ -> S2+ 3361 S2+ -> S3+ |
|
| Elektroujemność (Pauling) | 2,58 | |
| Energia wiązań kowalencyjnych [kJ·mol–1] | S-H S-C S=C S-O S=O S-F S-Cl S-S |
347 272 476 265 525 328 255 226 |
Selen
Jak wiele innych, sąsiednich w układzie okresowym, pół- i niemetali występuje w kilku odmianach. Selen czerwony po ogrzaniu (150°C) przechodzi w półprzewodnikową odmianę o metalicznym połysku zwaną selenem szarym. Ciekły selen jest czarną cieczą, która w wyniku nagłego oziębienia przechodzi w selen szklisty o barwie pośredniej pomiędzy szarą i czerwoną odmianą. Ogrzewany selen szklisty staje się plastyczny. Pary selenu (cząsteczki Se2) mają żółty kolor. Pierwiastek ten jest reaktywny. Spala się na powietrzu niebieskim płomieniem tworząc tlenek selenu(IV) (SeO2). Reaguje bezpośrednio z fluorowcami. Tworzy selenki z wieloma metalami. Rozpuszcza się w kwasach utleniających (stęż. H2SO4 i HNO3) i roztworach wodorotlenków litowców. Selen i jego związki są silnie trujące. Selen jest pierwiastkiem śladowym. Często towarzyszy siarce w wielu naturalnych siarczkach. Rudy selenowe występują bardzo rzadko. Zawartość w skorupie ziemskiej 5·10–6% wagowych. Produkcja selenu jest procesem ubocznym przetwarzania (rafinacja) rud miedzi i siarki. Selen w rudzie doprowadza się do postaci dwutlenku, który rozpuszcza się w kwasie azotowym(V). Po wprowadzeniu do roztworu tlenku siarki(IV) (SO2), wolny selen wytrąca się w postaci czerwonego osadu. Inną metodą jest wytrącanie selenu z kwasu selenowego(IV) (H2SeO3) za pomocą hydrazyny. Półprzewodnikowe własności szarego selenu wykorzystywane są w prostownikach. Jako substancja fotoprzewodząca znalazł on zastosowanie w elektrotechnicznych elementach światłoczułych. Czerwona odmiana używana jest do barwienia szkła na czerwono i jako środek klarujący (usuwający zielone zabarwienie szkła powodowane obecnością związków żelaza). Selenian sodu (Na2SeO3) jest silnym insektycydem. Siarczek selenu jest stosowany w medycynie chorób skórnych.
Związki selenu:
- +2 stopień utlenienia:
selenki – analogiczne do tlenków i siarczków, mogą być związkami zasadowymi jak K2Se lub kwaśnymi jak CSe2. Reakcje z wodą tych związków przebiegają następująco:
K2Se + H2O ↔ KHSe + KOH
CSe2 + H2O ↔ H2Se + H2CO3
Analogiem wody jest selenek wodoru H2Se, który jest gazem o nieprzyjemnym zapachu; kąt HSeH w cząsteczce tego związku wynosi 91°; temperatura topnienia 207,3K; temperatura wrzenia 227,5K. W wodzie rozpuszcza się lepiej niż siarkowodór, tworząc słaby kwas o pierwszej stałej jonizacji 10–4.
halogenki – selen tworzy halogenki w wyniku bezpośredniej syntezy z pierwiastków np.:
2Se + Cl2 → Se2Cl2
Dla związków selenu(II) charakterystyczne są reakcje dysproporcjonacji, przebiegające w wyższych temperaturach lub w trakcie hydrolizy:
2SeCl2 + 3H2O → Se + H2SeO3 + 4HCl
- +4 stopień utlenienia
tlenek selenu(IV) –SeO2 – temperatura sublimacji 588K; białe ciało stałe; ma budowę łańcuchową: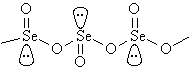
Otrzymuje się go w wyniku bezpośredniej syntezy z pierwiastków. Wykazuje pewne własności zasadowe tworząc z mocnymi kwasami sole SeO2·2HCl. Jest utleniaczem, przykładowo utlenia tlenek siarki(IV) do tlenku siarki(VI):
SeO2 + 2SO2 → Se + 2SO3
Dobrze rozpuszcza się w wodzie tworząc kwasy:
kwas selenowy(IV) – H2SeO3 - substancja stała, tracąca wodę w temperaturze 343K. Kwas ten można też otrzymać w wyniku hydrolizy halogenków selenu(IV):
SeCl4 + 3H2O → H2SeO3 + 4HCl
Kwas ten tworzy dwa szeregi soli - seleniany(IV) obojętne M2SeO3 i wodoroseleniany(IV) o wzorach: MHSeO3, MH3(SeO3)2.
tlenohalogenki selenu(IV) – SeOHal2 - związki o własnościach kwasowych.
SeOF2 – bezbarwny; temperatura wrzenia 397K;
SeOCl2 – jasnożółty, temperatura wrzenia 449K;
SeOBr2 – pomarańczowy, temperatura wrzenia 315K.
- +6 stopień utlenienia
tlenek selenu(VI) – SeO3 – biała substancja stała o temperaturze topnienia 458K. Występuje w dwóch odmianach amorficznej i azbestowej; silny utleniacz; z wodą reaguje bardzo energicznie tworząc kwas selenowy(VI) H2SeO4. W temperaturze powyżej 453K rozkłada się na lenek selenu(IV) i tlen. Można go otrzymać działając tlenkiem siarki(VI) na gorący roztwór K2SeO4:
K2SeO4 + SO3 → K2SO4 + SeO3
kwas selenowy(VI) – H2SeO4 – biała substancja krystaliczna o temperaturze topnienia 331K.W temperaturach powyżej 533K ulega rozkładowi z wydzieleniem tlenu. Silnie higroskopijny, pochłania wodę tworząc hydraty: H2SeO4·H2O, H2SeO4·2H2O, H2SeO4·4H2O. Kwas ten jest mniej trwały od kwasu siarkowego(VI); jako silny utleniacz utlenia HCl:
H2SeO4 + 2HCl → H2SeO3 + Cl2 + H2O
Mieszanina kwasu selenowego(VI) i kwasu solnego podobnie jak woda królewska rozpuszcza złoto i platynę.
| Konfiguracja elektronowa | Ar 3d104s24p4 | |
| Masa atomowa | 78,96 | |
| Gęstość [kg·m–3] | 4790 (293K) | |
| Główny stopień utlenienia | +4; +6 (-2; +1; +2) | |
| Izotopy: | ||
| 74Se 75Se 76Se 77Se 78Se 80Se 82Se |
73,923 - 0,9% - stabilny 74,923 - 0% - 120,4 dni 75,919 - 9,2% - stabilny 76,920 - 7,6% - stabilny 77,917 - 23,7% - stabilny 77,917 - 49,8% - stabilny 81,917 - 8,8% - stabilny |
|
| Temperatura topnienia [K] | 490 | |
| Temperatura wrzenia [K] | 957 | |
| Promień atomowy [pm] | 215,2 | |
| Powinowactwo elektronowe [kJ·mol–1] | 195 | |
| Energia jonizacji [kJ·mol–1] | 940,9 Se → Se+ 2044 Se+ → Se2+ 2974 Se2+ → Se3+ |
|
| Elektroujemność | 2,55 (Pauling); 5,89 eV (absolutna) | |
| Energia wiązań kowalencyjnych [kJ·mol–1] | Se-H Se-C Se-O Se-F Se-Cl Se-Se |
305 245 343 285 245 330 |