 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Układ okresowy pierwiastków
Układ okresowy pierwiastków
Wyjaśnienie natury odkrytej przez D. Mendelejewa okresowej zmienności właściwości pierwiastków ułożonych w kolejności wzrastającej liczby atomowej wymaga rozważenia osobliwości zapełniania powłok elektronowych atomów. Kolejność zapełniania powłok atomowych odkrył w 1922 roku Niels Bohr. Przechodząc od jednego atomu do następnego zwiększa się o jednostkę ładunek i w powłoce pojawia się kolejny elektron. Przy takim podejściu można by oczekiwać, że energia wiązania każdego z następnych dołączanych elektronów rośnie monotonicznie ze wzrostem liczby atomowej. Jednak w rzeczywistości tak nie jest. W atomie wodoru istnieje jeden elektron w stanie 1s. W atomie helu, następnego pierwiastka, pojawia się następny elektron w stanie 1s, przy czym energia wiązania każdego z elektronów w atomie helu jest znacznie większa niż w atomie wodoru. Wynika to z różnicy pól, w jakich znajdują się elektrony w obydwu atomach. Pola te w dużych odległościach są takie same, ale w pobliżu ładunku +2 w atomie helu pole jest silniejsze niż pole jądra w atomie wodoru o ładunku Z = 1. W atomie kolejnego pierwiastka, litu (Z = 3) trzeci elektron trafia do stanu 2s, gdyż zgodnie z zakazem Pauliego poziom 1s jest już obsadzony maksymalnie. Przy danym Z poziom 2s leży wyżej niż 1s. Natomiast w miarę zwiększania się ładunku jądra poziomy te obniżają się na skali energii, ale przy przejściu pomiędzy Z = 1 do Z = 2 pierwszy efekt znacznie przewyższa drugi i dlatego energia wiązania trzeciego elektronu w atomie litu jest znacznie mniejsza od energii wiązania elektronów w atomie helu. W atomach od berylu (Z = 4) do neonu (Z =10) kolejno przybywa jeszcze jeden elektron w stanie 2s i kolejne elektrony w stanie 2p. Energia wiązania tych elektronów wzrasta na skutek zwiększania się ładunku jądra. Kolejny elektron w atomie sodu trafia na poziom 3s, a efekt przejścia do wyższej powłoki przewyższa efekt zwiększania ładunku jądra. Tym samym energia wiązania wyraźnie maleje. Taki obraz zapełniania powłok elektronowych jest charakterystyczny dla całego układu okresowego pierwiastków. W związku z tym w kolejnych pierwiastkach w okresach w miarę zapełniania elektronami energia ich wiązania wzrasta i wyraźnie zmniejsza się przy przechodzeniu do następnego okresu. Zmiany te obrazują potencjały jonizacyjne pierwiastków odpowiadające energii wiązania elektronów w atomach.
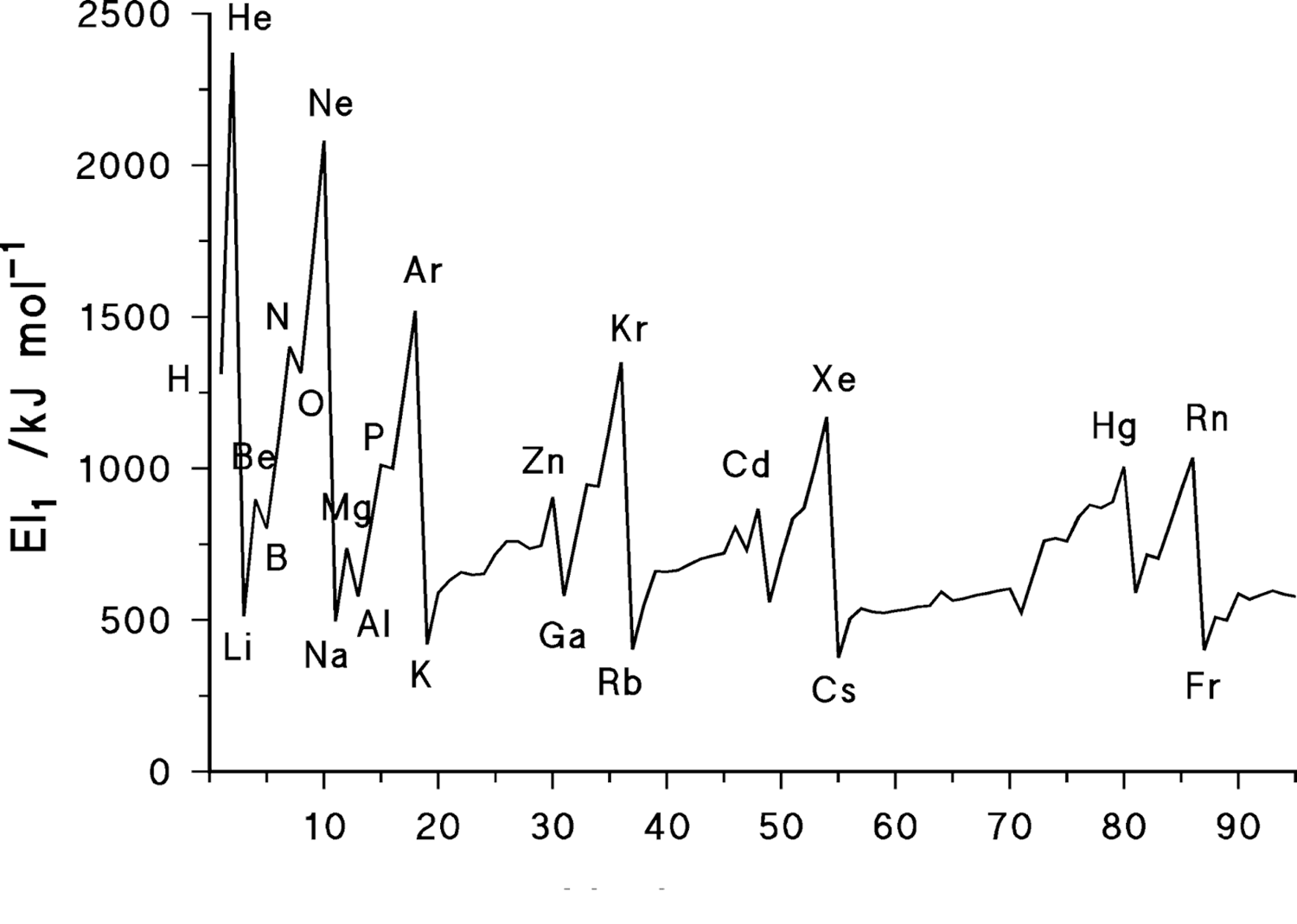 Uwzględniając zakaz Pauliego i kolejność zapełniania powłok możemy łatwo wskazać maksymalne liczby pierwiastków w danych okresach układu. W pierwszym okresie zapełniany jest stan 1s, na którym maksymalnie mogą znaleźć się dwa elektrony. W atomach pierwiastków drugiego okresu zapełniane elektronami są poziomy 2s i 2p co umożliwia rozlokowanie maksymalnie 8 pierwiastków. Atomy pierwiastków okresu trzeciego zapełniają elektronami poziom 3s i 3p co również umożliwia rozmieszczenie ośmiu pierwiastków. W następnych okresach dochodzi do zapełniania elektronami poziomów nd i nf co zwiększa ilość pierwiastków w tych okresach. I tak okres czwarty obejmuje poziomy 4s, 3d, 4p czyli maksymalnie 18 elektronów. Podobnie w okresie piątym mamy do dyspozycji stany 5s, 4d, 5p, a w okresie szóstym 6s, 4f, 5d, 6p czyli maksymalnie 32 elektrony. Należy jednak zdawać sobie sprawę z osobliwości stanów d i f, odróżniających je od stanów s i p. Otóż elektrony znajdujące się w stanach d i f są znacznie bliżej jądra niż w stanach s i p. Wynika to z przebiegu krzywych energii potencjalnej pola elektrycznego i pola sił odśrodkowych dla elektronów w ciężkich atomach. W ten sposób elektrony zapełniające stan 4f w atomach pierwiastków ziem rzadkich znajdują się znacznie bliżej jądra niż elektrony w stanach zapełnionych wcześniej. W rezultacie elektrony te nie wpływają praktycznie na właściwości chemiczne, uzależnione głównie od najbardziej zewnętrznych elektronów, pierwiastków. Z tego powodu właściwości chemiczne tych pierwiastków są bardzo podobne. Zapełnianie powłok d i f przebiega mniej regularnie niż ma to miejsce w przypadku poziomów s i p. Zamiast oczekiwanej konfiguracji dns2 pojawia się korzystniejsza energetycznie konfiguracja typu dn+1s lub dn+2. Przykładowo atom chromu ma konfigurację 3d 5s a nie 3d 4s2. Podobna sytuacja ma miejsce w przypadku jonów, które w niezapełnionych powłokach posiadają tylko elektrony d, a nie s czy p.
Uwzględniając zakaz Pauliego i kolejność zapełniania powłok możemy łatwo wskazać maksymalne liczby pierwiastków w danych okresach układu. W pierwszym okresie zapełniany jest stan 1s, na którym maksymalnie mogą znaleźć się dwa elektrony. W atomach pierwiastków drugiego okresu zapełniane elektronami są poziomy 2s i 2p co umożliwia rozlokowanie maksymalnie 8 pierwiastków. Atomy pierwiastków okresu trzeciego zapełniają elektronami poziom 3s i 3p co również umożliwia rozmieszczenie ośmiu pierwiastków. W następnych okresach dochodzi do zapełniania elektronami poziomów nd i nf co zwiększa ilość pierwiastków w tych okresach. I tak okres czwarty obejmuje poziomy 4s, 3d, 4p czyli maksymalnie 18 elektronów. Podobnie w okresie piątym mamy do dyspozycji stany 5s, 4d, 5p, a w okresie szóstym 6s, 4f, 5d, 6p czyli maksymalnie 32 elektrony. Należy jednak zdawać sobie sprawę z osobliwości stanów d i f, odróżniających je od stanów s i p. Otóż elektrony znajdujące się w stanach d i f są znacznie bliżej jądra niż w stanach s i p. Wynika to z przebiegu krzywych energii potencjalnej pola elektrycznego i pola sił odśrodkowych dla elektronów w ciężkich atomach. W ten sposób elektrony zapełniające stan 4f w atomach pierwiastków ziem rzadkich znajdują się znacznie bliżej jądra niż elektrony w stanach zapełnionych wcześniej. W rezultacie elektrony te nie wpływają praktycznie na właściwości chemiczne, uzależnione głównie od najbardziej zewnętrznych elektronów, pierwiastków. Z tego powodu właściwości chemiczne tych pierwiastków są bardzo podobne. Zapełnianie powłok d i f przebiega mniej regularnie niż ma to miejsce w przypadku poziomów s i p. Zamiast oczekiwanej konfiguracji dns2 pojawia się korzystniejsza energetycznie konfiguracja typu dn+1s lub dn+2. Przykładowo atom chromu ma konfigurację 3d 5s a nie 3d 4s2. Podobna sytuacja ma miejsce w przypadku jonów, które w niezapełnionych powłokach posiadają tylko elektrony d, a nie s czy p.