 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Henry Cavendish
Henry Cavendish
Henry Cavendish, urodzony w Nicei w 1731 roku i zmarły w Londynie w roku 1810 był doskonałe wykształconym człowiekiem, który poświęcił całe swoje życie badaniom naukowym, przekształcając swoją rezydencję na laboratorium. Był wyjątkowo nieśmiałym i ekscentrycznym człowiekiem, który z całych sił unikał pozowania do portretu. Jedyny szkic jakim dysponujemy został narysowany ukradkiem bez wiedzy Cavendisha. Lord Brougham pisał, że Cavendish „prawdopodobnie wypowiedział mniej słów w ciągu swojego życia niż jakikolwiek czterolatek”.
Oprócz swoich prac chemicznych Cavendish dokonał fundamentalnych badań energii elektrycznej i ciepła, z których większość nie opublikował. Jako pierwszy określił przewodność elektryczną roztworów soli i rozróżnił między napięciem i natężeniem prądu elektrycznego. Podał eksperymentalny dowód na oddziaływanie elektrostatyczne ładunków elektrycznych (prawo Coulomba) pokazując, że wewnątrz pustego przewodnika brak jest ładunku. Eksperymentował z ciepłem utajonym i właściwym, być może posiadając pewną wiedzę na temat eksperymentów i teorii J. Blacka. Odrzucił teorię materialnej natury ciepła, uważając, że polega on na wewnętrznym ruchu cząstek w ciałach, nazywając to „twierdzeniem sir Isaaca Newtona”, chociaż tak naprawdę teorię tę wysnuł Francis Bacon. Z zachowanych zapisków wynika, że po roku 1785 Cavendish nie przeprowadzał już żadnych doświadczeń chemicznych.
Pierwszą publikacją H. Cavendisha dotyczącą chemii był trzyczęściowy artykuł „Three Papers Containing Experiments on Factitious Air” z roku 1766. Nazwa „sztuczne (nienaturalne) powietrze” była używana przez R. Boyle’a. Cavendish mówi: „Przez sztuczne powietrze rozumiem ogólnie każdy rodzaj powietrza, który jest zawarty w innych ciałach w stanie nieelastycznym i jest wydzielany stamtąd za pomocą sztuki”, i podaje jako przykład ustalone powietrze J. Blacka. Opisuje manipulację gazami, w tym zbieranie w butlach wypełnionych wodą, w wannie pneumatycznej, przenoszenie gazu z jednej butli do drugiej przez wlewanie do góry przez lejek pod wodą; oraz przenoszenie gazu ze słoja do pęcherza za pomocą rurki syfonowej i ciśnienia hydrostatycznego.
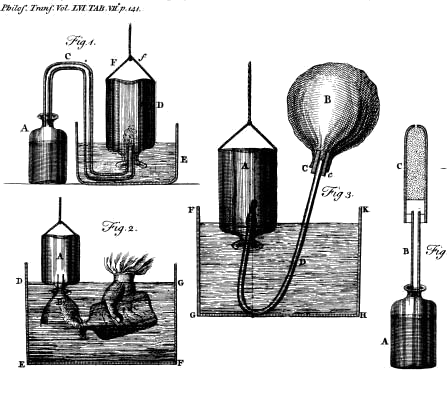 Rysunki H. Cavendisha z pracy „Three Papers Containing Experiments on Factitious Air”Cavendish stwierdził, że powietrze zawierające jedną dziewiątą objętości ustalonego powietrza gasi świecę, że woda pochłania znaczne ilości (1/9 więcej niż wynosi objętość wody) ustalonego powietrza w temperaturze pokojowej, a wartość ta wzrasta w przypadku wody zimnej oraz, że gotowanie powoduje usunięcie tego ustalonego powietrza z wady; duch wina (alkohol) pochłania 2 i 1/4 razy większą objętość ustalonego powietrza niż wynosi objętość alkoholu. Zaobserwował, że ustalone powietrze rozpuszcza się w alkaliach. Ustalone powietrze gromadził w cylindrze nad rtęcią. Ciężar ustalonego powietrza wydzielanego przez kwasy z wapienia, marmuru, spopielonych pereł (K2CO3) itp. określał za pomocą aparatu składającego się ze szklanej butli, do której nalewał kwasu i ważył ją łącznie z górną rurką suszącą wypełnioną strzępami bibuły. Następnie odważoną ilość substancji stałej umieszczał w butli z kwasem, zatykając ją rurką uszczelnioną za pomocą pasty migdałowej i kleju.
Rysunki H. Cavendisha z pracy „Three Papers Containing Experiments on Factitious Air”Cavendish stwierdził, że powietrze zawierające jedną dziewiątą objętości ustalonego powietrza gasi świecę, że woda pochłania znaczne ilości (1/9 więcej niż wynosi objętość wody) ustalonego powietrza w temperaturze pokojowej, a wartość ta wzrasta w przypadku wody zimnej oraz, że gotowanie powoduje usunięcie tego ustalonego powietrza z wady; duch wina (alkohol) pochłania 2 i 1/4 razy większą objętość ustalonego powietrza niż wynosi objętość alkoholu. Zaobserwował, że ustalone powietrze rozpuszcza się w alkaliach. Ustalone powietrze gromadził w cylindrze nad rtęcią. Ciężar ustalonego powietrza wydzielanego przez kwasy z wapienia, marmuru, spopielonych pereł (K2CO3) itp. określał za pomocą aparatu składającego się ze szklanej butli, do której nalewał kwasu i ważył ją łącznie z górną rurką suszącą wypełnioną strzępami bibuły. Następnie odważoną ilość substancji stałej umieszczał w butli z kwasem, zatykając ją rurką uszczelnioną za pomocą pasty migdałowej i kleju.
W swoich eksperymentach z palnym powietrzem (wodór) Cavendish uzyskiwał je działaniem rozcieńczonego kwasu siarkowego(VI) i kwasu solnego na cynk, żelazo i cynę. Stwierdził, że „powietrze jest takie samo i w tej samej ilości, niezależnie od tego, który kwas zostaje użyty do rozpuszczenia tej samej masy jakiegokolwiek konkretnego metalu”, i doszedł do wniosku, że powietrze to pochodzi z metalu, a nie z kwasu. Nazywa je „palnym powietrzem z metali”. Był zwolennikiem teorii flogistonu i reprezentowałby działanie kwasu na metal jako:
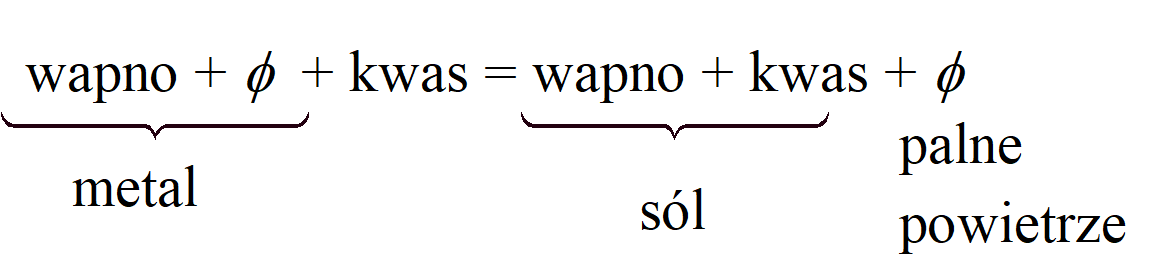
Cavendish pisze „ich flogiston [w metalach] ulatuje, nie zmieniając swojej natury pod działaniem kwasu, i tworzy palne powietrze Gaz prawdopodobnie nie pochodzi z kwasu, ponieważ palne powietrze powstaje również w procesach gnicia i suchej destylacji substancji roślinnych, które (jak metale) są bogate we flogiston. Z gorącym stężonym kwasem siarkowym(VI) metale wydzielały „siarkowe opary” (SO2), które uważał za związek kwasu siarkowego(VI) i flogistonu; z kwasem azotowym(V) wydzielały się czerwone opary, które miały być związkiem kwasu azotowego(V) i flogistonu.
Palne powietrze różniło się od ustalonego powietrza brakiem rozpuszczalności w wodzie i alkaliach. H. Cavendish stwierdził, że tworzy mieszaninę wybuchową z powietrzem, przy czym najbardziej gwałtowna detonacja następuje gdy zmieszaniu ulegną trzy objętości palnego powietrza z siedmioma objętościami zwykłego powietrza (nie próbował stosunku 2: 5). Gęstość palnego powietrza ustalił dwa sposoby. W pierwszym ważył pęcherza napełniony takimi samymi objętościami zwykłego powietrza i palnego powietrza, przy czym objętość określał za pomocą pomiaru obwodu pęcherza. Obliczył, że palne powietrze było 7 lub 10,8 razy lżejsze niż zwykłe powietrze. (Prawidłowa wartość to 14,4). W drugim sposobie zastosował jeden ze swoich aparatów, mierząc utratę ciężaru, gdy znaną masę metalu rozpuszczono w kwasie. Rurka susząca w tym przypadku wypełniał popiołem perłowym, który zatrzymywał zarówno wilgoć, jak i opary kwasu, przy czym dwutlenek węgla wydzielający się z reakcji kwasu z popiołem perłowym był zatrzymywany w postaci wodorowęglan potasu. W ten sposób stwierdził, że palne powietrze jest jedenaście razy lżejsze niż to, którym oddychamy.
Ogrzewając drut miedziany z „duchem soli” (HCl), do momentu aż całe powietrze zostanie usunięte z naczynia, Cavendish stwierdził, że „nagle, bez jakiejkolwiek sensownej zmiany ciepła, woda gwałtownie napłynęła. . . do butelki napełniając ją prawie całkowicie ”. Zauważa, że opar utworzony z kwasu „traci swoją elastyczność, gdy tylko zetknie się z wodą”. To dało J. Priestleyowi wskazówkę, która umożliwiła mu gromadzenie „kwaśnego powietrza” (HC1) nad rtęcią. W 1781 r. Cavendish stwierdził, że metodę pomiaru „dobroci” powietrza przez zmieszanie go z tlenkiem azotu zebranym w naczyniu nad wodą, którą zastosował J. Priestley uzyskując niepowtarzalne wyniki, można ustandaryzować poprzez wykonanie szeregu pomiarów w pewnym okresie czasu.. Pisze,, że „w ciągu drugiej połowy roku 1781 prowadziłem badania przez 60 różnych dni. . . ale, mimo oczekiwań, nie znalazłem żadnej różnicy w wynikach, chociaż wiatr i pogoda w tamtych czasach były bardzo różne; niektóre z dni były bardzo pogodne, inne bardzo mokre, a inne bardzo mgliste ”. Inne próby przeprowadzone w Londynie i Kensington dały ten sam wynik. Chociaż Cavendish nie pozwolił sobie na uznanie powietrza za mieszaninę powietrza deflogistonowego (tlenu) i powietrza flogistonowego (azotu), „jak przypuszczają pan Scheele i Lavoisier”, uzyskane przez niego wyniki odpowiadają 20,83 procentom objętościowym tlenu i 79,17% azotu, co daje wartości zbliżone do współczesnych. H. Cavendish był także pierwszym (1784 r.), który analizował powietrze z nieco wyższych warstw atmosfery pobierane przy pomocy balonu, znajdując go praktycznie takim samym jak na poziomie gruntu. Uprzedził C. Sheele’a w odkryciu kwasu arsenowego, który otrzymał gotując biały arsen (arszenik) z kwasem azotowym(V), ale nie opublikował wyników swoich badań.