 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
Teoria typów
August Laurent urodził się w La Folie, niedaleko Langres, w 1808 roku. Był uczniem i przez krótki czas asystentem J. B. A. Dumasa. Przez osiem lat był profesorem w Bordeaux, a potem wyjechał do Paryża, aby współpracować z Ch. F. Gerhardtem, ale brak środków utrzymania zmusił go do podjęcia pracy w mennicy, gdzie do dyspozycji miał zawilgoconą piwnicę jako laboratorium i mógł sobie pozwolić tylko na niewyszukane odczynniki. Zmarł w 1853 r. Zarówno Laurent, jak i Gerhardt poddani zostali ostracyzmowi przez swoich francuskich kolegów. A. W. von Hofmann, który odwiedził Paryż w 1851 r. z Thomasem Grahamem, pisze, że zostali ugoszczeni przez dwóch francuskich chemików, „Allerdings moins les deux” (czyli Laurenta i Gerhardta), którzy „verkehrten nur wenig mit ihren Fachgenossen; es war, als ob eine Art von Interdikt auf ihnen gelegen hätte.” Co mozn przetłumaczyć jako: „Naprawdę bardzo bolesne jest patrzenie, jak źle tych dwóch chemików, najbardziej błyskotliwych w swoim czasie, traktowali niektórzy z ich kolegów.” Gerhardt na rok przed śmiercią został uznany przez autorytety naukowe.
Laurent był zręcznym eksperymentatorem i zapalonym krytykiem, który pasjonował się zagadnieniami teoretycznymi klasyfikacji związków chemicznych. Jego Méthode de chimie został wydany w 1854 roku, rok po jego śmierci. We wstępie J-B. Biot pisze: „Cet ouvrage, rempli d’idées nouvelles. . . vous offre les convictions intimes d'un homme qui a enrichi la science de découvertes nombreuses et inattendues. … il attachait tant d’intérèt a laissèr après lui cet héritage, qu’il a traravaille à le finir, jusque dans les bras de la mort” Poważność i ogień autora przyświecają ze stron książki; jego logiczny umysł nie uległ zmniejszeniu w nowych systemach nomenklatury, od orientalnego atolan-telmm-ojafin-weso dla ałunu amonowego lub słowiańskiego lifavinaf dla merkaptan.
W 1832 r. Laurent przeprowadził badania naftalenu i jego pochodnych odkrywając antracen, a w 1836 r. uzyskał antrachinon przez utlenienie antracenu. W 1836 r. zsyntezował kwas ftalowy przez utlenienie naftalenu i stwierdził, że po podgrzaniu łatwo traci on wodę, przechodząc w bezwodnik. Badanie fenolu i jego pochodnych przeprowadzone w 1841 r. wykazało, że substancja ta jest identyczna z „kwasem karbolowym”, odkrytym w smole węglowej przez F. F. Runge w 1834 r., ale różni się od kreozotu odkrytego w smole drzewnej przez C. Reichenbacha w 1832 r.
Kiedy Berzelius oskarżył Dumasa o wysunięcie „absurdalnej teorii”, że chlor odgrywa tę samą rolę, co wodór w produktach substytucji, Dumas odpowiedział: „Nie jestem odpowiedzialny za przesadne rozszerzenie mitologii przez Laurenta”, ale po odkryciu kwasu trichloroctowego przekonał się do tej teorii i przekonywał, że jest ona jego autorstwa. Laurent wyjaśniał, że powodem, dla którego chlor może odgrywać rolę wodoru, jest silna tendencja rodnika chlorowego do takiego zachowania. Tak stabilną grupę atomów nazwał najpierw rodnikiem, a następnie jądrem („noyau”) biorących udział w reakcjach podstawienia. Pomysłu nie potraktowali poważnie Berzelius i Liebig, ale Laurent wykazał w 1837 r., że może on (rodnik) stanowić podstawę metody klasyfikacji związków organicznych, i w taki sposób wykorzystał to Gmelin w swoim Handbuch. Podstawowym „jądrem” jest pryzmat, którego kątami są atomy węgla, podczas gdy krawędzie są zajęte przez atomy wodoru. Te krawędzie można usunąć, ale aby zapobiec zapadnięciu się cząsteczki, należy je zastąpić innymi atomami, np. chloru, tworząc jądra pochodne. Można również „dodać wodór, halogen lub tlen, tworząc „hiperhydrydy”.
Teoria typów Dumasa
W wyniku swoich eksperymentów z chlorowaniem kwasu octowego i prawdopodobnie pod wpływem pomysłów Laurenta, Dumas w 1839 r. stwierdził, że: „w chemii organicznej istnieją pewne typy, które zachowują się nawet wtedy, gdy zamiast wodoru zawierają równą objętość chloru, a nawet gdy wprowadzany do cząsteczki jest brom lub jod”. W 1840 r. rozróżniał typy chemiczne czyli „substancje, które zawierają tę samą liczbę równoważników połączonych w ten sam sposób i wykazujących te same podstawowe właściwości chemiczne”, natomiast typy mechaniczne (drugi rodzaj) to substancje o podobnych wzorach chemicznych, powstające przez podstawienie, ale zasadniczo różne pod względem ich właściwości chemicznych. Typ mechaniczny został zapożyczony z tekstów H. V. Regnaulta; natomiast pojęcie typu chemicznego jest zawarty w pracy Laurenta. Jako przykłady można podać:
Rodzaje (typy) chemiczne Rodzaje (typy) mechaniczne
Kwas octowy C4H8O4 Gaz bagienny C2H2H6
Kwas chlorooctowy C4H2Cl2O4 eter metylowy C2OH6
Kwas mrówkowy C2H2O3
Chloroform C2H2Cl6
Chlorek węgla C2Cl2Cl6
Prześmiewczy list, naprawdę napisany przez Wöhlera, podpisał S.C.H. Windier (czyli „Swindler”), ale w języku francuskim i wysłany rzekomo z „Paris”, pojawił się w Annalen Liebiga w 1840 r. W liście wyśmiewane są nieuzasadnione rozszerzenia teorii substytucji przez Dumasa. Pomysłowy autor zastąpił wszystkie atomy w octanie manganu chlorem, tak że z MnO,C4H6O3 otrzymał Cl2Cl2,Cl8Cl6Cl6, a tym samym produkt podstawienia odpowiadał typowi i wykazywał wszystkie istotne właściwości octanu manganu, chociaż składał się wyłącznie z chloru. Przypis dodaje, że bielone tkaniny składające się wyłącznie z przędzionego chloru były w sprzedaży w Londynie i są „bardzo poszukiwane”.
Wstępna teoria Gerhardta
Blisko związany z Laurentem był Charles Gerhardt, urodzony w Strasburgu w 1816 r., który studiował u Liebiga i innych niemieckich chemików, a ostatecznie pracował w Paryżu. W 1844 r. został profesorem w Montpellier, gdzie miał do dyspozycji bardzo skąpo wyposażone laboratorium, w 1855 r. przeniósł się do Strasburga, gdzie zmarł w 1856 r. Gerhardt przeprowadził fundamentalne badania w dziedzinie chemii organicznej, z których najbardziej godnymi uwagi były prace nad bezwodnikami kwasów organicznych z roku 1852; i napisał dwa podręczniki: Précis de chimie organique, 2 tomy. Paryż, 1844-5, i Traité de chimie organique, 4 tomy. Paryż, 1853–56 i 1860–62. Pierwsza książka został źle przyjęta we Francji i Niemczech, ale William Gregory w Anglii uznał ją za bardzo dobrą. Gerhardt bezkompromisowo odnosił się na słowa krytyki swojego działa, i nie zwracał uwagi na ostrzeżenia Liebiga, co wzbudziło powszechne oburzenie i wpłynęło na odbiór jego osoby, i dalszych prac, wśród naukowców. Chociaż w swoich poglądach teoretycznych Gerhardt miał nieszczęście różnić się od większości ówczesnych wielkich autorytetów, ostatecznie przyznano mu rację, a jego wpływ na niezależnych myślicieli, takich jak A. W. Williamson i A. Kekulé, był znaczny.
W 1839 r. Gerhardt zwrócił uwagę na nowy rodzaj reakcji, którą początkowo nazwał sprzęganiem (accouplement), a następnie podwójnym rozkładem. Reakcja ta była komplementarna do procesów przyłączania (Dalton) i substytucji (Dumas) i zachodzi gdy dwie cząsteczki reagują z eliminacją części każdej, które to fragmenty tworzą prosty związek (woda, kwas chlorowodorowy itp.), podczas gdy „reszty” lub „rodniki” łączą się:
C6H5H + HO·NO2 → HOH + C6H5NO2
Te „pozostałości” nie muszą istnieć w stanie swobodnym: wyrażają jedynie możliwe mechanizmy reakcji chemicznych. Rodnik miał dla Gerhardta czysto formalne znaczenie; jego równania przedstawiają jedynie: „les relations qui rattachent les corps entre eux sous le rapport des transformations”. W szczególności: „wzory chemiczne nie są przeznaczone do reprezentowania rozmieszczenia atomów”. Powtarza to w kółko w swoich pismach. Jedna i ta sama substancja może mieć kilka czysto hipotetycznych wzorów zgodnie z konkretnymi reakcjami, w których odgrywa rolę.
Masy atomowe i równoważniki
Berzelius przyjął za równoważnik kwasów organicznych ich masy łączące się z jedną cząsteczką tlenku srebra. Ponieważ przyjął on dla tego ostatniego wzór AgO (Ag = 2 × 108), jego masy cząsteczkowe kwasów i ich wzory były dwukrotnie większe od rzeczywistych. Ponadto założył istnienie bezwodników we wzorach kwasów organicznych, a ze względu na to, że musiały one zawierać cząsteczkę wody dodanej do bezwodnika, wzór kwasu octowego zawierał dwa razy większe ilości atomów niż ma to miejsce. Należy również pamiętać, że „równoważnik” długi czas oznaczał to, co obecnie nazywamy masą cząsteczkową lub pewną wielokrotnością masy cząsteczkowej. Liebig, i Gerhardt do 1842 r., stosowali tak zwane „poczwórne wzory objętościowe” reprezentujące ilości substancji zajmujących tę samą przestrzeń co „cztery objętości” (H4) wodoru. To nasiliło zamieszanie, nazywając te ilości „równoważnikami” Berzelius użył przykładowo poprawnych wzorów odpowiadających dwóm objętościom dla alkoholu i eteru. Dumas przywiązywał dużą wagę do wyznaczania gęstości par, ale stosowane przez niego masy atomowe (C = 6, H = 1, 0 = 16) nie są oparte na zasadzie podwójnych objętości przy zapisywaniu wzorów związków.
W 1843 r. Gerhardt wskazał, że jeśli wzory związków organicznych zostały napisane w sposób wówczas zwyczajowy, to woda, kwas solny, dwutlenek węgla i amoniak były zawsze usuwane w reakcjach jako podwójne cząsteczki: H4O2, H2Cl2, C2O4 i N2H6, lub ich wielokrotnościach. Doszedł do wniosku, że jeśli formuły Berzeliusa dla prostych związków nieorganicznych (H2O, HCl, CO2, NH3) są prawidłowe, to jego wzory związków organicznych powinny zostać zmniejszone o połowę. Zatem kwasem octowym jest C2H4O2 (C = 12, H = 1, O = 6), a nie C4H8O4, lub C4H6O3 + H2O lub C8H4O2 + H4O2 (C = 6). Ten ostatni wzór został przyjęty przez Liebiga w celu wprowadzenia rodnika „acetylowego”, a wiele wzorów kwasów organicznych naprawdę reprezentowało bezwodniki, który, jak wiemy, dla bezwodnika kwasu jednozasadowego pochodzi z dwóch cząsteczek kwasu. Formuła kwasu chlorooctowego to C2HCl3O2 i dlatego nie może składać się z wody + bezwodnik, ani C2AgH3O2 octan srebra, nie zawiera tlenku srebra (Ag2O według Gerhardta): „w naszych kwasach nie ma wody i nie ma tlenku w solach.”
Podwojone wzory sumaryczne mogą reprezentować masy składające się z równoważników, C = 6, 0 = 8 itd., a jeśli te równoważniki zostałyby podwojone dając ciężary atomowe C =12, O = 16, S = 32 itd., które zostaną użyte, to w następstwie wzory związków byłyby zgodne z formułami związków nieorganicznych. To samo daje zmniejszenie o połowę wzorów Berzeliusa dla związków organicznych, przy zachowaniu jego ciężarów atomowych. Gerhardt faktycznie używa ciężarów atomowych Berzeliusa, ale nie mówi tego w sposób jawny. Jego prawidłowe masy atomowe metali alkalicznych i srebra były tylko o połowę mniejsze niż stosowane przez Berzeliusa, ponieważ zakładał, że wzory tlenków metali zazwyczaj są podobne do wzoru wody Me2O. Jego masy atomowe innych metali, takich jak cynk i miedź, były zatem o połowę mniejsze niż rzeczywiste, a tym samym jego system mas atomowych był mniej dokładny niż odrzucony przez Berzeliusa. W „nowych” masach atomowych Gerhardta wzory lotnych związków zgadzały się z ciężarami „dwóch objętości”, czyli objętości 2 gramów wodoru, H2. Gerhardt nie uznał tego wyniku za jedyną naczelną zasadę i nigdzie w swoich tekstach nie podkreślał wartości hipotezy Avogadro. Prawa dotyczące ciepła atomowego i izomorfizmu zostały również wykorzystane, tak jak zrobił to wcześniej Berzelius, ale nie były one systematycznie stosowane do określania mas atomowych metali. W 1846 r. Laurent przyjął masy atomowe Gerhardta jako najmniejsze ilości pierwiastków obecnych w masie cząsteczkowej dowolnego z ich związków. Definiuje „równoważniki” jako masy, które mają tę samą wartość w reakcjach lub zachowują te same funkcje w tworzeniu lub rozkładzie związków. Zwrócił uwagę, że istnieją pewne wyjątki od definicji masy cząsteczkowej Gerharda, która odnosi się do dwóch objętości, w takich przypadkach należy przyjąć masę czterech objętości, a te domniemane wyjątki (H2SO4, NH4Cl, PCl5 itd.) są substancjami, które dysocjują podczas ogrzewania, co zostało później określone przez S. Cannizzaro.
Jednak w swoim Traité Gerhardt używał starych wzorów, z wyjątkiem ostatniego, opublikowanego po jego śmierci, tomu. Było to konieczne, jak wyjaśnił, aby książka znalazła nabywców, ponieważ chemicy w ogóle nie użyliby jego nowych ciężarów atomowych. W tym czasie w kręgach chemicznych panowało nieprawdopodobne zamieszanie: stosowano różne ciężary atomowe i szereg wzorów opisujących te same związki. Najwyraźniej każdy chemik na znak niezależności poglądów stosował własny zestaw wzorów. W 1861 r. Kekulé podaje dziewiętnaście różnych wzorów kwasu octowego i „patrząc wstecz na te dyskusje”, pisze Carl Schorlemmer zaledwie 20 lat później, „wydaje się, że wkraczamy w przeszłość”.
Sanislao Cannizzaro
Użycie przekreślonych lub podkreślonych symboli pierwiastków przez Berzeliusa do przedstawienia podwójnych atomów we wzorze spowodowało pojawienie się wzorów podobnych do opartych na równoważnikach Gmelina, np. HO i HO, a kiedy pomijano przekreślenia, jak to bywało często, nie było wiadomo, który system mas atomowych jest w użyciu. Późniejsze użycie przekreślonych symboli pierwiastków przez F. A. Kekulégo i Ch. A. Wurtza do zapisywania mas atomowych Gerhardta wprowadziło dodatkowe zamieszanie. Tak naprawdę nie miało to większego znaczenia, gdyż każdy chemik miał swój własny zestaw symboli, ale po pracach A. W. Williamsona i Ch. F. Gerhardta wydawało się konieczne osiągnięcie jakiegoś porozumienia.
Chemicy z różnych krajów spotkali się w Karlsruhe w grudniu 1860 r., ale, jak można się było spodziewać, nie osiągnięto porozumienia. Dumas wyraził opinię, że istnieją dwie chemie, nieorganiczna i organiczna, a Cannizzaro wskazał, że w obu gałęziach stosowane są różne masy atomowe. Ostatecznie zdecydowano, że każdy chemik powinien nadal korzystać z tego, co akurat mu się podoba. Pod koniec konferencji rozdano broszurę napisaną przez S. Cannizzaro, a Lothar Meyer pisze, że po jej przeczytaniu „łuski spadły mi z oczu, wątpliwości zniknęły, a na ich miejsce pojawiło się poczucie spokoju”. broszura napisana po włosku, zatytułowana była: Sunto di un corso di filosofia chimica; pojawiła się drukiem w 1858 roku w Nuovo Cimento i została ponownie opublikowana w 1859 roku w Pizie, i 1880 r. w Rzymie; niemieckie tłumaczenie Lothara Meyera zostało opublikowane w 1891 r. Wyrażone w niej poglądy stanowiły podstawę książki Lothara Meyera Modernen Theorien der Chemie, opublikowanej po raz pierwszy w 1864 r., z której większość chemików czerpała informacje na temat teorii Avogadro i poglądów Cannizzaro.
Stanislao Cannizzaro urodził się w Palermo w 18264 r. Studiował w Palermo, potem w Neapolu, a następnie, w 1850 r., został asystentem M. Piria w Pizie. Jego pierwsze badania, dotyczące chlorku cyjanogenu, przeprowadzone wspólnie z F. S. Cloezem w laboratorium M. E. Chevreula w Paryżu, zostało opublikowane w 1851 r. W 1851 r. został profesorem w Alessandrii, a w 1853 roku opublikował wyniki badań działania potażu na benzaldehyd, w wyniku czego powstaje alkohol benzolowy („reakcja Cannizzaro”). W 1855 r. został profesorem w Genui, gdzie początkowo nie było laboratorium chemicznego. W 1861 r. wyjechał do Palermo, a w 1871 r. do Rzymu, gdzie został senatorem; zmarł w 1910 roku.
Cannizzaro jako pierwszy dostrzegł pełne znaczenie pracy swojego rodaka A. Avogadro. Masę cząsteczkową substancji lotnej można ustalić przez określenie gęstości pary, przy czym stosunek tej drugiej do gęstości substancji standardowej daje stosunek ciężarów cząsteczkowych. Jako standard wybrano wodór, najlżejszy gaz, ale ponieważ cząsteczka wodoru zawiera dwa atomy (jak wynika z rozumowania zastosowanego przez A. Avogadro w 1811 r.), gęstość względem wodoru należy pomnożyć przez dwa, aby uzyskać masę cząsteczkową par związku jako sumę mas atomowych, przy czym te ostatnie odnoszą się do H = 1. Masa atomowa pierwiastka jest wówczas najmniejszą jego masą zawartą w masie cząsteczkowej dowolnego lotnego związku. W przypadku szeregu lotnych związków masy pierwiastka zawartego w masie cząsteczkowej są zawsze pełnymi wielokrotnościami (w tym jednością) liczby, którą należy przyjąć za masę atomową. Tak ustalone ciężary atomowe są zgodne z wynikającymi z prawa rządzącego ciepłem atomowym, dlatego jest ono stosowane w przypadkach, w których gęstości par nie może zostać wyznaczona.
Wielką zasługą Cannizzaro było wykazanie, jak to ujął W. A. Tilden, że: „W rzeczywistości istnieje tylko jedna nauka chemii i jeden zestaw mas atomowych”. Kekulé stwierdził w 1859 r., że „gdy chemiczne masy cząsteczkowe są porównywane z ciężarami właściwymi w par, okazuje się, że te dwie wielkości są równe dla prawie wszystkich związków, i jednocześnie dla wszystkich związków węgla są identyczne”. Ch. F. Gerhardt, choć zdziwiony rzekomymi wyjątkami od swoich formuł pisanych zgodnie z zasadą „dwóch objętości”, nie zaniechał pisania wzorów związków w formie H2SO4, PCl5, NH4Cl itp., ponieważ takie wzory wynikały z dowodów chemicznych. Wyjaśnienie wyjątków wynikających z dysocjacji związków wywołanej temperaturą zostało po raz pierwszy podane przez Cannizzaro w 1857 r.
Jednolita teoria Gerhardta
W latach 1841-2 Gerhardt przedstawił schemat klasyfikacji związków organicznych na podstawie ich wzorów empirycznych, układając je na czymś, co nazywa „drabiną spalania” („échelle de combustion”), z materią zwierzęcą na górze i dwutlenkiem węgla, wodą i amoniakiem u dołu (później przedstawił ten schemat w formie użytecznej).
W swojej Précis de chimie organique (1844-5) Gerhardt przedstawił wzory empiryczne, wskazując, że stosuje się siedem różnych wzorów konstytucyjnych dla alkoholu, „z których każdy jest tylko wyrazem jednej lub dwóch reakcji”. Jak pisze: „autant de réactions, autant de formules rationelles”. Zgrupował związki organiczne w rodziny, z których każda zawiera substancje o tej samej liczbie atomów węgla. W rezultacie kwasy i ich estry pojawiły się w różnych grupach, i nawet A. Laurent sprzeciwiał się temu arbitralnemu systemowi: „system wzorów empirycznych (formules brutes) jest zbyt absolutny, a jeśli zostanie przyjęty, przesłoni mnóstwo interesujących relacji”.
Gerhardt zwrócił uwagę na to, co nazwał serią homologiczną (homologous series) związków, czyli kolejnymi członami różniącymi się wielokrotnością grupy CH2. „Substancje te podlegają reakcji (se metamorfosent) zgodnie z tymi samymi równaniami i wystarczy znać reakcje jednego z nich, aby przewidzieć te jakim podlegają inne.” Stanowi to jeden z uroków chemii organicznej zarówno w teorii, jak i praktyce. Istnienie serii homologicznej alkoholi, zawierającej rodniki nR + H, w której R = C2H2 (C = 6), zostało wskazane przez J. Schiela w 1842 r., a Dumas wykazał, że istnieje podobny związek między kwasami tłuszczowymi, ale Gerhardt uogólnił tę prawidłowość i nadał jej nazwę homologii. W publikacji Gerhardta Introduction à l’étude de la chimie par le système unitaire (Paryż, 1848) znajdujemy: „wszystkie ciała są uważane za unikalne cząsteczki, których atomy są rozmieszczone w kolejności, którą reakcje chemiczne wskazują jedynie w sposób względny. Każde proste lub złożone ciało jest traktowane jako budowla, jako układ utworzony przez zestaw atomów. Ten układ nazywa się cząsteczką danego ciała.” Podobny punkt widzenia wydaje się mieć Berzelius już wiele lat wcześniej. W liście do Wöhlera zauważa on, że „w kwasie benzoesowym jako kwas nie występuje ani benzen, ani benzoil, ani związek łatwopalnego rodnika, w odróżnieniu od reszty związku; raczej zależy to całkowicie od warunków, w jakich ciało ulega rozkładowi na części, na które się rozkłada. Trzeba wiedzieć, na jakie części można go rozłożyć, ale nie można powiedzieć, że składa się z tych części”. Berzelius jednak nie przyjmował ten poglądu konsekwentnie.
August Wilhelm von Hofmann urodził się w Giessen w 1818 roku. Po kilku latach studiowania filozofii i prawa zdecydował się na chemię i został asystentem Liebiga. Po krótkim pobycie w Bonn został powołany w 1845 r. przez księcia Alberta do nowo założonego College of Chemistry w Londynie, który w 1853 r. stał się instytucją rządową. W 1865 r. zastąpił Alexandra Mitscherlicha w Berlinie, gdzie zmarł w 1892 r. Badania Hofmanna obejmowały tak szeroki zakres, że napisanie tekstu o jego dokonaniach dla Chemical Society zlecono kilku chemikom. Był świetnym wykładowcą, a jego pobyt w Londynie miał bardzo korzystny wpływ na angielską chemię.
Idea Dumasa, że właściwości związku są określane głównie przez jego rodzaj, a właściwości elektrochemiczne atomów nie mają większego znaczenia, został w pewien sposób zmodyfikowany w wyniku prac Hofmanna nad chlorowymi i bromowymi pochodnymi aniliny (1845). Te pochodne, choć wykazywały właściwości zasadowe, to jednak w mniejszym stopniu niż anilina co wynikało z elektroujemności lub kwasowości podstawników halogenowych. Nawet Gerhardt był zmuszony uznać, że chociaż zarówno kwas azotowy, jak i potaż należą do tego samego typu co obojętna woda, to pierwszy zawiera elektroujemny rodnik, NO2, nadający mu właściwości kwasowe, podczas gdy drugi zawiera elektrododatni atom potasu, nadający mu odczyn zasadowy. Rodnik etylowy, C2H5, jest na tyle pokrewny wodorowi, że cząsteczka alkoholu jest praktycznie obojętna. W ten sposób nie tylko masy atomowe Berzeliusa, ale nawet części jego układu elektrochemicznego zostały przyjęte przez jednego z jego głównych przeciwników.
W 1849 r. Ch. A. Wurtz przypadkowo uzyskał metyloaminę i etyloaminę w wyniku działania alkaliów na estry cyjanowe i cyjanurowe i stwierdził, że można je przedstawić jako „amoniak, w którym jeden równoważnik wodoru zastąpiono metylem lub etylem”, NH2Me i NH2Et. Możliwość istnienia takich związków, zawierających rodnik amidowy, NH2 = Ad, zostało przewidziane około dziesięć lat wcześniej przez Liebiga. W 1850 r. Hofmann wykazał, że działając jodkiem etylu na amoniak, wszystkie atomy wodoru tego drugiego można kolejno zastąpić etylem, tworząc trzy aminy, które zaprezentował w następujący sposób:
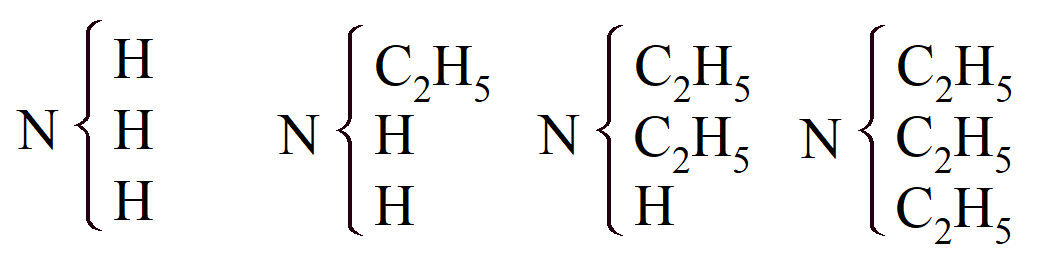
Zostały one nazwane pierwszorzędowymi, drugorzędowymi i trzeciorzędowymi aminami przez Gerhardta w czwartym tomie jego Traité, a Berzelius określił organiczne zasady jako amoniak sparowany z węglowodorami, np. aniliną jako NH3 + C12H8 = an Ak, ale określając je tak jak Hofmann stworzył kolejny rodzaj nazwany Typem Amoniaku. Poprawność wzorów ustalono przez otrzymanie etyloaniliny i dietyloaniliny z aniliny i bromku etylu oraz etyloamyloaniliny z etyloaniliny i bromku amylu:
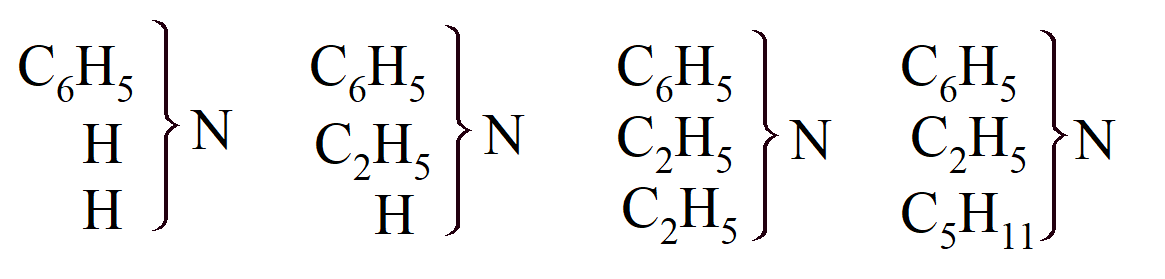
Wszystkie substancje były zasadowe, tworząc chlorowodorki, które w połączeniu z chlorkiem platyny tworzyły podwójne związki w taki sam sposób jak chlorek amonu. W 1855 roku Hofmann i A. A. T. Cahours otrzymali podobne związki wychodząc z fosfiny, PH3. Stwierdzono, że trzeciorzędowa etyloamina łączy się z cząsteczką jodku etylu, tworząc sól, N(C2H5)4I, analogiczną do jodku amonu, z której otrzymano silną zasadę N(C2H5)4OH w wyniku reakcji z wilgotnym tlenkiem srebra. Otrzymano też odpowiednie sole fosfoniowe i jodek fosfoniowy (PH4I).
W 1846 roku Laurent przedstawiał alkohol i eter jako analogi wody, wodorotlenku potasu i tlenku potasu: OHH, OEtH, OEtEt, OHK, OKK, a idea „typu wody” została rozszerzona przez A. W. Williamsona. Alexander William Williamson urodził się w Windsworth w 1824 r. Studiował w Heidelbergu, a w latach 1844 - 1846 u Liebiga w Giessen. Po okresie studiów w Paryżu zastąpił G. Fownesa w 1849 r. na stanowisku profesora chemii analitycznej na University College w Londynie; w 1855 r. objął stanowisko T. Grahama jako profesor chemii ogólnej. Zmarł w 1904 roku. Najważniejszą publikacją Williamsona było: On the formulae of alcohol and ether and of related compounds, w której wzory związków zapisane zostały w postaci (C = 6; C = 12):
|
|
Dumas |
Berzelius |
Liebig |
|
alkohol |
C8H8·H4O2 |
C2H6O |
C4H10O·H2O |
|
eter |
C8H8·H2O |
C4H10O |
C4H10O |
Około 1850 r. wzory Berzeliusa zostały zastąpione wzorami Liebiga, który uważał alkohol za hydrat eteru, ale Williamson wykazał, że formuła alkoholu Liebiga jest nieprawidłowa. W ten sposób dostarczył eksperymentalny dowód na pogląd Gerhardta, że cząsteczki alkoholu i eteru zajmują równe objętości w stanie pary, każda zgodnie z zasadą „dwóch objętości”, podczas gdy eter zgodnie ze wzorami Dumasa i Liebiga ma dwie, a alkohol cztery objętości. Williamson zaczął od pomysłu zastąpienia wodoru w znanych alkoholach rodnikami węglowodorowymi, w celu otrzymania wyższych alkoholi. W wyniku działania jodku etylu na etylan potasu, powstający w wyniku działania potasu na alkohol, spodziewał się, że otrzyma alkohol z dodatkowym etylem, ale: „ku mojemu zdziwieniu tak utworzony związek nie miał żadnych właściwości alkoholu, był niczym innym jak tylko zwykłym eterem.” W związku z tym eter musi zawierać dwa rodniki etylowe. Zapis reakcji został przez niego podany w następujący sposób:
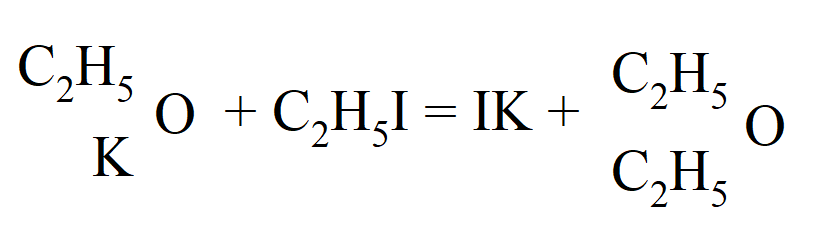
Zatem alkohol to woda, w której jeden z atomów wodoru został zastąpiony rodnikiem, a eter to woda, w której obydwa wodory zostały zastąpione, czyli:
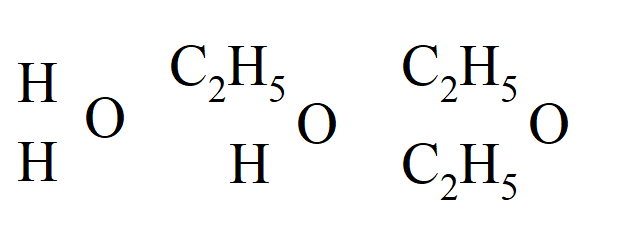
O tym, że alkohol i eter należą do typu wody, udowodniono wytwarzając mieszany eter, zawierający dwa różne rodniki węglowodorowe, z metanolanu potasu i jodku etylu. Proces powstawania eteru (wcześniej uważany za katalityczny) został teraz wyjaśniony przez naprzemienne tworzenie kwasu sulfonowego i jego rozkład przez alkohol:
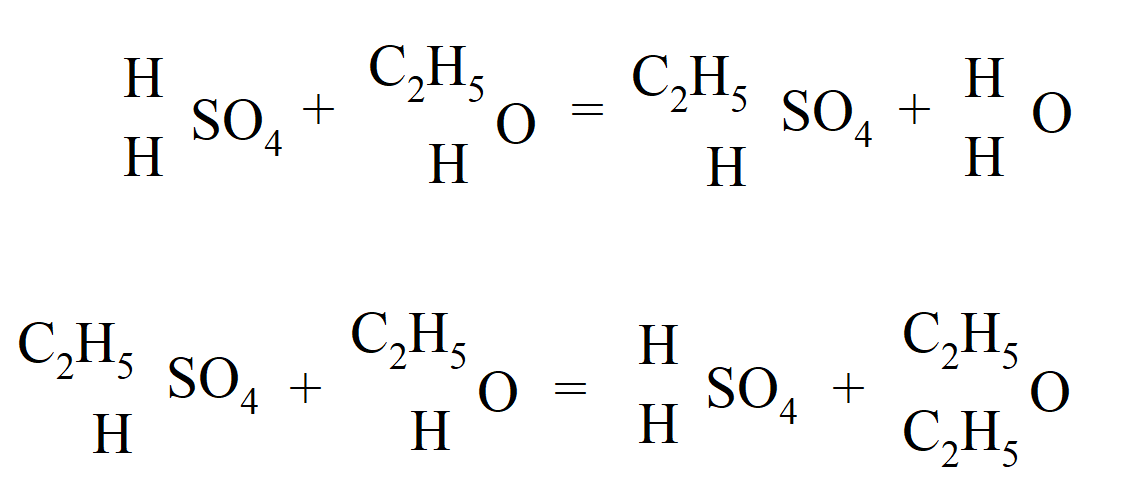
To pozwoliło na wyjaśnienie powstawania mieszanych eterów. „Naprzemienne tworzenie i rozkład kwasu sulfonowego jest dla mnie, podobnie jak i zwolenników teorii chemicznej, kluczem do wyjaśnienia procesu eteryfikacji”. Williamson wykazał, że teoria Liebiga, że alkohol jest hydratem eteru, oraz teoria Mitscherlicha, że działanie kwasu siarkowego w tworzeniu eteru ma jedynie charakter katalityczny, jest niepoprawna. Uznał również, że kwas octowy należy do typu wody, a rodnik C2H3O, otyl (obecnie nazywanego acetylem), zastępuje wodór w cząsteczce wody. „Wierzę, że w całej chemii nieorganicznej i dla najbardziej znanych związków organicznych wystarczy jeden prosty typ; to woda.” „Gdyby dwa atomy wodoru w wodzie zostały zastąpione przez. . . otyl powinniśmy mieć bezwodny kwas octowy.” Gerhardt, który z początku uważał, że bezwodniki kwasów jednozasadowych nie mogą istnieć (ponieważ cząsteczka kwasu nie może zawierać cząsteczki wody), pomimo otrzymania bezwodnika kwasu azotowego(V) przez H. E. Deville'a w 1849, otrzymał w 1852 r. związek już przewidziany przez Williamsona, a mianowicie. bezwodnik octowy przez działanie chlorku acetylu (odkrytego przez Gerhardta w 1852 r.) na bezwodny octan sodu:
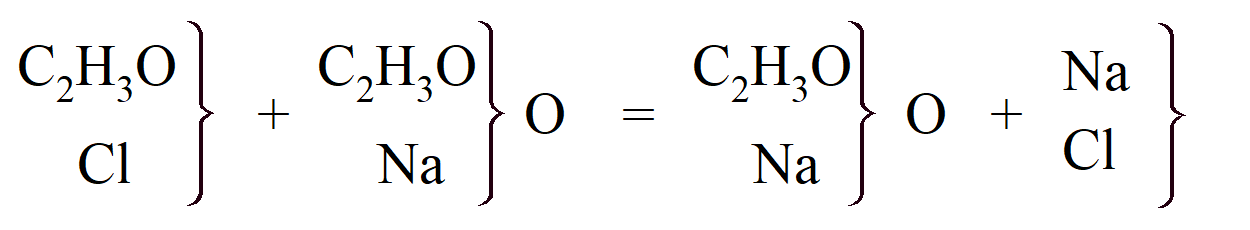
A ponieważ inne bezwodniki można podobnie otrzymać, te badania Gerhardta zostały uznane przez chemików za niezwykle istotne. Williamson wyprowadził kwasy dwuzasadowe z dwóch cząsteczek wody; na przykład kwas siarkowy z 2H2O, w którym 2H zastępuje rodnik sulfurylowy, SO2; i kwas węglowy z 2H2O, w którym rodnik CO zastępuje 2H. Napisał: „1 atom tlenku węgla jest tutaj równoważny 2 atomom wodoru, a poprzez ich zastąpienie pozostają razem 2 atomy hydratu (OH), w którym były zawarte”. Wykazał, że oprócz chlorku sulfurylu, związek pośredni, kwas chlorosulfonowy („chlorowodorowany kwas siarkowy”), powstaje w wyniku działania PCl5 na kwas siarkowy(VI):
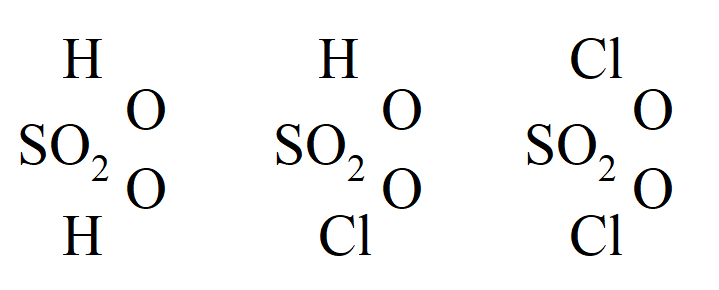
w którym następuje zastąpienie OH przez Cl.
W 1852 r. Williamson podał prawidłowe wzory acetonu i aldehydu: aldehyd jest „hydruretem otylelu, ponieważ aceton jest jego związkiem metylowym”:
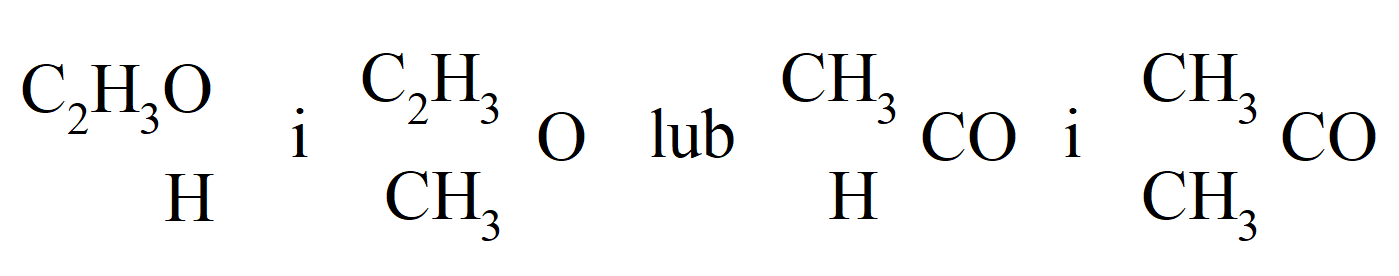
Odling w 1854 r. rozszerzył koncepcję wielu typów i wprowadził kreski przy symbolu, np. SO2’’, Bi’’’ wskazujące ile atomów wodoru może zastąpić dany atom lub rodnik. W 1857 r. Kekulé i Odling wprowadzili typy mieszane do których należy na przykład tiosiarczan sodowy, który należy do mieszanego typu pochodzącego od wody i siarkowodoru.
W swoim tekście z 1853 r. dotyczącym bezwodników kwasów organicznych Gerhardt sformułował cztery typy nieorganiczne, z których, jak sądził, można uzyskać wszystkie związki organiczne. Te typy były „używane do reprezentowania podwójnego rozkładu” i zajmowały równe objętości (2 objętości, H2) w stanie pary. Nie reprezentowały pozycji atomów w cząsteczkach, które Gerhardt wydaje się uważać za niemożliwe do identyfikacji na drodze eksperymentalnej. „Wyprowadzając substancję z rodzaju wody, zamierzam wyrazić przez to, że substancja ta jest uważana za tlenek, odpowiada chlorkom, bromkom, siarczkom, azotkom itp., jest podatnym na podwójny rozkład lub jest jego produktem, analogiczne do tych substancji prezentowanych przez kwas chlorowodorowy, kwas bromowodorowy, siarkowodór, amoniak itp., lub które powstają z tych samych związków. Typ jest zatem jednostką porównawczą dla wszystkich substancji, które podobnie jak one, są podatne na podobne przemiany lub powstają w wyniku podobnych przemian.” Te cztery rodzaje, lub typy, to woda, kwas solny, amoniak i wodór. Ich cząsteczki i ich pochodne były postrzegane jako kompletne jednostki, a cały układ został nazywany „système unitaire”:
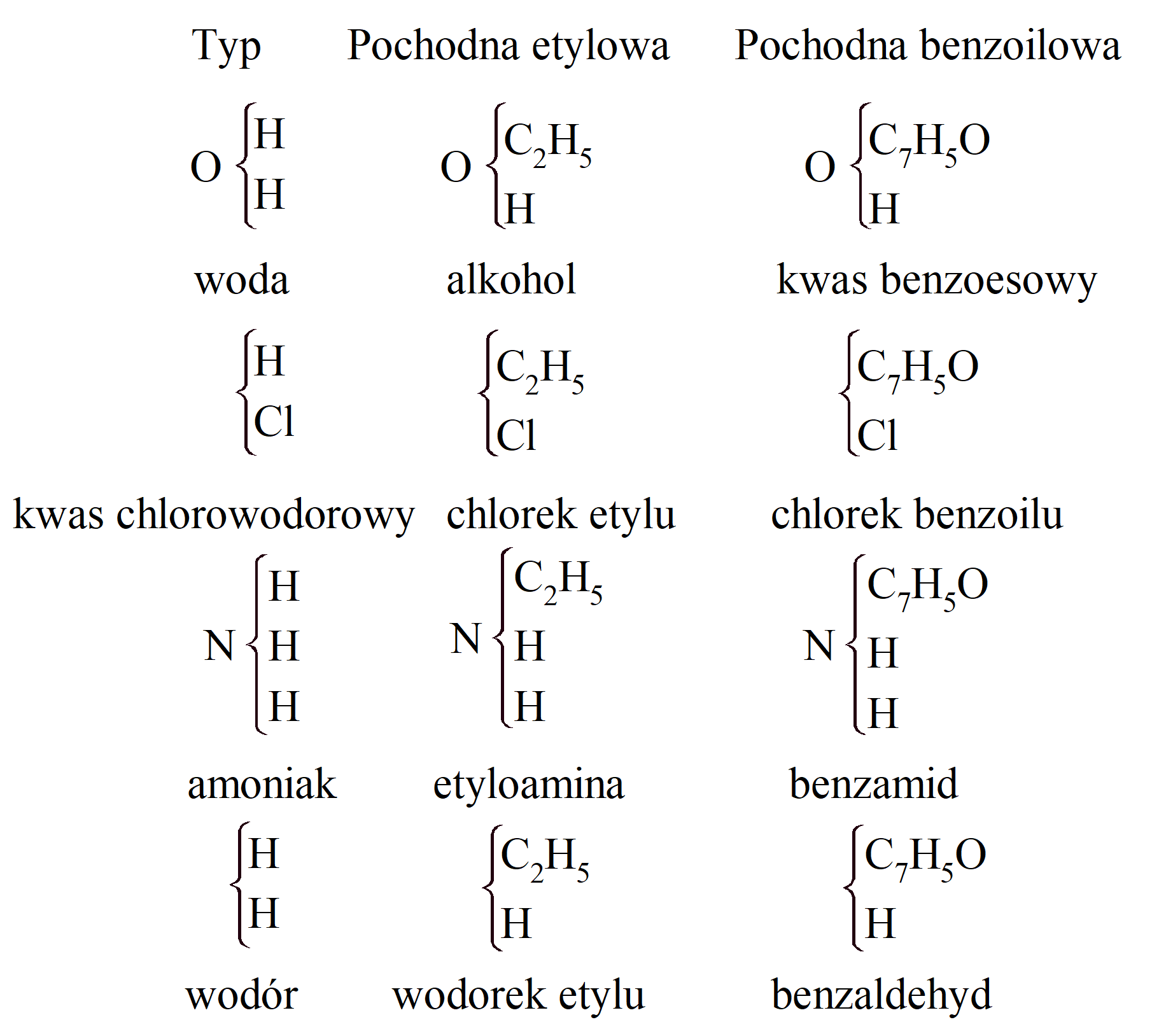
Siarczki, tellurki, tlenki, kwasy, zasady, sole, alkohole, etery itp. należą do typu wody; chlorki, bromki, jodki, cyjanki i fluorki do typu kwasu chlorowodorowego (Gerhardt nie widzi, że tak naprawdę należą do typu wodoru); azotki, fosforki, arsenki itp. należą do rodzaju amoniaku; wodorki metali, węglowodory i metale do typu wodoru. Bardziej skomplikowane związki powstają przez podstawienie wodoru rodnikami w tych typach. Ten schemat klasyfikacji pozwala przewidzieć dużą liczbę nieznanych związków.
Gerhardt rozróżniał rodniki wodoru i chloru, H i Cl oraz wolny wodór i chlor, H2 i Cl2. Wiele tak zwanych reakcji addycji, pisze, jest naprawdę podwójnym rozkładem:
HH + ClCl → HCl + HCl;
ale uogólnienie to zostało przeprowadzone zbyt daleko, np. w równaniach:
ZnZn + ClH → ZnH + ZnCl;
ZnH + ClH → ZnCl + HH.
(masa Zn była połową współczesnej masy atomowej).
Ważnym krokiem było połączenie teorii typów i teorii rodników. Kwasy tłuszczowe można uznać za pochodzące z rodzaju wody przez zastąpienie wodoru rodnikami:
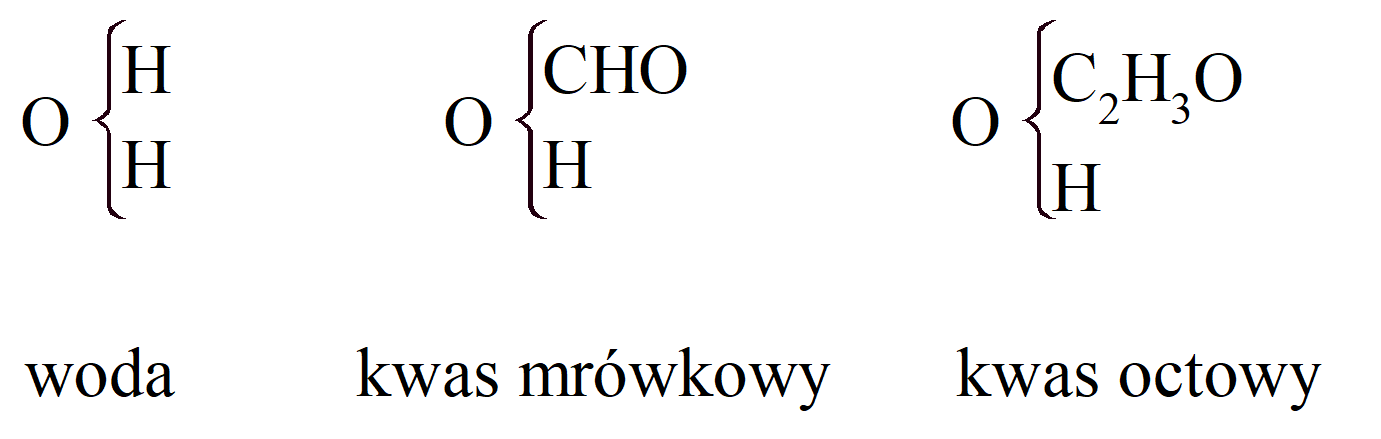
Gerhardt nazywa te rodniki monoatomowymi, diatomowymi itp., zgodnie z tym zastępują one 1, 2 lub więcej atomów wodoru. Ale rodniki kwasu monoatomowego, CnH2n_1O, same mogą być uważane za złożone z rodnika karbonylowego, CO, połączonego z wodorem w kwasie mrówkowym i z rodnikiem węglowodorowym, CnH2n+1, w wyższych kwasach tłuszczowych. Zatem acetyl, C2H3O, można uznać za karbonyl połączony z metylem: CO + CH3. Potwierdza to tworzenie metanu podczas ogrzewania octanu z zasadą. Octan potasu, jak wykazał Kolbe, podczas elektrolizy daje dwutlenek węgla, wodór i „metyl” (naprawdę etan, C2H6). Kwas octowy to nie tylko:
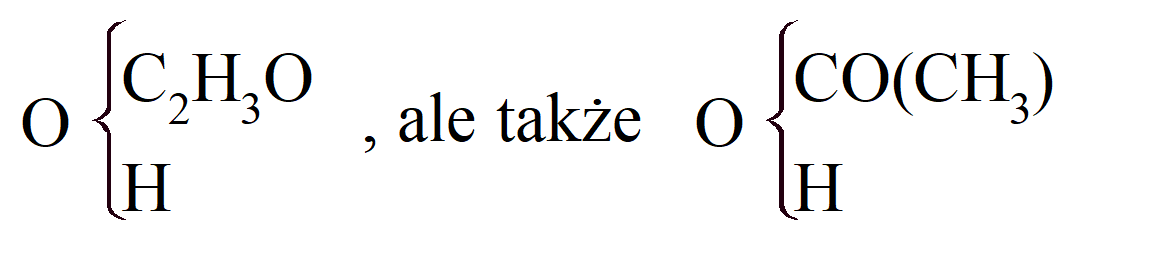
w którym grupa acetylowa, C2H3O, jest tym, co Gerhardt nazywa sprzężonym rodnikiem, tj. złożonym z dwóch lub więcej rodników, „z których każdy przypomina jeden szczególny typ podwójnego rozkładu”. Ta sama idea została zastosowana do nitrozwiązków.
