Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Reakcje przegrupowania
Reakcje przegrupowania
W reakcji przegrupowania grupa przemieszcza się od jednego atomu do drugiego w tej samej cząsteczce. Większość z tych procesów polega na migracji od atomu do atomu sąsiedniego (przegrupowanie 1,2), ale w niektórych przypadkach proces zachodzi na większych odległościach.
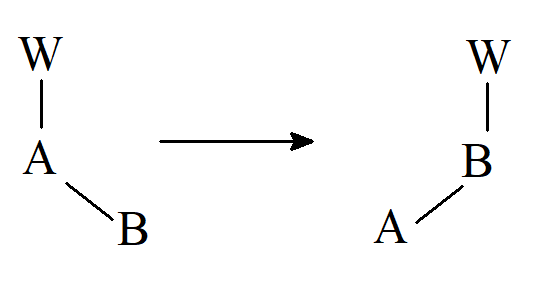
Grupa migrująca (W) może przemieszczać się wraz ze swoją parą elektronów (przegrupowania nukleofilowe lub anionotropowe; grupę migrującą można uznać za nukleofil), bez swojej pary elektronów (przegrupowania elektrofilowe lub kationotropowe; przegrupowania prototropowe) lub tylko z jednym elektronem (przegrupowania rodnikowe). Przegrupowania nukleofilowe 1,2 są częstsze niż elektrofilowe lub rodnikowe. Wyjaśnieniem tego stanu można znaleźć rozważając stany przejściowe (lub w niektórych przypadkach półprodukty).
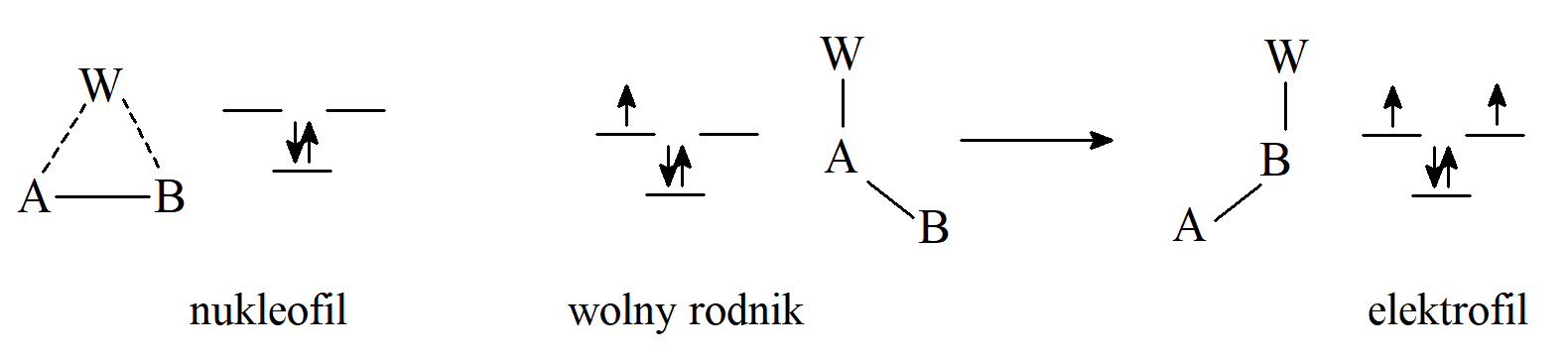
Na schemacie przedstawiono stan przejściowy dla wszystkich trzech przypadków jako pierwszy układ po lewej stronie, w którym dwuelektronowe wiązanie A–W obejmuje orbital na atomie B, który zawiera zero, jeden i dwa elektrony, odpowiednio w przypadku nukleofilowej, rodnikowej i elektrofilowej migracji. Nakładanie się tych orbitali skutkuje powstaniem trzech nowych orbitali, jednego wiążącego i dwóch, zdegenrowany orbitali antywiążących. W przypadku przegrupowania nukleofilowego, które angażuje tylko dwa elektrony, mogą one znaleźć się na orbitalu wiążącym, i stan przejściowy ma niską energię. Natomiast przy migracji wolnorodnikowej lub elektrofilowej zaangażowane są odpowiednio trzy lub cztery elektrony, które muszą znaleźć się na orbitalach antywiążących. Zatem w procesach przegrupowania 1,2 elektrofilowego lub wolnorodnikowego migrującą grupą W jest zwykle aryl lub inna grupa, która może przyjąć dodatkowy jeden lub dwa elektrony, a tym samym skutecznie usunąć je z trójczłonowego stanu przejściowego.
Przy każdym przegrupowaniu możemy zasadniczo rozróżnić dwa możliwe sposoby reakcji: w jednym z nich grupa W zostaje całkowicie odłączona od A i może znaleźć się przy atomie B innej cząsteczki (przegrupowanie międzycząsteczkowe); w drugim W przechodzi z A do B w obrębie tej samej cząsteczki (przegrupowanie wewnątrzcząsteczkowe), w którym to przypadku musi istnieć oddziaływanie utrzymujące W połączone z układem A–B, uniemożliwiając jego całkowite uwolnienie. Ściśle mówiąc, tylko typ wewnątrzcząsteczkowy pasuje do definicji przegrupowania, ale ogólna praktyka, którą się stosuje, polega na określaniu terminem „przegrupowanie” wszystkich tego typu procesów, niezależnie od tego, czy są one wewnątrzcząsteczkowe, czy międzycząsteczkowe. Zwykle nie jest trudno stwierdzić, czy dane przegrupowanie jest między- czy wewnątrzcząsteczkowe. Najpopularniejsza metoda polega na zastosowaniu eksperymentów krzyżowych. W tego typu doświadczeniu przegrupowanie przeprowadza się na mieszaninie W– A– B i V–A–C, gdzie V jest analogiem W (metyl vs. etyl), a B analogiem C. W procesie wewnątrzcząsteczkowym odzyskiwane są tylko produkty typu A–B–W i A–C–V, ale jeśli reakcja jest międzycząsteczkowa to powstają również A–B–V i A–C–W.
Mechanizm przegrupowania nukleofilowego
W tym procesie następuje przeniesienie grupy migrującej wraz z parą elektronową, a w związku z tym atom docelowy musi posiadać sekstet elektronowy na powłoce walencyjnej. Pierwszym krokiem w tego typu mechanizmie jest więc powstanie układu (atomu) zawierającego sześć elektronów walencyjnych. Powstawanie tego rodzaju centrów może odbywać się na różne sposoby, ale dwa z nich odgrywają istotną rolę.
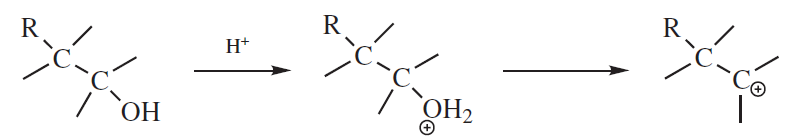
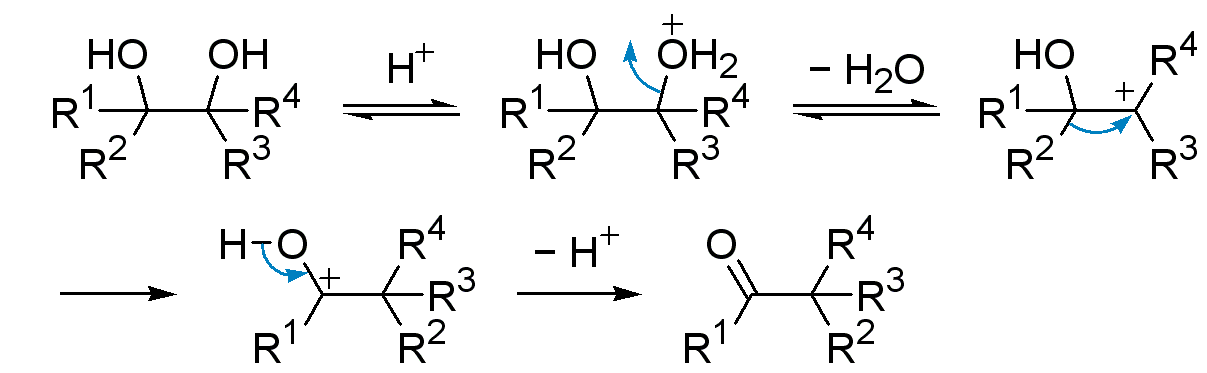
– Tworzenie karbokationu – można je otrzymywać na wiele sposobów, ale jedną z najczęstszych metod, gdy oczekiwane jest przegrupowanie, jest traktowanie alkoholu kwasem w celu uzyskania karbokationu z pośredniego jonu oksoniowego. Te dwa etapy są takie same, jak pierwsze dwa etapy reakcji SN1cA lub E1 w przypadku alkoholi.
– Tworzenie nitrenów – rozkład azydków acylowych jest jednym ze sposobów tworzenia acylonitrenów. Po migracji atom od którego został przemieszczony podstawnik ma sekstet elektronowy. W kolejnym kroku atom ten uzyskuje oktet elektronowy. W przypadku karbokationów najczęściej występującymi etapami kończącymi są reakcja z nukleofilem (przegrupowanie z podstawieniem) i utratą H+ (przegrupowanie z eliminacją).
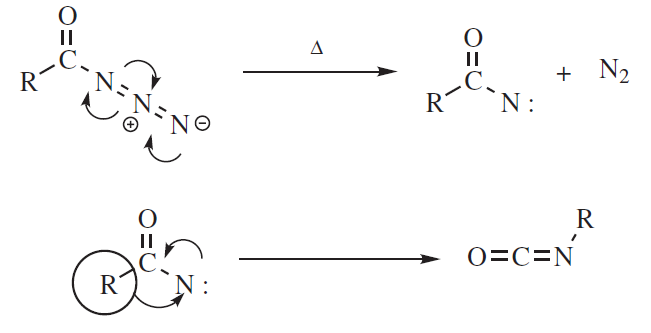
Większość przegrupowań nukleofilowych 1,2 jest wewnątrzcząsteczkowych.
Przegrupowanie rodnikowe
Przegrupowania rodnikowe 1,2 są znacznie mniej powszechne niż nukleofilowe, ale jeśli występują to ogólny schemat jest taki sam. Najpierw musi nastąpić wytworzenie wolnego rodnika, a następnie faktyczna migracja, w której migrująca grupa porusza się z jednym elektronem:

Powstały nowy wolny rodnik bierze udział w kolejnej reakcji, która stabilizuje układ.
Przegrupowanie elektrofilowe
Ten rodzaj przegrupowania jest bardzo rzadki. W pierwszym etapie tworzony jest karboanion, lub inny jon ujemny, a rzeczywisty etap przegrupowania obejmuje migrację podstawnika bez elektronów wiązania.

Produkt przegrupowania może ulegać dalszym reakcjom ale zależy to od jego natury.
Przykłady reakcji przegrupowania
Przegrupowanie Beckmana – przegrupowanie oksymów do amidów katalizowane przez kwasy. Cykliczne oksymy przegrupowują do laktamów. W wyniku działania protonu H+ na cząsteczkę oksymu, powstaje jon oksoniowy, a grupa R' znajdująca się w położeniu trans (anti) wobec grupy hydroksylowej -OH migruje do atomu azotu tworząc związek przejściowy, który poprzez odłączenie i ponowne przyłączenie cząsteczki wody przechodzi w formę enolową amidu. Katalizatory tej reakcji poprzez przyłączenie się do grupy -OH przekształcają ją w grupę odchodzącą. Migracji do azotu ulega zawsze grupa znajdująca się w położeniu trans względem grupy –OH.
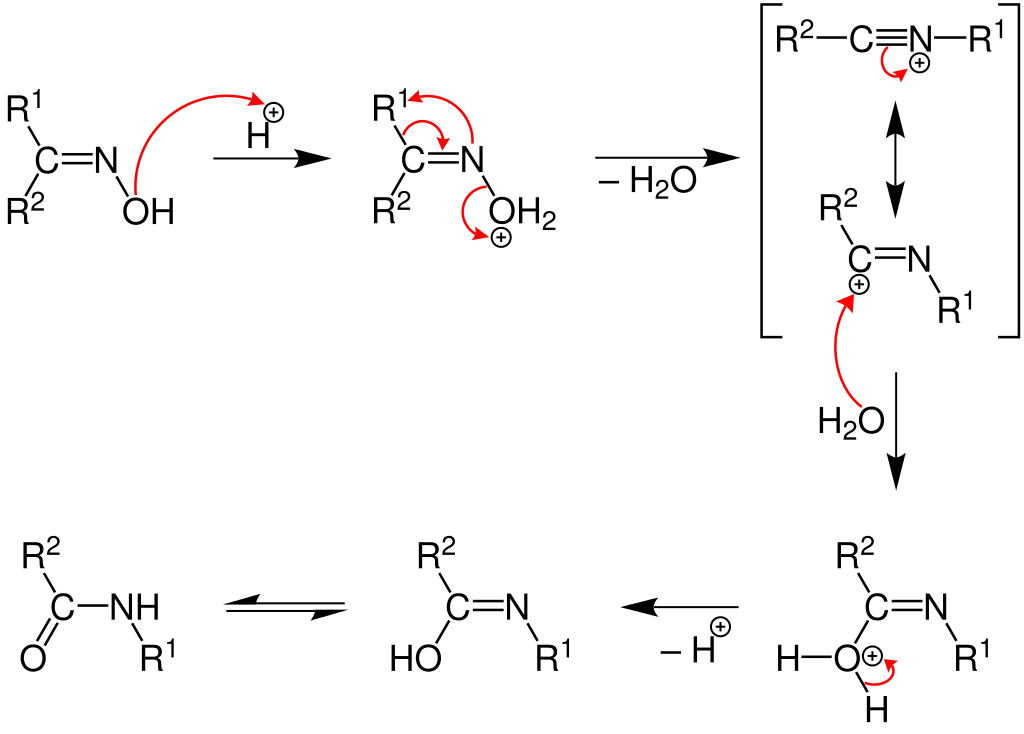
Przegrupowanie Curtiusa – reakcja, w której azydki acylowe ulegają przegrupowaniu do izocyjanianów.

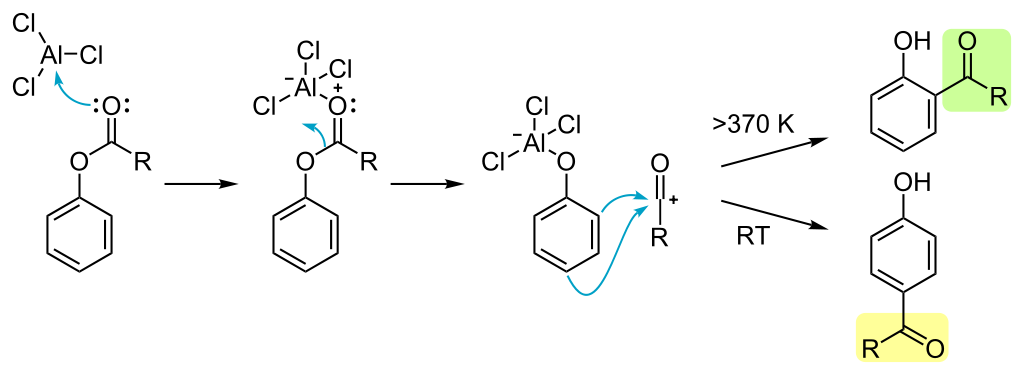
Przegrupowanie Friesa – reakcja, której ulegają estry fenoli podczas ogrzewania w obecności kwasu Lewisa, prowadząca do otrzymania fenolo-ketonów.
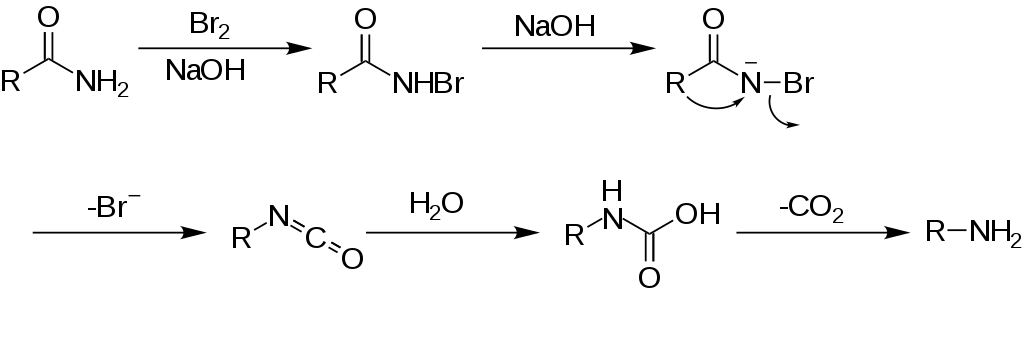
Przegrupowanie Hofmanna – reakcja, w której pierwszorzędowe amidy ulegają przekształceniu do pierwszorzędowych amin o łańcuchu węglowym krótszym o jeden atom węgla.
Przegrupowanie Nebera – reakcja, w której oksymy przekształcają się w α-aminoketony pod wpływem działania chlorku tosylu

Przegrupowanie pinakolowe – reakcja, podczas której 1,2-diole przekształcają się w aldehydy lub ketony o takiej samej liczbie atomów węgla.
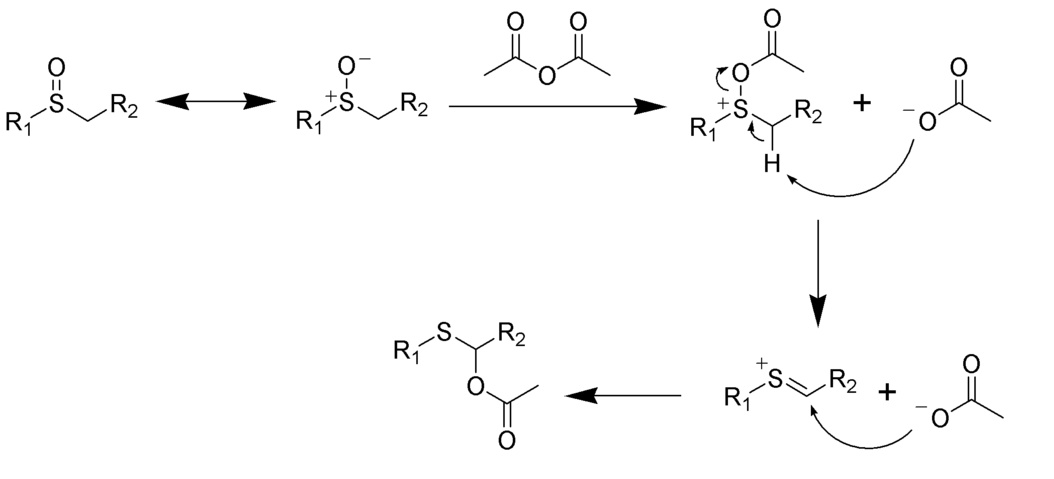
Przegrupowanie Pummerera – reakcja, w której sulfotlenek alkilu w obecności bezwodnika octowego ulega przegrupowaniu do α-acyloksy-tioeteru.