 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
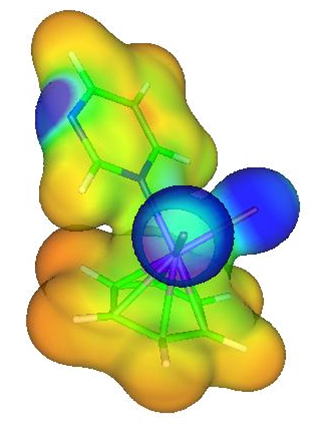 Arenowe związki koordynacyjne
Arenowe związki koordynacyjne
Rozpatrzmy związek koordynacyjny metalu, w którym ligandem jest związek charakteryzujący się sprzężonym układem wiązań π, czyli arenowy związek koordynacyjny. Najczęściej przytaczanym przykładem (ze względu na prostotę i poglądowość) są związki metali z cyklopentadienem będącym ligandem. Weźmy pod uwagę pierścień cyklopentadienylowy i wzajemny rozkład orbitali p atomów węgla dla anionu cyklopentadienylowego.
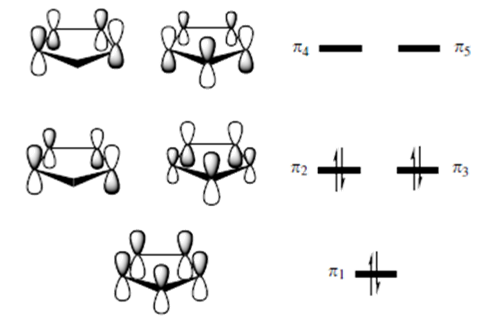 Z pięciu orbitali π przedstawionych na schemacie, trzy są obsadzone, w związku z czym ligand cyklopentadienylowy możemy traktować jako trójfunkcyjny. Na początek przyjrzyjmy się cyklopedianenylowemu związkowi koordynacyjnemu żelaza czyli ferocenowi (Cp2Fe), w którym ligandy Cp są równoległe względem siebie. Obsadzone orbitale π dwóch ligandów Cp dają w wyniku kombinacji sześć obsadzonych orbitali cząsteczkowych zdelokalizowanych na obydwu ligandach Cp. Jak łatwo zauważyć, ze względu na symetrię orbital π1(+) może tworzyć kombinację z orbitalem s atomu centralnego, a π1(-) z orbitalem pz. Kolejne orbitale, tworzące poziom e1, mają symetrię zgodną z orbitalami py (π2(+)) i px (π3(+)), a π2(-) i π3(-) z dyz oraz dxz. Tym sposobem powstaje sześć wiążących orbitali cząsteczkowych, charakteryzujących sześć wiązań w cząsteczce związku o geometrii oktaedrycznej, jak przedstawiono to na poniższym schemacie:
Z pięciu orbitali π przedstawionych na schemacie, trzy są obsadzone, w związku z czym ligand cyklopentadienylowy możemy traktować jako trójfunkcyjny. Na początek przyjrzyjmy się cyklopedianenylowemu związkowi koordynacyjnemu żelaza czyli ferocenowi (Cp2Fe), w którym ligandy Cp są równoległe względem siebie. Obsadzone orbitale π dwóch ligandów Cp dają w wyniku kombinacji sześć obsadzonych orbitali cząsteczkowych zdelokalizowanych na obydwu ligandach Cp. Jak łatwo zauważyć, ze względu na symetrię orbital π1(+) może tworzyć kombinację z orbitalem s atomu centralnego, a π1(-) z orbitalem pz. Kolejne orbitale, tworzące poziom e1, mają symetrię zgodną z orbitalami py (π2(+)) i px (π3(+)), a π2(-) i π3(-) z dyz oraz dxz. Tym sposobem powstaje sześć wiążących orbitali cząsteczkowych, charakteryzujących sześć wiązań w cząsteczce związku o geometrii oktaedrycznej, jak przedstawiono to na poniższym schemacie:
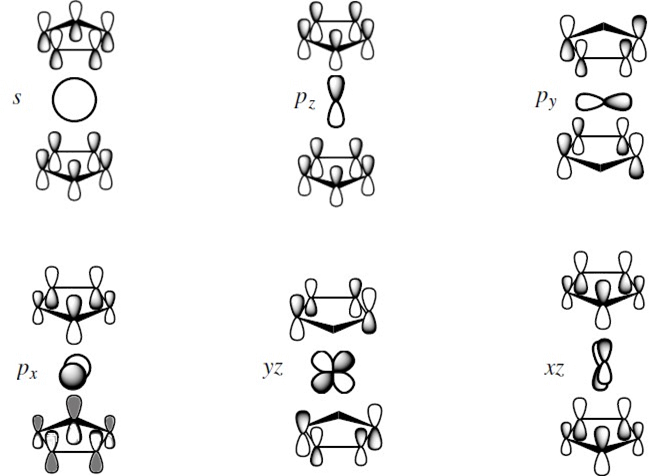 Trzy pozostałe orbitale d atomu centralnego czyli dxy, dx2-y2 oraz dz2 to niewiążące orbitale cząsteczkowe, przy czym orbitale dxy i dx2-y2 przez oddziaływanie z poziomem e2 (π4 i π5) cyklopentadienu uzyskują niższą energię niż orbital dz2; tym samym ulega zmianie degeneracja poziomu t2g oktaedru.
Trzy pozostałe orbitale d atomu centralnego czyli dxy, dx2-y2 oraz dz2 to niewiążące orbitale cząsteczkowe, przy czym orbitale dxy i dx2-y2 przez oddziaływanie z poziomem e2 (π4 i π5) cyklopentadienu uzyskują niższą energię niż orbital dz2; tym samym ulega zmianie degeneracja poziomu t2g oktaedru.
Jednak nie wszystkie cyklopentadienylowe związki koordynacyjne mają równoległe ustawienie pierścieni Cp. W przypadku związków koordynacyjnych typu Cp2MLn (gdzie n = 1, 3), ligandy Cp są ustawione kątowo w stosunku do siebie. Dodatkowo jeżeli ligand Cp jest trójkoordynacyjny to liczba koordynacyjna jonu centralnego wynosi 7 lub 9, w zależności od liczby ligandów L. Obniżenie symetrii z oktaedrycznej do C2v powoduje, że orbitale dx2-y2 i dz2 uzyskują symetrię typu a1, a orbital dxy b2. Orbital o symetrii b2 jest destabilizowany ze względu na słabsze oddziaływanie z pustymi orbitalami π cyklopentadienu. Podobnej destabilizacji należy oczekiwać dla orbitalu a1 (dx2-y2) ale ze względu na symetrię może on oddziaływać z orbitalem dz2 (2a1), którego energia ulega znacznemu podwyższeniu. Jednocześnie wzajemne oddziaływanie tych orbitali powoduje polaryzację orbitalu dx2-y2 wzdłuż osi x, a orbitalu dz2 w płaszczyźnie xy.
 Energia orbitali d atomu centralnego w związkach koordynacyjnych o liniowym i kątowym ułożeniu ligandów cyklopentadienylowych.
Energia orbitali d atomu centralnego w związkach koordynacyjnych o liniowym i kątowym ułożeniu ligandów cyklopentadienylowych.