 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Polimery nieorganiczne
Polimery nieorganiczne
Zdefiniowanie pojęcia zawartego w tytule rozdziału nie jest proste tak jak w przypadku związków opartych na węglu. W przypadku polimerów organicznych mamy do czynienia z łańcuchowym układem bardzo często opartym o łączniki węglowodorowe. W przypadku nieorganicznych polimerów oczekujemy jednostki (meru) nieorganicznej powtarzającej się regularnie w strukturze związku. Niektóre definicje polimeru nieorganicznego ograniczają się do makrocząsteczek nie zawierających w swoim szkielecie atomów węgla. Taka definicja wyklucza z obszaru zainteresowań większość związków koordynacyjnych i wszystkie metaloorganiczne układy polimeryczne, w których atomy metalu stabilizują polimeryczną strukturę szkieletu związku. Z tego powodu często stosuje się pojęcie polimerów nieorganicznych i metaloorganicznych do jednoczesnego opisu obydwu typów związków. Można napotkać definicję polimeru nieorganicznego ograniczającą tę klasę związków do polimerów liniowych zawierających w składzie dwa różne, powtarzające się mery. Ta definicja obejmuje związki koordynacyjne i metaloorganiczne ale jednocześnie zalicza do polimerów nieorganicznych poliestry i poliamidy wykluczając polikrzemiany oraz elementarną siarkę, która przecież też tworzy układy polimeryczne. Inne definicje zaliczają do polimerów nieorganicznych diament, grafit, krzemionkę, szkła nieorganiczne, a nawet beton. W takim ujęciu układy ceramiczne oraz sole jonowe też należy zaliczyć do polimerów. Aby uniknąć kontrowersji zaproponowano ograniczenie tej definicji, zgodnie z którym polimery nieorganiczne muszą odzyskiwać swoją strukturę po przemianach fizycznych takich jak topnienie czy rozpuszczanie. To prowadzi do wykluczenia z obszaru polimerów nieorganicznych soli jonowych oraz krzemionki i szkieł tlenkowych. Na potrzeby poniższego tekstu zdefiniujmy polimer nieorganiczny jako układ, w którym występuje powtarzający się atom metalu lub półmetalu (metaloidu) w łańcuchu. Dodatkowo należy jeszcze rozgraniczyć pojęcia polimeru i oligomeru. Granica pomiędzy jednym a drugim nie jest ściśle określona. Pojęcie oligomeru, wprowadzone po raz pierwszy w roku 1930, ograniczało łańcuch związku od trzech do sześciu merów. Bardzo często w przypadku związków nieorganicznych czy metaloorganicznych spotyka się określenie polimer dla układów zawierających trzy lub cztery jednostki strukturalne (zwłaszcza dotyczy to roztworów). Wydaje się, że takie układy są raczej oligomerami niż typowymi polimerami. Stopień polimeryzacji czyli ilość merów tworzących układ polimeryczny stanowi kryterium pozwalające odgraniczyć oligomer od polimeru, jednak nie ma ustalonej wartości odgraniczającej jeden rodzaj układu od drugiego.
Jednym ze sposobów klasyfikacji polimerów nieorganicznych jest metoda polegająca na określeniu liczby atomów połączonych z danym atomem 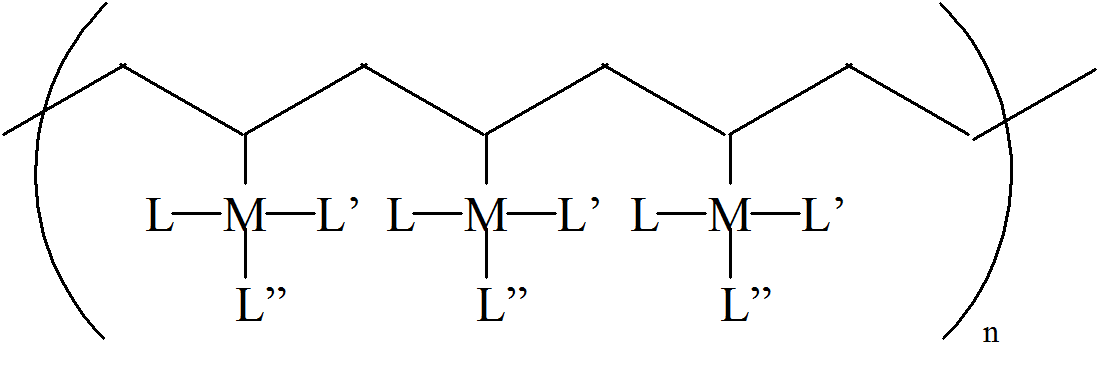 będącym częścią łańcucha lub matrycy polimeru. Wartość tej liczby zawiera się w granicach od 1 dla atomu w końcowej lub funkcyjnej grupie stanowiącej składnik łańcucha do 8, 10 w przypadku niektórych polimerów koordynacyjnych. Opierając się na tak zdefiniowanym parametrze łączliwości (connectivity) polimeru możemy stwierdzić, że liniowe układy, w których atom metalu jest połączony z jednowymiarowym łańcuchem polimerowym posiadają wartość parametru łączliwości równą 1. Metal poza koordynacją do łańcucha polimerowego posiada jeszcze inne ligandy, które jeżeli nie łączą się z matrycą polimerową nie wpływają na wartość parametru łączliwości.
będącym częścią łańcucha lub matrycy polimeru. Wartość tej liczby zawiera się w granicach od 1 dla atomu w końcowej lub funkcyjnej grupie stanowiącej składnik łańcucha do 8, 10 w przypadku niektórych polimerów koordynacyjnych. Opierając się na tak zdefiniowanym parametrze łączliwości (connectivity) polimeru możemy stwierdzić, że liniowe układy, w których atom metalu jest połączony z jednowymiarowym łańcuchem polimerowym posiadają wartość parametru łączliwości równą 1. Metal poza koordynacją do łańcucha polimerowego posiada jeszcze inne ligandy, które jeżeli nie łączą się z matrycą polimerową nie wpływają na wartość parametru łączliwości.
Łączliwość równą 2 posiadają polimeryczne alotropowe odmiany siarki i selenu o liniowej (w przypadku siarki również pierścieniowe cząsteczki S8) budowie. Łączliwość równą 2 posiadają polimeryczne alotropowe odmiany siarki i selenu o liniowej (w przypadku siarki również pierścieniowe 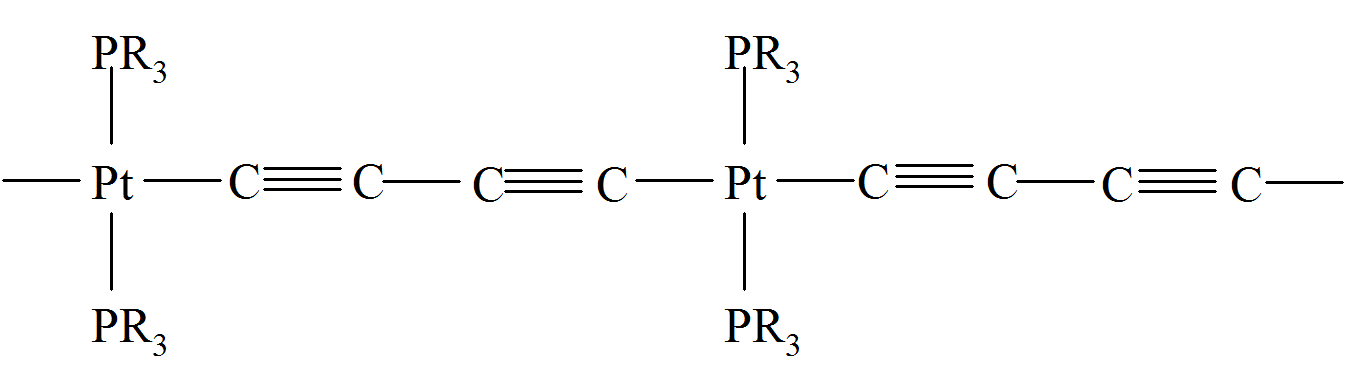 cząsteczki S8) budowie. Również liniowe cząsteczki polifosforanów, polifosfazenów, krzemianów i związków krzemoorganicznych o szkielecie zbudowanym z łącznika –Si–O– oraz liniowe polimery koordynacyjne i metaloorganiczne połączone ligandami jednokleszczowymi charakteryzują się parametrem łączliwości równym 2.
cząsteczki S8) budowie. Również liniowe cząsteczki polifosforanów, polifosfazenów, krzemianów i związków krzemoorganicznych o szkielecie zbudowanym z łącznika –Si–O– oraz liniowe polimery koordynacyjne i metaloorganiczne połączone ligandami jednokleszczowymi charakteryzują się parametrem łączliwości równym 2.
Niektóre krzemiany jak mika, talk, siarczek arsenu (As2S3) czy węgiel w graficie wykazują łączliwość równą 3, która powoduje, że mamy tu do czynienia z polimerami o strukturach typu 2D. Analogiczną wartość łączliwości posiadają związki krzemoorganiczne o ogólnym wzorze [RSi]n oraz związki metali o liczbie koordynacyjnej 3, jak przykładowo związek srebra(I).
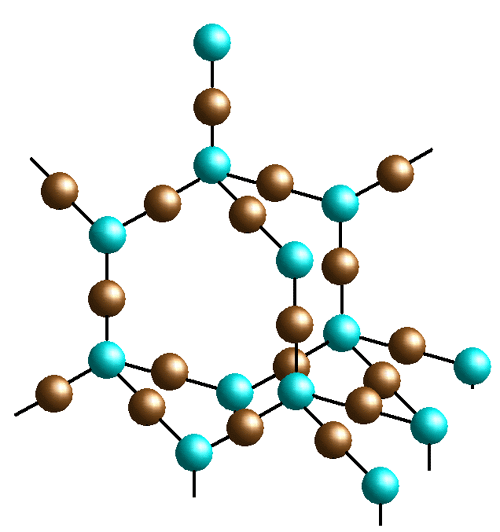
Chociaż w przypadku kwasów polifosforowych(V) o budowie liniowej i cyklicznej atom fosforu posiada łączliwość równą 2 to w wyniku hydrolizy P4O10 prowadzącej do ich powstania pojawia się forma, w której atomy fosforu posiadają parametry łączliwości 2 i 3. Hydroliza jest procesem dynamicznym, w którym tworzenie i zrywanie wiązań a tym samym zmiany parametru łączliwości atomów fosforu zachodzą w czasie, to podobna sytuacja związana z obecnością atomów o mieszanej łączliwości występuje w azbeście amfibolowym. W tym wypadku podwójne łańcuchy krzemianowe połączone są mostkami tlenowymi co powoduje, że atomy krzemu występują na stopniach łączliwości 2 i 3.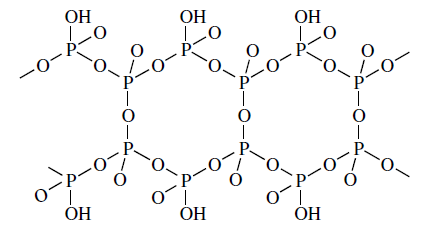
Atomy krzemu w szkłach krzemianowych posiadają łączliwość równą 4. Podobnie w fosforanach boru i glinu jak również w przypadku wielu polimerów 3D mamy do czynienia z łączliwością atomów równą 4. W przypadku polimerów koordynacyjnych ten stopień łączliwości występuje w przypadkach gdy atom metalu jest połączony ze szkieletem polimerowym za pomocą liganda dwukleszczowego, który koordynuje do metalu w sposób bidentny.

W przypadku polimerów koordynacyjnych gdy atom metalu jest koordynowany przez trzy trójkleszczowe ligandy mamy do czynienia z łączliwością równą 6. Przykładem takie polimeru może być ferrocenowy związek koordynacyjny żelaza:
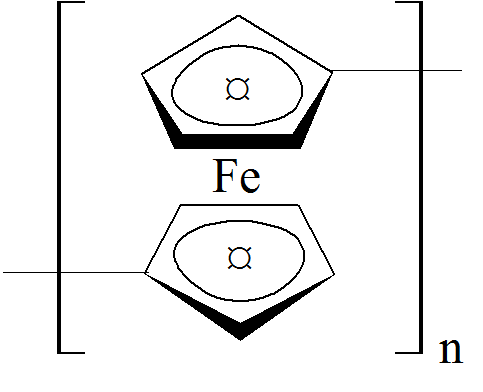 w którym łączliwość atomów żelaza wynosi 6 jeżeli przyjmujemy, że liczba wiązań pomiędzy żelazem a pierścieniem cyklopetadienylowym wynosi trzy. Z drugiej strony ponieważ odległość pomiędzy każdym atomem węgla pierścienia C5H5 i żelazem jest taka sama można, przyjmując liczbę atomów w otoczeniu jonu żelaza, określić łączliwość na równą 10.
w którym łączliwość atomów żelaza wynosi 6 jeżeli przyjmujemy, że liczba wiązań pomiędzy żelazem a pierścieniem cyklopetadienylowym wynosi trzy. Z drugiej strony ponieważ odległość pomiędzy każdym atomem węgla pierścienia C5H5 i żelazem jest taka sama można, przyjmując liczbę atomów w otoczeniu jonu żelaza, określić łączliwość na równą 10.
Łączliwość równą 8 posiadają jony cyrkonu(IV), itru(III) i niektórych lantanowców skoordynowane przez dwa czterokleszczowe ligandy tworzące łańcuch polimerowy.
Innym rodzajem klasyfikacji polimerów nieorganicznych jest metoda oparta na wymiarowości polimeru. Liniowe polimery są jednowymiarowe (1D), a łączliwość atomów w łańcuchu polimerowym wynosi 2, chociaż jest możliwe, że łączliwość atomów będzie większa przykładowo 3. Taka sytuacja ma miejsce w przypadku polimerów, w których w łańcuchu polimerowym występują pierścienie benzenowe. Niektóre z atomów węgla w pierścieniu będą miały łączliwość równą 3. Wiele polimerów nieorganicznych wykazuje struktury dwu– lub trójwymiarowe (2D, 3D).
Struktury 1D występują w postaci takich układów jak: łańcuch prosty, zig–zag, podwójny łańcuch, helisa, szkielet ryby, szyna czy drabina. Polimery dwuwymiarowe powstają, gdy atom metalu koordynuje 3 lub 4 molekuły liganda mostkującego i struktura rozrasta się w dwóch wymiarach. W tym przypadku motywy strukturalne mogą być następujące: motyw kratki kwadratowej, rombowej lub prostokątnej, motyw plastra miodu, ściany lub parkietu. Najtrudniejsze do zaprojektowania są struktury 3D, gdyż tutaj motyw musi się rozszerzać przez mostkujące ligandy w trzech kierunkach. Jedna z najbardziej znanych sieci trójwymiarowych to struktura diamentowa, w której każdy węzeł jest połączony z czterema ligandami i wykazuje geometrię tetraedryczną.