 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Początki teorii atomowej
Początki teorii atomowej
Teoria atomów sięga wczesnych filozofów greckich. R. Boyle, w 1661 r., pisał o „teoriach dawnych filozofów”, które teraz, wskrzeszone, traktuje się z wielkim szacunkiem, jako odkryte w tamtych epokach. Roztrząsa się jak Strabon w swoich pismach wspomina fenickiego Mochosa „sydończyka żyjącego przed wojną trojańską”, jako twórcę „starożytnego poglądu na temat atomów”, chociaż nic więcej o nim nie wiadomo, to ogólnie uważa się, że spekulacje na temat atomów rozpoczęły się od starożytnych Greków, Anaksagoras z Klazomenai (koło Smyrny) (498-428 p.n.e.) nauczał, że ciała są podzielne bez ograniczeń zachowując swoje cechy. Szkoła Eleatów, założona przez Xenophanesa z Kolophon (570–480 p. n. e.), miała jako głównego mistrza Zenona z Elei (ur. 489 p. n. e.), który nauczał, że materia jest ciągła, a ponieważ wszechświat jest pełen materii to w nim nie może występować ruch. Skonstruował kilka paradoksów, takich jak „Achilles i żółw”, aby udowodnić, że rzeczy tak naprawdę się nie poruszają.
Arystoteles twierdzi, że teorię atomową stworzył Leukippos (około 450 p.n.e.), którego pisma zaginęły. Arystoteles pisze, że argumentował on przeciwko ideom eleatów w następujący sposób:
Eleaci: Bez próżni nie ma ruchu; nie ma próżni, stąd nie ma ruchu.
Leukippos: Bez próżni nie ma ruchu; jest ruch, stąd jest próżnia.
Arystoteles pisze: „Leukippos twierdził, że jego teoria jest zgodna z rozsądkiem”. Twierdził bowiem, że „to, co jest ściśle mówiąc rzeczywiste, jest absolutną przestrzenią (plenum); ale przestrzeń nie jest jedną [niepodzielną całością]. Wręcz przeciwnie, jest ich nieskończona liczba i są niewidzialne ze względu na swój niewielki rozmiar. Poruszają się w próżni (bo próżnia istnieje); a poprzez zjednoczenie powodują powstanie; przez separację, zanik.”
Teorię atomową przyjął i rozszerzył Demokryt z Abdery (460-370 p.n.e.), jeden z najbardziej znanych i cenionych myślicieli starożytności, którego pisma niestety zaginęły, za wyjątkiem kilku fragmentów. Arystoteles pisze, że nauczał on iż atomy są twarde, mają formę, rozmiar i być może wagę (jest to kwestia sporna). Są niewidoczne ze względu na mały rozmiar. Nie mają koloru, smaku ani zapachu, ponieważ są to jedynie drugorzędne lub subiektywne właściwości. Atomy poruszają się spontanicznie i nieustannie w próżni; łączą się one przez „konieczność” (anaikh), tworząc zespoły za pomocą swego rodzaju mechanizmu haczyka i oczka, a nie przez działanie sił przyciągających. Ruch atomów jest podobny do ruchu drobin pyłu widocznych w promieniu słońca w nieruchomym powietrzu
Założenia teorii Demokryta rozwinął Epikur (341-270 p.n.e.), który przypisał atomom ciężar. Poruszają się one ruchem prostoliniowym w próżni, ale w nieokreślonym czasie i w nieokreślonych miejscach „skręcają” i zderzają ze sobą. Ta nieoczekiwana zmiana kierunku ruchu, wyśmiewana przez przeciwników Epikura, wykazuje pewne podobieństwo do współczesnej zasady nieokreśloności, a „konieczność” Demokryta znajduje odzwierciedlenie w statystycznej, kinetycznej teorii gazów. Filozoficzne rozważania poprzedników znalazły swoje odniesienie, i zostały rozbudowane w De Rerum Natura Lukrecjusza (około 57 r. p. n. e.). Dzieło to jest uważane obecnie, nie bez powodu, za zawierające współczesne rozumienie świata. We fragmencie „Ruchy i kształty atomów” zamieszczonym na początku drugiej księgi znajdujemy dyskusję ruchu drobinek kurzu widocznego w wiązce światła.
Odrodzenie teorii atomowej
Zadziwiające, a jednocześnie pocieszające, jest to że dwa tysiące lat spekulacji nie pozwoliło na stworzenie teorii atomowej w postaci wystarczająco prostej aby można było sprawdzić ją eksperymentalnie. Zastosowanie przez Roberta Boyle’a newtonowskiego prawa o malejącej wraz z odległością sile oddziaływań pomiędzy cząsteczkami gazu, a niemal pół wieku później genialne dedukcje Daniela Bernoulliego w stosunku do teorii kinetycznej nie pozwoliły uczonym zrozumieć natury atomów. Sytuacja zmieniła się za sprawą wiejskiego nauczyciela, człowieka o nieokrzesanych manierach, który w przebłysku natchnienia wskazał drogę do świata atomu.
John Dalton urodził się 5 września 1766 roku w rodzinie ubogiego tkacza, w miejscowości Eaglesfield położonej w hrabstwie Cumberland na północy Anglii. W swoim czasie został wysłany do szkoły w pobliskiej miejscowości, gdzie pobierał podstawowe nauki. Gdy miał lat 11 nauczyciel, pan John Fletcher, zrezygnował z dalszej pracy i John Dalton otworzył szkołę we własnym domu, którą później przeniósł do lokalnego domu spotkań społeczności wiejskiej. Trudno zrozumieć jak możliwe było zlecenie 12 letniemu chłopcu nauczania rówieśników. Dodatkowo zdumienie budzi fakt, że młody Dalton nigdy nie był określany jako szczególnie błyskotliwy. Można przypuszczać, że wytrwałość, samodzielność i niesamowita zdolność do koncentracji na różnych zagadnieniach, tak widoczna w jego późniejszym życiu, została zauważona przez dorosłych, którzy odważyli się powierzyć mu kształcenie rówieśników. Mając 15 lat John przeniósł się do swojego brata Jonathana w Kendal gdzie prowadził szkołę dla dzieci przyjaciół. Przez następne 12 lat, od roku 1781 do 1793, nauczał i studiował. W tym czasie położył podwaliny pod swe wielkie odkrycia co było, w pewnym stopniu, wynikiem przyjaźni z o 10 lat starszym Johnem Gaughem. J. Gaugh chociaż niewidomy od urodzenia posiadał cechy, których brakowało Daltonowi; był uznanym filozofem i eksperymentatorem, posiadającym niezależne środki finansowe i błyskotliwy umysł. Szczególne zainteresowanie jakie wykazywał w stosunku do matematyki i nauk ścisłych spowodowało, że John Dalton niejako został jego studentem. Jedną z dziedzin jaka interesowała J. Gaugha była meteorologia. W marcu 1787 roku przekonał J. Daltona do rozpoczęcia regularnych obserwacji pogodowych, które ten kontynuował aż do swojej śmierci. To właśnie dzięki zaangażowaniu w obserwacje meteorologiczne Dalton sformułował swoje teorie wyjaśniające reakcje chemiczne i stworzył nowoczesną teorię atomową, która przyniosła mu nieśmiertelną sławę. Wiosną 1793 roku J. Dalton, dzięki rekomendacji J. Gaugha, otrzymał propozycję objęcia stanowiska nauczyciela matematyki i filozofii przyrody w New College w Manchesterze. Wkrótce po objęciu posady opublikował pierwsze swoje dzieło Meteorological Observations and Essays zawierające dane zgromadzone podczas pobytu w Kendal. To tutaj znajdujemy większość idei, których rozwijaniem zajmował się przez kolejne 10 lat, między innymi rozważania nad mieszaninami gazów znajdujących się w atmosferze. Niecały rok później został członkiem Towarzystwa Filozoficznego w Manchesterze, a jego pierwsze wystąpienie na forum Towarzystwa dotyczyło nie gazów, a widzenia barw. To właśnie w tej publikacji omówił ślepotę na barwy czerwoną i zieloną, na którą cierpiał, i stąd wzięło się określenie daltonizm. W ciągu kolejnych pięciu lat przedstawił jeszcze tylko jedną pracę, co pokazuje, że obowiązki w New College połączone z obserwacjami meteorologicznymi, pochłaniały cały jego czas. W 1799 roku uczelnia została zamknięta, a J. Dalton pozbawiony stanowiska powrócił do roli prywatnego nauczyciela, czym zajmował się przez resztę życia. Na szczęście Towarzystwo Filozoficzne pozwoliło mu na zajęcie jednego z pomieszczeń w siedzibie przy George Street, które przez lata użytkował jako salę lekcyjną i swoje laboratorium. Nigdy wcześniej nie prowadził systematycznych badań laboratoryjnych, ale gdy pojawiła się taka możliwość zdołał w ciągu kilku lat zrealizować wszystkie swoje idee dotyczące dyfuzji gazów, prawa ciśnień cząstkowych, zachowania pary wodnej w atmosferze i chemicznej teorii atomowej co przyniosło mu sławę i uznanie. Tak imponujący dorobek wskazuje, ze J. Dalton musiał opanować sztukę prowadzenia eksperymentów w stopniu mistrzowskim, ale co dziwne osąd mu współczesnych był zupełnie przeciwny.
Pod koniec XVIII wieku właściwości gazów były słabo poznane. Teoria kinetyczna, podstawa do zrozumienia zachowania się gazów, zaproponowana przez Roberta Hooke’a i opracowana matematycznie przez Daniela Bernoulliego, nie była szeroko znana mimo rangi tych dwóch uczonych. Świat naukowy, pod wpływem geniuszu Antoine’a Lavoisiera, skupiał się na chemii i jej roli w badaniu przyrody. Ujęcie chemiczne pozwalało na wyjaśnienie szeregu tajemniczych zjawisk. Zaskakujący współczesnych fakt, że tlen i azot znajdujące się w powietrzu nie ulegały rozdzieleniu na odrębne warstwy pomimo różnic w ciężarach właściwych, wyjaśniano faktem powstawania „luźnego” związku chemicznego. Prostotę takiego podejścia do zjawisk przyrodniczych można scharakteryzować jedynie jako „luźne” myślenie. W podobny sposób, za pomocą „chemicznego” odziaływania, wyjaśniano obecność i ruch pary wodnej w powietrzu. J. Dalton, nie znając ówcześnie obowiązujących pojęć chemicznych, podszedł do problemu z fizycznego punktu widzenia. Pozostając pod wpływem I. Newtona, i jego cząsteczkowej koncepcji gazów, rozwinął fizyczną teorię dyfuzji, ciśnień cząstkowych i zachowania pary wodnej w powietrzu. Swoje przemyślenia przedstawił w pracy, zaprezentowanej Towarzystwu Filozoficznemu w październiku roku 1801, pod bardzo rozbudowanym tytułem: Experimental essays on the constitution of mixed gases; on the force of steam or vapour from water and other liquids in different temperatures, both in a Torricellian vacuum and in air; on evaporation; and on the expansion of gases by heat. Fizyczna teoria dyfuzji wynikała z założenia przez J. Daltona wzajemnie odpychających się cząstek newtonowskich. Rozpatrując problem od strony eksperymentalnej wykazał, że w danej temperaturze występuje określone ciśnienie pary wodnej – ciśnienie nasycenia – które ma wartość stałą niezależnie od rodzaju gazu w jakim znajduje się para wodna. Ponadto wynik eksperymentów był taki sam gdy para wodna znajdowała się w próżni. Wyniki eksperymentalne w naturalny sposób prowadziły do prawa ciśnień cząstkowych:
„Ciśnienie wywierane przez mieszaninę gazów jest równe sumie ciśnień wywieranych przez składniki mieszaniny, gdyby każdy z nich był umieszczany osobno w tych samych warunkach objętości i temperatury, jest ono zatem sumą ciśnień cząstkowych.”
Analizując zjawisko nasycenia pary wykazał, że każda próba zwiększenia ciśnienia nasycenia powoduje jedynie kondensację. Ponadto wykazał, że jeżeli ciśnienie cząstkowe pary wodnej w powietrzu było mniejsze niż wartość nasycenia, to obniżenie temperatury powodowało osiągnięcie punktu rosy, czyli stan nasycenia. Niektóre wyniki tych eksperymentów znalazły się w jego New System of Chemical Philosophy z roku 1808. Z teorii dyfuzji, którą opracował, wysnuł wniosek, że na pewnych wysokościach gazy atmosferyczne mogą ulec rozdzieleniu. Aby to sprawdzić badał mieszaniny powietrza z tlenkiem azotu(II) (NO) i odkrył, że przebieg reakcji pomiędzy tymi gazami zależy od proporcji w jakich zostały one zmieszane. Związane z tym eksperymenty prowadził od połowy 1802 roku. Z notatnika laboratoryjnego wynika, że dopiero 4 sierpnia 1803 roku zrozumiał jaka jest przyczyna zmienności proporcji reagujących ze sobą substancji. Notatki z tych badań przedstawiają się następująco (w tekście podano współczesną notację nazw związków chemicznych):
„Jeżeli 100 części powietrza zmieszane zostaną z 36 częściami tlenku azotu(II) w rurce o szerokości ¾ cala i długości 5 cali, to po kilku minutach objętość całości zredukuje się do 79 lub 80 części, w których nie występuje tlen i NO(II)”
„Jeżeli 100 części powietrza wprowadzi się do 72 części tlenku azotu(II) w szerokim naczyniu częściowo zanurzonym w wodzie, i mieszanina gazów zostanie natychmiast podpalona, to jak poprzednio pozostanie 79 lub 80 części początkowej objętości czystego tlenku azotu(II)”
„Jeżeli w ostatnim doświadczeniu zostanie użytych mniej niż 72 części tlenku azotu(II), to w pozostałej mieszaninie gazów znajduje się tlen; jeżeli użytych zostanie więcej tlenku azotu(II), to on pozostaje w mieszaninie poreakcyjnej … te obserwacje wskazują na to, że pewna objętość tlenu może łączyć się z pewną częścią tlenku azotu(II) lub też z dwukrotnie większą ilością tego gazu, ale nie ma możliwości wystąpienia pośrednich ilości. W pierwszym przypadku rezultatem reakcji jest kwas azotowy(V), a w drugim kwas azotowy(III) … Ponieważ jednak obydwa kwasy mogą powstawać w tym samym czasie, to jedna część tlenu reaguje z jedną częścią tlenku azotu(II), a w drugim przypadku z dwoma częściami NO. W związku z tym ilość zużytego w reakcji tlenku azotu(II) musi być zmienna.”
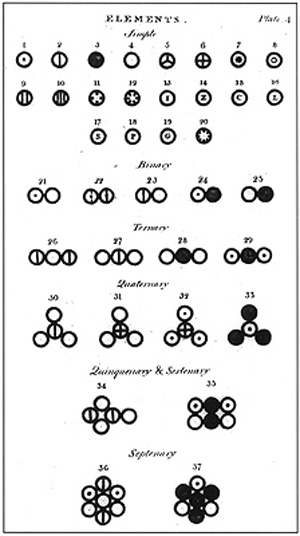 Skan strony książki Johna Daltona „A New System of Chemical Philosophy”, 1808W tym miejscu warto zwrócić uwagę na to jak rozwija się nauka, a jest to sposób odmienny od tego co można wywnioskować z popularnych przedstawień. Żadne wielkie odkrycie nie powstało nagle, w sposób całościowy i jasny, w umyśle badacza. Żmudnie zbierane dowody eksperymentalne wskazują na uogólnienia, które nie wyjaśniają w sposób jednoznaczny obserwowanych faktów i wymagają znacznego wysiłku aby połączyć je w spójną całość. W taki sposób naukowe koncepcje nabierają określonej formy, której ważność i granice stosowalności stają się następnie przedmiotem kolejnych badań. Ostateczna wartość nowych odkryć rzadko, jeśli w ogóle, może zostać w pełni ujęta w momencie ich sformułowania. Znaczenie nowej koncepcji naukowej ugruntowuje się w trakcie kolejnych, trwających latami badań. Wracając do doświadczeń J. Daltona zastanówmy się jakie znaczenia miało odkrycie zależności ilości produktów reakcji od proporcji użytych substratów. Opierając się na modelu gazu jako układu cząstek założył on, że cząsteczki danego gazu są takie same, a reakcja chemiczna polega na połączeniu atomów jednego rodzaju z innymi. W ten sposób, na bazie eksperymentalnej, została sformułowana teoria atomowa. Natomiast ta, wydawać by się mogło, prosta koncepcja niosła ze sobą znacznie szerszy kontekst. W ciągu następnego miesiąca J. Dalton zauważył, że jeżeli dwa pierwiastki tworzą ze sobą więcej niż jeden związek chemiczny, to masy jednego z pierwiastków przypadające na taką samą masę drugiego mają się do siebie jak niewielkie liczby całkowite. Skoro tak, to opierając się na wzorze związku chemicznego można wyznaczyć względne ciężary atomów wchodzących w jego skład. To odkrycie natychmiast pozwoliło mu na skonstruowanie tabeli względnych mas atomowych pierwiastków, dla których zaproponował odpowiednie symbole. Na październikowym posiedzeniu Towarzystwa Filozoficznego przedstawił swoje dokonania w tej materii. Nie wiemy jak zostało przyjęte jego doniesienie; prawdopodobnie w spotkaniu uczestniczyła tylko garstka członków Towarzystwa i wątpliwym jest aby ktokolwiek z nich zdawał sobie sprawę ze znaczenia tego odkrycia.
Skan strony książki Johna Daltona „A New System of Chemical Philosophy”, 1808W tym miejscu warto zwrócić uwagę na to jak rozwija się nauka, a jest to sposób odmienny od tego co można wywnioskować z popularnych przedstawień. Żadne wielkie odkrycie nie powstało nagle, w sposób całościowy i jasny, w umyśle badacza. Żmudnie zbierane dowody eksperymentalne wskazują na uogólnienia, które nie wyjaśniają w sposób jednoznaczny obserwowanych faktów i wymagają znacznego wysiłku aby połączyć je w spójną całość. W taki sposób naukowe koncepcje nabierają określonej formy, której ważność i granice stosowalności stają się następnie przedmiotem kolejnych badań. Ostateczna wartość nowych odkryć rzadko, jeśli w ogóle, może zostać w pełni ujęta w momencie ich sformułowania. Znaczenie nowej koncepcji naukowej ugruntowuje się w trakcie kolejnych, trwających latami badań. Wracając do doświadczeń J. Daltona zastanówmy się jakie znaczenia miało odkrycie zależności ilości produktów reakcji od proporcji użytych substratów. Opierając się na modelu gazu jako układu cząstek założył on, że cząsteczki danego gazu są takie same, a reakcja chemiczna polega na połączeniu atomów jednego rodzaju z innymi. W ten sposób, na bazie eksperymentalnej, została sformułowana teoria atomowa. Natomiast ta, wydawać by się mogło, prosta koncepcja niosła ze sobą znacznie szerszy kontekst. W ciągu następnego miesiąca J. Dalton zauważył, że jeżeli dwa pierwiastki tworzą ze sobą więcej niż jeden związek chemiczny, to masy jednego z pierwiastków przypadające na taką samą masę drugiego mają się do siebie jak niewielkie liczby całkowite. Skoro tak, to opierając się na wzorze związku chemicznego można wyznaczyć względne ciężary atomów wchodzących w jego skład. To odkrycie natychmiast pozwoliło mu na skonstruowanie tabeli względnych mas atomowych pierwiastków, dla których zaproponował odpowiednie symbole. Na październikowym posiedzeniu Towarzystwa Filozoficznego przedstawił swoje dokonania w tej materii. Nie wiemy jak zostało przyjęte jego doniesienie; prawdopodobnie w spotkaniu uczestniczyła tylko garstka członków Towarzystwa i wątpliwym jest aby ktokolwiek z nich zdawał sobie sprawę ze znaczenia tego odkrycia.
Mniej więcej w tym samym czasie J. Dalton przyjął zaproszenie do wygłoszenia wykładów bożonarodzeniowych w Royal Institution w roku 1803. Instytucja, która miała odegrać wielką rolę w brytyjskiej nauce została niedawno powołana a kierował nią energiczny hrabia Rumford, czyli Benjamin Thompson, fizyk, badacz zagadnień z zakresu termodynamiki i wynalazca. Kierując radą naukową Instytutu, B. Rumford z właściwą sobie dalekowzrocznością zatrudnił już młodego Kornwalijczyka dwudziestoparoletniego Humphry’ego Davy’ego. To właśnie H. Davy zaaranżował pobyt i wykłady J. Daltona na forum Instytutu. Wydaje się, że J. Dalton musiał wcześniej przedstawić H. Davy’emu swoje koncepcje, ale jedyne co możemy stwierdzić na pewno to fakt, że teoria atomowa Daltona została przedstawiona w trakcie wykładów bożonarodzeniowych w brytyjskim stowarzyszeniu naukowo-edukacyjnym. Warto w tym miejscu wspomnieć, że chociaż H. Davy uznał potęgę teorii atomowej J. Daltona, to nigdy nie zaakceptował jej podstawowych założeń, ani nie uznał rzeczywistości atomów. Dokumenty J. Daltona z lat 1801-1803 przedstawiające jego teorię atomową ukazały się drukiem w roku 1805. W międzyczasie dr Thomas Thomson z Glasgow, chemik cieszący się renomą i autor szeroko znanego traktatu o chemii, odwiedził J. Daltona w 1804 roku aby omówić niedostatki jego teorii dyfuzji. I chociaż dyskusja obydwu uczonych nie była zbyt owocna to T. Thomson zainteresował się eksperymentami J. Daltona i jego teorią. Gdy następna edycja podręcznika T. Thomsona ukazała się w 1807 roku zawierała pierwszy ogólnie dostępny opis teorii atomowej. Tekst samego autora teorii ukazał się dopiero rok później w części pierwszej New System of Chemical Philosophy. Natomiast problem dyfuzji, który doprowadził do powstania teorii atomowej, nigdy nie został przez J. Daltona rozwiązany. Początkowo zakładał on, że atomy wszystkich gazów są tej samej wielkości ale wątpliwości T. Thomsona doprowadziły go do zmiany poglądu i założenia, że chociaż wszystkie atomy danej substancji są identyczne pod każdym względem, atomy różnych substancji są różnej wielkości. Później powrócił do pierwotnego przekonania o tych samych rozmiarach wszystkich atomów. Komplikacje w teorii dyfuzji wprowadzało założenie, że podczas gdy atomy gazu A odpychają się wzajemnie, podobnie jak atomy gazu B, to atomy A i B wzajemnie nie oddziałują. Takie założenie dobrze współgrało z prawem ciśnień cząstkowych. Jednak skoro odpychanie atomów jednego gazu było powodowane ciepłem otaczającym każdy z atomów (idea ta została zaczerpnięta od A. Lavoisiera) trudno było zrozumieć dlaczego atomy dwóch różnych gazów nie działały na siebie wzajemnie. Ta nieścisłość nigdy nie została rozwiązana przez J. Daltona.
Kolejne lata po 1804 roku J. Dalton spędził dopracowując swoje teorie i przeprowadzając kolejne eksperymenty naukowe. Żaden z tych eksperymentów nie przyniósł przełomowych rezultatów. Wydawało się, że po ogłoszeniu teorii atomowej zagubił się w labiryncie szybko gromadzących się, ale pozornie sprzecznych, danych chemicznych. Akceptacja dla teorii atomowej postępowała bardzo powoli w świecie naukowym, szczególnie wśród uczonych angielskich. Nieco lepiej było na terenie Europy kontynentalnej, szczególnie we Francji. Eksperymenty przeprowadzone przez Louisa Gay-Lussaca, opublikowane w 1809 roku wykazały, że w reakcjach pomiędzy gazami, objętości substratów i produktów, mierzone w tych samych warunkach temperatury i ciśnienia, mają się do siebie jak niewielkie liczby całkowite. Wyjaśnienie wyników tych eksperymentów na podstawie teorii J. Daltona nastąpiło w 1811 a dokonał tego włoski fizyk Amadeo Avogadro przy czym słowo wyjaśnienie należałoby wziąć w cudzysłów, gdyż Avogadro uznał, że teoria Daltona wyjaśnia eksperyment pod warunkiem gdy ktoś zechce uwierzyć w atomy i „połówki atomów”. Rzeczywiście J. Dalton uważał, że dowolny gaz zbudowany jest z atomów i nigdy nie wprowadził rozróżnienia pomiędzy tym co obecnie nazywamy atomem i cząsteczką. Rozróżnienie pomiędzy atomem i cząsteczką oraz pomieszanie jakie powstało w wyniku wyznaczania przez J. Daltona mas atomowych z użyciem arbitralnych reguł przebiegu reakcji chemicznych przyszło dopiero pół wieku później za sprawą geniuszu włoskiego chemika Stanislao Cannizaro. I chociaż wielu chemików jak H. Davy nie uznawało istnienia atomów to teoria atomowa została szeroko zaakceptowana jako potężne narzędzie wykorzystywane do zrozumienia przebiegu reakcji chemicznych.
W rok po sformułowaniu swojej koncepcji teorii atomowej J. Dalton zamieszkał w domu księdza Wiliama Johnsa przy George Street, gdzie spędził kolejne 26 lat, do momentu kiedy ksiądz Johnes przeniósł się na przedmieścia Manchesteru. W tym okresie życie J. Daltona było podobne do losów bohatera powieści Julesa Verne’a „W osiemdziesiąt dni dookoła świata”, codzienność toczyła się z matematyczną precyzją – „un homme mathématiquement précis”. W laboratorium codziennie przebywał taką samą liczbę godzin, a jego sąsiedzi mogli regulować zegarki obserwując moment sprawdzania termometru przez uczonego. Dzień kończył dokładnie o godzinie 21, spożywał posiłek, po którym zasiadał do palenia fajki. Nie brał żywego udziału w rozmowach, ograniczając się jedynie do zdawkowych wtrąceń lub lakonicznych dowcipnych uwag. W każdy czwartek po południu nie prowadził badań poświęcając ten czas na cotygodniową rekreację. W ramach czwartkowego odpoczynku udawał się po obiedzie do kręgielni przylegającej do tawerny Dog and Partridge, gdzie grał z zapałem i entuzjazmem ku uciesze innych. Zazwyczaj stateczny i skromny, podczas gry stawał się niezwykle ożywiony. Grając zawierał zawsze kilka skromnych zakładów, które skrupulatnie notował. Po wypaleniu fajki w tawernie wracał do domu w momencie, w którym zwykł odczytywać wskazania barometru i termometrów. W niedzielę, ubrany w surowy strój kwakierski, uczestniczył w obrządku religijnym dwukrotnie. Wydaje się, ze uważał to za swój obowiązek chociaż nie używał frazeologii kwakierskiej i nie wdawał się w dyskusje o poglądach religijnych. Jego postawa sprawia wrażenie jakby starał się przestrzegać zewnętrznych form wyznawanej wiary, może jako wzorca moralnego dla innych lub też aby nie narażać się na krytykę, podczas gdy jego własne życie emocjonalne nie było z wiarą przesadnie związane. Brak ogłady towarzyskiej wynikający z wiejskiego pochodzenia, a częściowo z powodu chorobliwej wręcz niezręczności, powodował, że nie był zapraszany do uczestnictwa w spotkaniach towarzyskich. Brat H. Davy’ego scharakteryzował go tymi słowami: „jego wygląd i sposób bycia były odrażające … jego głos był szorstki i chuligański, a chód sztywny i niezgrabny”. Podobny opis dał inny członek Towarzystwa Filozoficznego: „Głos miał głęboki i szorstki, artykulacja niewyraźna i bełkotliwa tak bardzo, że obcy mógł pomyśleć, że ma do czynienia z osobą nieokrzesaną”. Z tych opisów jasno wynika dlaczego J. Dalton nie odniósł sukcesu jako wykładowca, chociaż społeczna awersja jaką budził nie mogła być jedyną przyczyną. Wiele demonstracji, które przeprowadzał na swoich wykładach nie udawało się z powodu jego niezręczności. Ten brak zdolności eksperymentatora przeniósł się również na badania jakie prowadził. Jego biograf dr W. C. Henry zanotował „instrumenty badawcze jakimi się posługiwał, wykonane własnoręcznie, były niedokładne, a sposób prowadzenia eksperymentów był niedbały, jeśli nie niechlujny”. Nie wykazywał „zręczności manualnej ani nawyków czy też temperamentu niezbędnego do rygorystycznie prowadzonych badań eksperymentalnych”. Niemniej jednak bliscy mu naukowcy cenili jego zdolności i oddanie nauce. Manchesterskie Towarzystwo Filozoficzne wybrało go na sekretarza w roku 1800, wiceprezydenta w 1808, a przewodniczącym Towarzystwa został w 1817 roku. Przez resztę jego życia wybór na przewodniczącego był ponawiany. Chociaż i tutaj dawał znać jego brak ogłady towarzyskiej i ograniczenia poglądów wynikające z wiejskiego wychowania. Mało co czytał, co zanotowali jego biografowie opisując go jako „człowieka, który może nosić swoją bibliotekę na plecach, a mimo to nie przeczytał nawet połowy książek”. Ta charakterystyka osoby J. Daltona wyniknęła z jego niechęci do powiększania zasobu książek naukowych w Towarzystwie mimo tego, że była to wtedy jedyna taka biblioteka w Manchesterze. Ponieważ Manchesterskie Towarzystwo nosi nazwę The Manchester Literary and Philosophical Society, to jego przewodniczący powinien również propagować publikacje literackie. Jednak J. Dalton starał się zniechęcać społeczeństwo do czytania literackich esejów. Musiało być zabawnym, ale jednocześnie irytującym, dla autorów usłyszeć jak ocenia on odczyty literackie jako „nie wnoszące żadnych pozytywnych faktów do zasobu wiedzy i niczego nie dowodzące”.
Gdy teoria Daltona rozpowszechniła się w środowisku naukowym uznanie jego osoby znacznie wzrosło. Francuska Akademia Nauk przyjęła go do swojego grona jako członka korespondenta w roku 1816, a Royal Society, którą kierował H. Davy, w roku 1822. W 1826 roku Towarzystwo Królewskie uhonorowało go medalem i jedną z dwóch przyznanych wtedy nagród Jerzego IV, wysokości 50 gwinei. W 1830 roku Akademia Francuska przyznała mu najwyższy zaszczyt jaki mógł osiągnąć naukowiec z poza granic Francji, wybierając go, spośród ośmiu kandydatów, na miejsce zajmowane wcześniej przez, zmarłego rok wcześniej, H. Davy’ego. Kiedy dwa lata później Brytyjskie Stowarzyszenie na rzecz Nauki odbywało swoje spotkanie w Oxfordzie, uniwersytet nadał mu stopień doktora wraz z Michaelem Faraday’em, Robertem Brownem i Sir Davidem Brewsterem. Rok później, również w Cambridge, ogłoszono, że rząd przyznał mu roczną emeryturę w wysokości 150 funtów. Trzy lata później wysokość emerytury została podwojona, a w 1834 roku Uniwersytet w Edynburgu nadał mu stopień naukowy doktora prawa. W tym samym roku został przedstawiony królowi Wilhelmowi IV na przyjęciu w St. James Palace. Ceremonia w pałacu wymagała noszenia miecza, który nie pasował nie tylko do charakteru J. Daltona ale również do wyznawanych prze niego reguł kwakierskich. Problem rozwiązano ubierając J. Daltona w szatę doktora nauk z Oxfordu. Jak zapisano w kronikach król zwrócił się do niego słowami: „Cóż panie Dalton jak sobie radzisz w Manchesterze, spokojnie, jak sądzę?.” Uwaga Króla nie była zwykłym zwyczajowym powitaniem, prawdopodobnie odnosiła się do zamieszek jakie miały miejsce w tym mieście rok wcześniej. Odpowiedź jakiej udzielił Dalton miała charakterystyczny dla nie go styl: „Cóż nie wiem, myślę, że tak sobie”. Zapytany przez przyjaciela, czy nie uważa, ze jego zachowanie narusza zasady dworskiej etyki, odpowiedział, posługując się wiejską gwarą z Cumberland „Może i tak, ale co można powiedzieć takiemu jak on?”. Okres uznania przyszedł w odpowiednim czasie dla uczonego; wiosną 1837 roku doznał dwukrotnie dwóch wylewów, po których już nigdy nie odzyskał pełni zdrowia. Pomimo, że mógł dalej kontynuować, chociaż wolniej, swoje prace badawcze jego intelekt słabł. W 1840 roku Royal Society odmówiło publikacji jego artykułu. W czerwcu 1842 r. Towarzystwo w Manchesterze odbywało swoje spotkanie i J. Dalton miał nadzieję ponownie zostać wybranym przewodniczącym. Jednak sposób wypowiadania, dość trudno zrozumiały wcześniej, stał się kompletnie niezrozumiały, a stan zdrowia znacznie się pogorszył. Mimo tego, został wiceprezesem Towarzystwa, i było to ostatnie stanowisko jakie osiągnął w świecie naukowym Przez kolejne dwa lata prowadził swoje obserwacje meteorologiczne, aż do śmiertelnego udaru w dniu 17 lipca 1844 roku.
Teoria, że reakcje chemiczne polegają na łączeniu się atomów ze sobą była opracowywana również przez innych badaczy jeszcze przed J. Daltonem. Pierwszym zwolennikiem takiej teorii wydaje się być irlandzki chemik i nauczyciel pracujący w Londynie, Bryan Higgins (1737-1820), a drugi to jego bratanek William Higgins (1769-1825). Warto przytoczyć krótkie podsumowanie teorii braci Higginsów. Bryan Higgins opublikował cztery traktaty odnoszące się do teorii atomowej “Syllabus of Chemical and Philosophical Inquiries” (1775), “A Philosophical Essay Concerning Light” (1776), “Experiments and Observations Relating to Acetous Acid, etc.” (1786) oraz “Minutes of a Society for Philosophical Experiments and Conversations” (1795). Teorię atomową przedstawioną w tych pismach można podsumować następująco. Istnieje siedem pierwiastków – ziemia, powietrze, woda, pierwiastki przejęte ze starożytności, do których B. Higgins dodał kwasy, zasady, flogiston i światło. Ogień, którzy starożytni uważali za pierwiastek przez Higginsa był uważany za związek flogistonu i światła. Atomy pierwiastków są twarde i sferyczne, przyciągają się siłami zmieniającymi się w zależności od odległości pomiędzy nimi, a siła oddziaływania pomiędzy atomami jest odwrotnie proporcjonalna do odległości. Ogień przenika wszystkie ciała i daje efekt odpychania. Gazy powstają poprzez wprowadzenie ognia do ciał stałych i cieczy. Ciała pozostają w swoim stanie skupienia dzięki odpowiednim proporcjom pomiędzy siłami przyciągania i odpychania. Cząsteczki związków dwuskładnikowych zawsze zawierają po jednym atomie każdego ze składników. W gazach cząsteczki są otoczone ogniem wywierającym siłę odpychającą. Podczas tworzenia związku chemicznego siły otaczające atomy muszą zostać zmieszane lub unicestwione. Porównanie tych idei z teorią J. Daltona pokazuje pewne podobieństwa w cechach jak sferyczność atomów, rozdzielenie cząsteczek gazu przez atmosferę ognia (ciepło) i łączenie atomów w odpowiednich proporcjach w związku chemicznym. Pierwsze dwie idee, sferyczność atomów i rozdzielenie cząsteczek w gazie za pomocą odpychającej atmosfery ognia reprezentuje mniej więcej ogólny pogląd uczonych tamtych czasów. Trzeci punkt jest prostą konsekwencją założenia o budowie cząsteczek na drodze łączenia się atomów. Jednak wiedząc, że J. Dalton raczej stronił od czytania czegokolwiek można przypuszczać, że nie znał prac Higginsów. Szczegóły przebiegu reakcji chemicznej według koncepcji B. Higginsa nie zostały wyjaśnione, ale jego poglądy wskazują na duży wpływ idei Newtona. Chociaż Bryan Higgins, nie znalazł uznania w kręgach naukowych, to jego siostrzeniec William, autor książki „Comparative View of the Phlogistic and Antiphlogistic Theories” z roku 1789, wywarł pewien wpływ na współczesnych mu naukowców głównie tym, że przeciwstawił się bardzo modnej ówcześnie doktrynie flogistonu. Spekulacje na temat doktryny atomistycznej posłużyły autorowi głównie jako broń w arsenale intelektualnym skierowanym przeciwko zwolennikom doktryny flogistonowej. W każdym razie W. Higgins nigdy nie sprecyzował pochodzenia ani natury sił odpowiedzialnych za łączenie się atomów w cząsteczki. Gdyby miały charakter centralnych sił grawitacyjnych byłyby odwrotnie proporcjonalne do kwadratu odległości pomiędzy atomami w cząsteczce. Nic nie wskazuje na to aby W. Higgins przyjął taki model. Natomiast jeżeli traktował je jako sztywne kule, zgodnie z modelem Bryana Higginsa, to należy założyć, że w związku chemicznych atomy stykają się ze sobą. W takim wypadku atomy o równych rozmiarach, będące w kontakcie ze sobą, znajdują się w równych odległościach od siebie, jeżeli rozważać kombinacje sześciu kul z jedną zajmującą położeniu środkowe. Ponieważ żadna z tych idei nie znajduje się w teorii J. Daltona, można przyjąć, że nie znał on prac braci Higginsów.
Po raz pierwszy podobieństwa obydwu teorii zostały przedstawione gronu naukowemu podczas wykładu wygłoszonego w listopadzie 1810 roku przez J. Daltona. Skutkiem tego było nagłośnienie prac W. Higginsa wśród uczonych europejskich co wywołało kontrowersje między dwoma rywalizującymi uczonymi, i pojawienie się głosów zarzucających J. Daltonowi plagiat. Teoria Daltona była silnie wspierana przez Thomasa Thomsona, chemika i redaktora Annals of Philosophy, W. C. Henry’ego oraz uczonych z Manchesteru Angusa Smitha czyli H. E. Roscoe'a i C. Schorlemmera. Biorąc pod uwagę awersję J. Daltona do czytania, ograniczoną współpracę z chemikami oraz to, że jego teoria powstała jako fizycznie związana z dyfuzją gazów i ich wzajemnym oddziaływaniem jest mało prawdopodobne aby znał on prace Higginsów przed ich rozpowszechnieniem przez H. Davy’ego w roku 1810. Chociaż należy przyznać, że koncepcja W. Higginsa zakładająca oddziaływanie atomów w reakcjach chemicznych powstała wcześniej niż teoria Daltona, jednak zasługa odkrycia naukowego trafia do badacza, który daje solidne podstawy swojej teorii. W opinii współczesnych William Higgins nie oparł swojej teorii na odpowiednich podstawach.