 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Reakcje w ciele stałym
Reakcje w ciele stałym
Najbardziej rzucającą się w oczy różnicą pomiędzy reakcjami w fazie ciekłej czy gazowej a zachodzącymi w fazie stałej jest różnica w ruchliwości reagujących cząstek decydująca o przebiegu reakcji. Należy jednak zdawać sobie sprawę z tego, że występujące w ciałach stałych defekty i nieregularności odgrywają zasadniczą rolę w przebiegu reakcji chemicznych i determinują ruchliwość ciała stałego. W doskonałej strukturze ciała stałego przesunięcie atomu czy cząsteczki jest utrudnione ze względu na odpychanie wywierane przez otoczenie. Jednak rzeczywiste ciała stałe posiadają defekty, takie jak przykładowo luki, które umożliwiają dyfuzję atomów. Dyfundujący atom pozostawia lukę w miejscu, które opuszcza, i z tego względu proces ten można rozpatrywać jako dyfuzję atomu lub też dyfuzję luki. W takim wypadku można wyróżnić obszary, w których ruchliwość elementów tworzących ciało stałe jest zwiększona. Należą do nich:
– otoczenia defektów punktowych,
– nieregularności w upakowaniu jednostek składowych ciała stałego, czyli dyslokacje i granice pomiędzy ziarnami,
– powierzchnie.
Idealna budowa krystaliczna jest związana z minimum energii dla danej struktury, jednak trwałość układu jest zdeterminowana przez jego energię swobodną, co implikuje możliwość wystąpienia struktur niedoskonałych stabilizowanych przez wzrost entropii. Z tego powodu w rzeczywistych kryształach występują defekty spowodowane czynnikami termodynamicznymi lub kinetycznymi. W kryształach występują trzy główne rodzaje defektów, które poniżej przedstawiono na przykładzie kryształów jonowych.
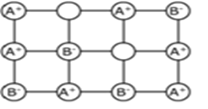 Defekty Schottky’ego
Defekty Schottky’ego
Defekt ten pojawia się wtedy gdy brak jest kationu i anionu w ciele stałym. Powstają wtedy gdy kation i anion opuszczają swoje miejsca w objętości kryształu i przenoszą się na powierzchnię kryształu. Struktura kryształu staje się nieuporządkowana, a wzrost entropii jest równoważony niewielkim obniżeniem energii sieci krystalicznej.
Defekty Frenkla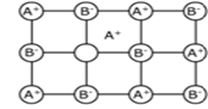
Powstaje wtedy gdy jon opuszcza swoje miejsce w sieci krystalicznej i przechodzi do pozycji międzywęzłowej. W wyniku tego pojawia się luka w pozycji węzłowej. Na ogół w pozycje międzywęzłowe wędrują kationy, co wynika z ich mniejszych rozmiarów niż anionów.
 Centra F
Centra F
Efekt ten wynika z nadmiaru kationów w sieci krystalicznej co pociąga za sobą obecność pewnej liczby pustych pozycji przeznaczonych dla anionów. Aby zapewnić lojalny bilans ładunku w miejscach gdzie powinny być aniony znajdują się pułapkowane elektrony. Przykładowo w krysztale KCl jon potasu dyfunduje stwarzając lokalny nadmiar jonów K+, a ładunek jest równoważony elektronami zajmującymi luki anionowe. Pułapkowane elektrony często silnie absorbują promieniowanie z zakresy widzialnego, co powoduje, że kryształy z takimi defektami są barwne.
Defekty punktowe takie jak luki Schottky’ego czy luki kationowe mogą dyfundować w obszarze ciała stałego. Dodatkowo zanieczyszczenia znajdujące się w przestrzeniach międzywęzłowych również wykazują się ruchliwością, której szybkość zależy od ich rozmiarów i ładunku.
Jednolita klasyfikacja reakcji w ciele stałym nie jest możliwa. Opracowano szereg systematyk. Biorąc pod uwagę stan skupienia substancji reagujących czyli substratów i produktów można reakcje w ciele stałym podzielić na 7 klas gdyż dwie substancje reagujące ze sobą w stanie stałym mogą dać w wyniku siedem produktów różniących się stanem skupienia. Oparcie klasyfikacji na liczbie składników i stanów skupienia prowadzi do utworzenia pięciu klas, które dzielą się na podklasy, typy i podtypy. Jednak tego rodzaju klasyfikacje nie uwzględniają mechanizmów zachodzących reakcji. Przyjmując za kryterium podziału chemiczny charakter substratów reakcji wyróżniono pięć klas:
- reakcje między tlenkami zasadowymi i kwasowymi;
- reakcje między węglanami lub siarczanami a tlenkami zasadowymi;
- reakcje wypierania dwutlenku węgla z węglanów przez tlenki kwasowe;
- reakcje podstawiania metalu w jego soli lub tlenku innym metalem;
- reakcje podwójnej wymiany między węglanami a siarczanami.
Innym podziałem jest klasyfikacja stosowana przy charakterystyce procesów metalurgicznych. Obejmuje ona trzy klasy:
- reakcje dwóch pierwiastków z utworzeniem ich związku;
- reakcje dwóch związków mających jeden wspólny składnik;
- reakcje dwóch związków nie mających wspólnego składnika.
Każda z tych klas dzieli się na podklasy w zależności od tworzenia lub nietworzenia roztworów stałych w reagującym układzie, oraz typy uzależnione od wzajemnego stosunku ruchliwości elementów strukturalnych substancji biorących udział w danej reakcji.
Kolejna klasyfikacja wyróżnia cztery klasy:
- reakcje, nie związane z przemianą sieci krystalicznej, obejmujące procesy chemisorpcji oraz tworzenia przez produkty reakcji roztworów stałych z substratami
- reakcje, w których z substancji niekrystalicznych powstaje faza krystaliczna;;
- reakcje prowadzące do zniszczenia sieci krystalicznej z utworzeniem faz ciekłych lub gazowych;
- reakcje, w których następuje zarówno niszczenie sieci krystalicznej jak i tworzenie nowej
Uwzględnienie kinetyki przebiegającego procesu prowadzi do klasyfikacji obejmującej również cztery grupy:
- reakcje zachodzące w obszarze kinetycznym, których szybkość jest warunkowana szybkością procesu chemicznego;
- reakcje zachodzące w obszarze dyfuzyjnym , których szybkość jest warunkowana dyfuzją reagujących składników;
- reakcje zachodzące w obszarze dyfuzyjno-kinetycznym, których szybkość jest zależna zarówno do procesów chemicznych jak i dyfuzyjnych;
- reakcje zachodzące w obszarze kinetycznym, których szybkość jest określona przez procesy krystalizacji.
Większość reakcji w fazie stałej można sprowadzić do odpowiedniej kombinacji procesów cząstkowych obejmujących:
- reakcję chemiczną;
- dyfuzję;
- parowanie i kondensację;
- topnienie;
- krystalizację.
Ponieważ procesy topnienia i krystalizacji zależą w głównej mierze od wymiany cieplnej, a przez to są one procesami szybkimi w porównaniu do pozostałych procesów cząstkowych, to reakcje w fazie stałej można podzielić na trzy grupy:
- reakcje, których szybkość jest uwarunkowana przebiegiem reakcji chemicznych;
- reakcje, których szybkość jest uwarunkowana przebiegiem reakcji dyfuzji;
- reakcje, których szybkość jest uwarunkowana przebiegiem parowania lub kondensacji.
Kinetyka danej reakcji w fazie stałej może zależeć na różnych etapach od przebiegu różnych przemian gdyż reakcje cząstkowe mogą być właściwymi reakcjami chemicznymi, jak i procesami przenoszenia masy czy energii lub tez procesami zmiany stanu skupienia. Z tego względu daną reakcję można zaliczyć do więcej niż jednej klasy czy grupy. Problemy z klasyfikacją reakcji w stanie stałym można zobrazować na przykładzie klasyfikacji reakcji rozkładu termicznego. Wydzielono dla tego typu reakcji dwie grupy, z których pierwsza to reakcje rozkładu zachodzące wskutek zerwania wiązań w ramach danej podsieci (kationowej lub anionowej). Grupa ta dzieli się na dwie podgrupy w zależności od odwracalności reakcji. I tak do pierwszej podgrupy zalicz się reakcje, w czasie których wydzielający się gaz może reagować z produktami rozkładu. Tego typu reakcje zachodzą zazwyczaj bez udziału stanów pośrednich. Druga podgrupa obejmuje reakcje nieodwracalne, których nieodwracalność jest najczęściej związana z występowaniem stanów pośrednich. Drugą grupę stanowią reakcje zachodzące wskutek przeniesienia elektronu od podsieci anionowej do kationowej. W takich przypadkach ulegają zniszczeniu obydwie podsieci. Ta grupa również została podzielona na dwie podgrupy, z których pierwsza obejmuje reakcje, w których przeniesienie elektronu zachodzi tylko w obrębie jednej podsieci. Druga podgrupa obejmuje reakcje zachodzące poprzez pośrednie etapy tworzenia rodników z jonów składających się na podsieć anionową lub kationową. Rodnik tworzący się w podsieci anionowej ulega przemianie w produkt końcowy przez rozerwanie wiązania w jego obrębie, lub w wyniku rekombinacji rodników, ewentualnie połączonej z rozerwaniem wiązań w ich cząsteczkach.
W wielu reakcjach zachodzących w stanie stałym istotne znaczenie, determinujące kierunek i szybkość procesu, ma kwasowość substancji reagujących. W związku z tym opracowano skalę kwasowości tlenków przyjmując, że najbardziej kwasowym jest tlenek krzemu, a najbardziej zasadowym tlenek wapnia. Kwasowość tlenków odnoszona jest do reakcji w wysokich temperaturach. Przy układaniu skali posłużono się definicja kwasowości według której kwasami są substancje mogące oddawać kationy lub przyłączać aniony, a zasadami te, które mogą odszczepiać aniony lub przyłączać kationy. Skalę kwasowości powiązano z elektroujemnością kationu tworzącego dany tlenek, a aim większa różnica pomiędzy kwasowościami reagujących substancji tym większa ich wzajemna reaktywność.