 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Tlen
Tlen
Odkrycie tlenu pod koniec XVIII wieku stało się kamieniem milowym na drodze rozwoju chemii. Przede wszystkim tlen pogrążył ostatecznie teorię flogistonu. Wnioski jakie wysnuwano z wyników badań eksperymentalnych, opierając się na tej teorii były nie tylko błędne, ale samo jej stosowanie prowadziło do trudności w zrozumieniu natury. Mimo faktu, że wodór i azot odkryto opierając się na teorii flogistonu to jednak dalszy rozwój chemii wymagał innego spojrzenia na naturę niż to jakie miała to zaoferowania ta teoria. W obronie flogistonu przeprowadzano i powtarzano szereg analogicznych doświadczeń polegających na spalaniu i wyprażaniu różnych metali uzasadniając zachodzące procesy pobieraniem „substancji” z powietrza. Przykładowo, w roku 1673 Robert Boyle badając kalcynację ołowiu i antymonu doszedł do wniosku, że podczas ogrzewania do metalu przechodzi „materia ignea” z powietrza, a próbka metalu w połączeniu z tą materią zwiększa swój ciężar. Osiemdziesiąt lat później Łomonosow stwierdził, że wniosek Boyle’a był błędny gdyż to cząsteczki powietrza podczas spalania substancji mieszają się z nią i dlatego masa próbki po wygrzewaniu się zwiększa.
W okresie gdy rozwinęła się „chemia pneumatyczna” francuski chemik Pierre Bayen w roku 1774 dyskutował problem wzrostu masy substancji podczas wygrzewania ich na powietrzu. Zgodnie z jego teorią podczas prażenia metalu swoisty rodzaj powietrza – fluid rozszerzalny – cięższy od powietrza dostaje się do metalu zwiększając jego ciężar. Bayen otrzymał swój fluid przeprowadzając termiczny rozkład związków rtęci, a następnie w wyniku reakcji fluidu z metaliczną rtęcią uzyskał czerwony związek. Niestety nie przeprowadził dalszych badań swojego fluidu, a przecież jak wiemy otrzymał on tlen, który w reakcji z rtęcią utworzył czerwony tlenek. W tym samym roku J. Priestley przeprowadzał eksperymenty z tymi samymi związkami rtęci. Nieco wcześniej dokonał odkrycia, że rośliny zielone umieszczone w środowisku „ustalonego powietrza”, nie nadającego się do oddychania, przekształcają je w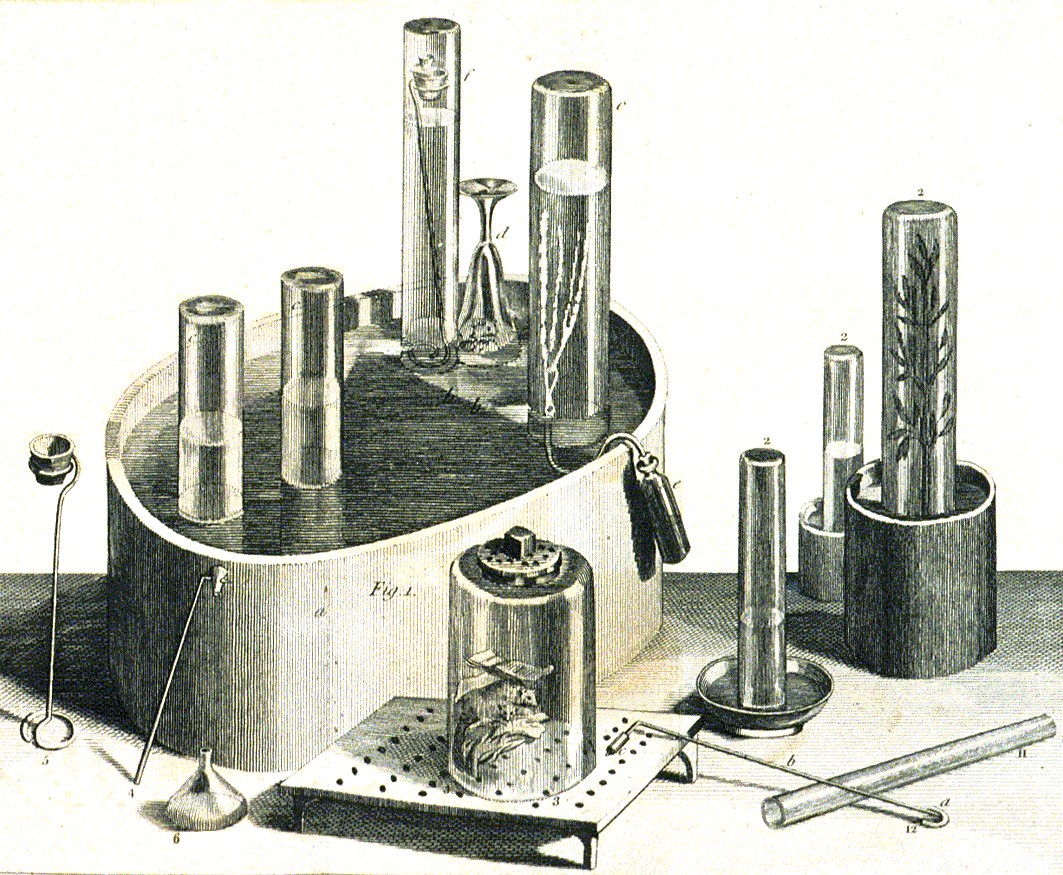 zwykłe powietrze, którym można oddychać.
zwykłe powietrze, którym można oddychać.
We wczesnych latach siedemdziesiątych osiemnastego wieku znany był „gaz saletrowy” czyli tlenek azotu, powstający w reakcji pomiędzy rozcieńczonym kwasem azotowym(V) i opiłkami żelaza. Priestley odkrył, że można go przekształcić w reakcji ze sproszkowanym żelazem w inną odmianę „powietrza”, w której możliwe jest spalanie substancji, ale oddychanie tym gazem jest niemożliwe. Z punktu widzenia współczesnej chemii wiemy, że odkrył on inny tlenek azotu – N2O – któremu zgodnie z teorią flogistonową nadał nazwę „pozbawiony flogistonu gaz saletrowy”.
Data 1 sierpnia 1774 roku jest przełomowa z punktu widzenia historii chemii. Tego dnia Priestley umieścił czerwony tlenek rtęci w zamkniętym naczyniu i wystawił go na działanie promieni słonecznych skupionych za pomocą dużej soczewki. Związek zaczął się rozkładać uwalniając metaliczną rtęć i gaz, który za kilka lat zostanie nazwany tlenem. Jak widać tlen nie został odkryty w atmosferze, jak azot, lecz wydzielony z ciała stałego. Okazało się, że uzyskany przez niego gaz doskonale nadaje się do oddychania. Odkrywca tak scharakteryzował ten nowo odkryty rodzaj powietrza: „pięć lub sześć razy lepsze do oddychania, palenia, i moim zdaniem, do każdego innego celu niż zwykłe powietrze”. Badając nowo odkryty gaz stwierdził, że nic się nie dzieje podczas mieszania go ze zwykłym powietrzem, ale mieszanina z „gazem saletrowym” powoduje powstawanie brunatnych dymów. Obecnie wiemy, że nastąpiło utlenienie tlenku azotu NO do dwutlenku azotu NO2, o ile tlenek jest bezbarwny to dwutlenek azotu ma barwę brunatną. Opierając się na teorii flogistonu nazwał ten nowy gaz „powietrzem odflogistonowanym”.
Po dokonaniu tego odkrycia Priestley udał się do Paryża gdzie zaprezentował swoje doświadczenie Lavoisierowi. Lavoisier docenił wagę odkrycia jednak proponował inne wyjaśnienie zachodzących procesów, oparte nie na teorii flogistonu. Niestety Priestley zdecydowanie obstawał za flogistonem i w związku z tym uznawał odkryty przez siebie gaz za substancję złożoną, a nie jak twierdził Lavoisier za substancję prostą. Według francuskiego uczonego eksperymenty Priestleya dowodzą, że powietrze jest mieszaniną substancji, a nie jest mieszaniną odkryty przez niego gaz. Anglik stał na stanowisku, że w „odflogistonowanym powietrzu” proces spalania zachodzi z większą gwałtownością gdyż jako pozbawione flogistonu może ono pochłonąć więcej „materia ignea”. Różnice zdań doprowadziły do wzajemnych animozji pomiędzy obydwoma uczonymi.
W historii odkrycia tlenu mamy dwóch naukowców P. Bayena i J. Priestleya. Jednak jest jeszcze trzeci badacz, który najprawdopodobniej odkrył tlen wcześniej, jednak opóźnił publikację wyników swoich eksperymentów i odkrycie tlenu przypadło komu innemu. Mowa o szwedzkim chemiku Carlu Scheele. Przed swoim odkryciem tlenu był oczywiście wyznawcą teorii flogistonu i badał powietrze. Badał reakcje zachodzące podczas ogrzewania saletry, dwutlenku manganu, azotanów metali ciężkich, węglanu srebra i tlenku rtęci otrzymując tlen prawdopodobnie w roku 1771. W yniki swoich badań opublikował w pracy złożonej do druku w roku 1775 w Szwecji i zatytułowanej „Chemische Abhandlung von der Luft und dem Feuer”, która ukazała się drukiem dopiero w roku 1777, czyli wtedy gdy doniesienia Priestleya i Lavoisiera były już opublikowane. Dodatkowo Scheele pisał w języku niemieckim, a angielskie tłumaczenie jego pracy ukazało się dopiero w roku 1780.
yniki swoich badań opublikował w pracy złożonej do druku w roku 1775 w Szwecji i zatytułowanej „Chemische Abhandlung von der Luft und dem Feuer”, która ukazała się drukiem dopiero w roku 1777, czyli wtedy gdy doniesienia Priestleya i Lavoisiera były już opublikowane. Dodatkowo Scheele pisał w języku niemieckim, a angielskie tłumaczenie jego pracy ukazało się dopiero w roku 1780.
Zgodnie z obowiązującą wtedy nomenklaturą Scheele nazwał odkryty przez siebie gaz „ognistym powietrzem” i zgodnie z teorią flogistonową twierdził, że odkryty przez niego nowy rodzaj powietrza w reakcji z flogistonem (wodorem w rozumieniu Scheele’go) produkuje światło i ciepło, czyli dwa podstawowe składniki materii. Jednak Scheele gdy dotarły do niego informacje, że inni chemicy badając reakcje pomiędzy tlenem i wodorem uzyskali wodę, zmodyfikował swoją teorię i uznał tlen za sól. Sól to kolejny składnik materii (zasada) w teoriach alchemicznych. Tlen Scheele’go stał się „zasadą solną” wody, a proces rdzewienia polega na tym, że żelazo reagując z tlenem („ogniste powietrze”) tworzy wodę, która dodaje się do metalu zwiększając jego masę.
Scheele badał też mieszaniny „ognistego powietrza” z innymi znanymi wówczas gazami. Po zmieszaniu „ognistego powietrza” z „zepsutym” czy też „szkodliwym powietrzem” Rutherforda stwierdził, że uzyskana mieszanina niczym nie różni się od zwykłego powietrza jakim oddychamy. Jednak oczywista dla nas wiedza, że powietrze jest mieszaniną gazów dla Scheele’go była niewyobrażalna, pomimo oczywistych faktów eksperymentalnych.
Ostatecznie kres teorii flogistonu położył Lavoisier. Przeprowadzając wiele eksperymentów związanych ze spalaniem i kalcynacją różnych substancji i odnosząc wyniki do obowiązującej teorii flogistonowej nie sposób było nie zauważyć pojawiających się nieścisłości, a wręcz sprzeczno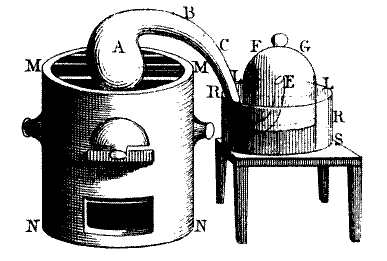 ści, jakie wynikały z opisu obserwacji w ramach tej teorii. Przeprowadzone przez Lavoisiera, i niezależnie Łomonosowa, doświadczenia polegające na spalaniu substancji w zamkniętych naczyniach pozwoliły na wysunięcie wniosku, że powietrze jest mieszaniną gazów. Wniosek ten był logiczną konkluzją z obserwacji, że po spaleniu substancji w określonej objętości powierza w naczyniu pojawia się podciśnienie. Początkowo Lavoisier przypuszczał, że gaz, który łączy się ze spalaną substancją jest tym, który J. Black nazwał „ustalonym powietrzem”. Jednak bardzo szybko zorientował się, że taki wniosek był błędny, ale sama idea pojmowania spalania jako łączenia się substancji z inną była rewolucyjna.
ści, jakie wynikały z opisu obserwacji w ramach tej teorii. Przeprowadzone przez Lavoisiera, i niezależnie Łomonosowa, doświadczenia polegające na spalaniu substancji w zamkniętych naczyniach pozwoliły na wysunięcie wniosku, że powietrze jest mieszaniną gazów. Wniosek ten był logiczną konkluzją z obserwacji, że po spaleniu substancji w określonej objętości powierza w naczyniu pojawia się podciśnienie. Początkowo Lavoisier przypuszczał, że gaz, który łączy się ze spalaną substancją jest tym, który J. Black nazwał „ustalonym powietrzem”. Jednak bardzo szybko zorientował się, że taki wniosek był błędny, ale sama idea pojmowania spalania jako łączenia się substancji z inną była rewolucyjna.
Wyniki swoich badań nad spalaniem różnych substancji w powietrzu przedstawił 20 października 1772 roku Akademii Francuskiej, pisząc że spalany fosfor pochłania bardzo dużą ilość powietrza tworząc w wyniku spalenia „kwaśnego ducha fosforu” oraz znacznie zwiększając swój ciężar. Pierwszego listopada, w nocie wysłanej do Akademii, rozszerza swoje obserwacje i wnioski pisząc o spalaniu siarki: „to co obserwuje się podczas spalania fosforu i siarki może mieć miejsce również w przypadku spalania innych substancji. Przypuszczam, że wzrost ciężaru metali poddawanych procesom kalcynacji ma również ten sam charakter”.
Łacińską nazwę tlenu – Oxygenium – zaproponował Lavoisier, a wynikała ona z tego, że uważano w tamtych czasach, że wszystkie kwasy zawierają w sobie właśnie ten pierwiastek. Oxygenium wywodzi się z dwóch słów greckich – oxy – kwaśny i – gennao –rodzę.
Lavoisier przeprowadzał też wiele eksperymentów z „palnym powietrzem” i „odflogistonowanym powietrzem” czyli wodorem i tlenem. Cavendish zauważył, że w wyniku spalania wodoru w tlenie powstaje woda jednak nie wyciągnął nasuwającego się wniosku o składzie tej pospolitej substancji. Podobnie postąpili i inni badacze tego okresu, jak Scheele, którzy próbowali wyjaśniać zachodzącą reakcję w oparciu o teorię flogistonową. Natomiast Lavoisier we współpracy z matematykiem Pierrem Simonem de Laplacem dokonał syntezy wody z pierwiastków w naczyniu zanurzonym w rtęci. Wyniki ilościowe były wystarczające do potwierdzenia jego teorii, że woda nie jest substancją prostą, alchemicznym i filozoficznym elementem pokutującym od ponad dwóch tysiącleci, lecz związkiem dwóch gazów wodoru i tlenu. Lavoisier i jego współpracownicy zapoczątkowali niezwykle istotny proces w badaniach naukowych dotyczących przyrody. Otóż byli oni pierwszymi naukowcami, którzy dokładnie ważyli substraty i produkty reakcji, które przeprowadzali. Dodatkowo reakcje zachodzące w fazie gazowej, a te były głównym przedmiotem „chemii pneumatycznej” przeprowadzali w zamkniętych szklanych naczyniach, z których gazy nie mogły się ulotnić. W roku 1774 Lavoisier wykazał, że materia chociaż ulega zmianie w czasie reakcji chemicznej, to całkowita masa reagentów przed i po zakończeniu reakcji pozostaje niezmienna. We Francji prawo zachowania masy nosi nazwę prawa Lavoisiera i jest podawane w formie będącej parafrazą z jego traktatu „Traité Élémentaire de Chimie” w postaci „Rien ne se perd, rien ne se crée, tout se transforme.”, czyli „Nic nie ginie, nic nie jest tworzone, wszystko się zmienia”. Nieco wcześniej analogiczne prawo sformułował Michaił Łomonosow i również potwierdził je na drodze eksperymentalnej, a inni badacze tego okresu, tacy jak J. Black czy H. Cavendish, swoimi eksperymentami położyli podwaliny umożliwiające powstaniu stechiometrii czyli działu chemii zajmującego się stosunkami ilościowymi przemian chemicznych, bez której nie byłby możliwy dalszy rozwój chemii jako dziedziny nauki.
Pozostała jeszcze sprawa do rozwiązania sprawa skomplikowanej nomenklatury, która ze względu na stosowanie kilku nazw tej samej substancji wprowadzała potworne zamieszanie. Wcześniej wspomnieliśmy o nazwach jakimi określano azot czyli „flogistonowe powietrze”, „szkodliwe powietrze” i „uszkodzone powietrze”, przy czym dwie ostatnie nazwy były używane przez uczonego, który odkrył ten gaz. W roku 1787 do Akademii Francuskiej wpłynął projekt opracowany przez grupę, w skład której wchodzili A. Lavoisier, L. B. Guyton de Morveau, C. Berthollet i A. Fourcroy. Przede wszystkim twórcy projektu nowej nomenklatury chemicznej odrzucili nieracjonalny pogląd na budowę materii składającej się z czterech żywiołów czyli ziemi, powietrza, ognia i wody a na jego miejsce wprowadzili 55 nowych substancji, których nie dało się metodami chemicznymi rozdzielić na prostsze. Oczywistym faktem jest, że zaproponowany, nowy system był oparty na nowej tlenowej teorii budowy materii Lavoisiera. Jako substancje proste występowały: światło, ciepło, zasady tlenowe, wodór, azot, węgiel, siarka, fosfor oraz nieznane jeszcze „rodniki” kwasów solnego, borowego i fluorowego, 17 metali, pięć ziem będących głównie tlenkami magnezu, baru i strontu, trzy wodorotlenki (sodowy, potasowy i amonowy) i 19 „rodników” kwasów organicznych. Rodnikami nazywane były nieznane jeszcze związki lub pierwiastki, których kwasy znano.
Nazwy kwasów zgodnie z nowym systemem, w którym były rozpatrywane jako związki danego pierwiastka z tlenem nosiły nazwy wskazujące na zawartą w nich ilość tlenu. I tak były kwasy siarkowy i siarkawy, fosforowy i fosforawy. Końcówkę –owy nadawano kwasom z większą ilością tlenu, a –awy zawierającym mniej tlenu. Podobnie wyglądało nazewnictwo soli, przykładowo siarczan miedzi i siarczyn miedzi. Końcówkę –an uzyskiwały sole kwasów o większej zawartości tlenu, a –yn o jego mniejszej zawartości. System był spójny i jednoznaczny, pomijając zaliczenie do substancji prostych światła i ciepła, a ponadto pozwalał w miarę odkrywania nowych związków nadawać im nazwy nie tylko w sposób zrozumiały ale, co istotne, jednolity. Jako przykład niech posłuży siarczan(VI) miedzi nazywany zgodnie z tym systemem siarczanem miedzi zamiast „witriolu Wenus”. Nazwa podana w nowej nomenklaturze jednoznacznie wskazuje z jaką substancją mamy do czynienia. Wiemy od razu, że jest to sól kwasu siarkowego i miedzi, natomiast witriol Wenus może być czymkolwiek co tylko zechcemy przypisać tej enigmatycznej nazwie. W ten sposób ostatecznie zakończyła się epoka alchemii, a chemia stała się nauką ścisłą.