 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Teoria wartościowości
Teoria wartościowości
Kolbe był zdania, że rodnik lub pierwiastek, z którym skoniugowana jest substancja, mają jedynie podrzędny wpływ na naturę związku. Zatem kwas octowy, HO + C2H3 ⁀ (C2O2)O jest podobny do kwasu węglowego, 2HO + (C2O2)O2 (C = 6; O = 8). Frankland w 1852 roku wykazał, że ta idea jest nieprawidłowa. Jeśli weźmie się pod uwagę związki metaloorganiczne, widać, że gdy arsen jest sprzężony z metylem, ten pierwszy zmienia swoją zdolność nasycenia. Podczas gdy arsen może łączyć się z pięcioma równoważnikami tlenu (O = 8), tworząc kwas arsenowy, AsO5, kakodyl może łączyć się tylko z trzema, tworząc kwas kakodylowy, (C2H3)2AsO3, który jest odporny na działanie silnych utleniaczy.
Połączenie metali z rodnikami węglowodorowymi zmienia zatem ich zdolności nasycania. Frankland mówi dalej: „Gdy bierze się pod uwagę wzory związków nieorganicznych, nawet powierzchowny obserwator zauważa ogólną symetrią ich budowy; związki azotu, fosforu, antymonu i arsenu wykazują tendencję tych pierwiastków do tworzenia związków zawierających 3 lub 5 równoważników innych pierwiastków, i właśnie w tych proporcjach ich powinowactwa są najlepiej zaspokajane; tak więc grupy zewnętrzne to NO3, NH3, NI3, NS3, PO3, PH3, PCl3, SbO3, SbH3, SbCl3, AsO3, AsH3, AsCl3, itd.; oraz NO6, NH4O, NHI, PO6, PH4I itd. Bez wysuwania jakiejkolwiek hipotezy dotyczącej przyczyny tego symetrycznego grupowania atomów, z podanych przykładów jest oczywiste, że taka tendencja lub prawo przeważają i że bez względu na to, jakie są cechy łączących się atomów, moc pierwiastka przyciągającego, jeśli można tak powiedzieć, jest zawsze zaspokojona przez tę samą liczbę tych atomów.” Należy zauważyć, że Frankland użył w swoich wzorach mas równoważnikowych.
Ta „moc łącząca” została następnie nazwana ekwiwalentnością lub wartościowością. Frankland zwrócił uwagę, na poglądy Gerhardta: „Tworzenie się i badanie ciał metaloorganicznych daje możliwość połączenia dwóch teorii, które tak długo dzieliły opinie chemików, które zbyt szybko uznano za niemożliwe do pogodzenia; ponieważ chociaż jest oczywiste, że istnieją pewne typy serii związków, równie jasne jest, że natura ciała pochodzącego z pierwotnego typu jest zasadniczo zależna od elektrochemicznego charakteru jego pojedynczych atomów, a nie tylko od pozycji względnej atomów.” To był ważny krok z dwóch powodów. Po pierwsze, starsza teoria rodników (w odróżnieniu od teorii reszt Gerhardta) została połączona z teorią typów, a po drugie, uwaga ponownie skupiła się na atomach jako prawdziwym decydującym czynniku zmian chemicznych, zamiast na rodnikach lub typach. Zniknęła także niejasna idea sprzężenia.
Idea Franklanda została opracowany i rozszerzona przez Kekulégo. Friedrich August Kekulé urodził się w 1829 r. w Darmstadt. W 1847 studiował architekturę na uniwersytecie w Giessen, natomiast wpływ Liebiga skierował jego uwagę na chemię. Studiował również pod kierunkiem Dumasa, korespondując z Gerhardtem. Będąc w Londynie jako asystent J. Stenhouse'a (przyjaźnił się z Williamsonem) dopracował swoją teorię struktury (architekturę molekularną). Jak powiedział później: „Początkowo byłem uczniem Liebiga, stałem się uczniem Dumasa, Gerhardta i Williamsona: teraz nie należę już do żadnej szkoły”. Był profesorem w Gandawie w 1858 r. i tam rozwinął swoją teorię benzenu; w 1867 r. przeniósł się do Bonn, gdzie zmarł w 1896 r.
Kekulé zrozumiał prawdziwe znaczenie wartościowości i uczynił ją głównym elementem swojej teorii budowy cząsteczek organicznych. W 1853 r., gdy przebywał w Londynie, odkrył, że pentasiarczek fosforu daje w reakcji z kwasem octowym kwas tiooctowy, i porównał wynik tej reakcji z reakcją pentachlorku fosforu:
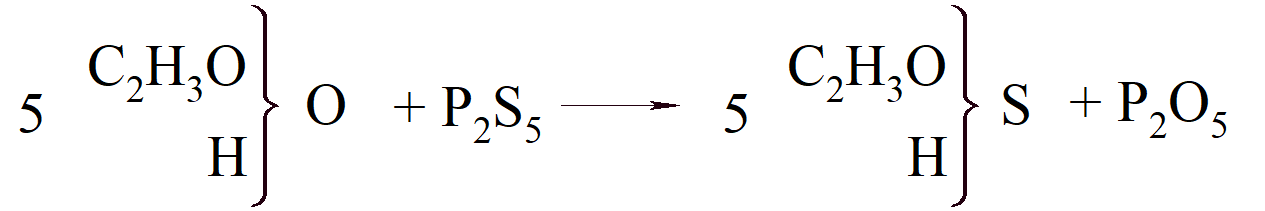
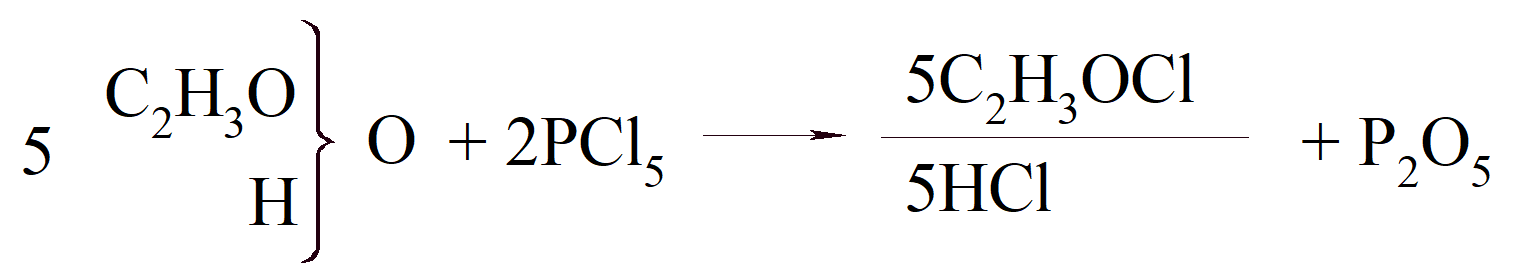
Podczas gdy w drugim przypadku produkt rozpada się, w pierwszym tak się nie dzieje, „ponieważ ilość siarki, która jest równoważna dwóm atomom chloru, nie jest podzielna”. Można to wytłumaczyć ciężarami atomowymi Gerhardta, „ponieważ siarka, podobnie jak sam tlen, jest dwuzasadowa (zweibasisch), dzięki czemu jeden atom jest równoważny dwóm atomom chloru”.
W 1857 r. Kekulé dodał do rodzajów Gerhardta gaz bagienny, ale zastosował go tylko do kilku związków; wrócił teraz do Niemiec i przyjął tam masy równoważnikowe (C = 6, 0 = 8, N = 14, Hg = 100):
Gaz bagienny C2HHHH
Chlorek metylu C2HHHCl
Chloroform C2HClClCl
Chloropikrynian C2(NO4)ClClCl
Piorunian rtęci C2(NO4)HgHg(C2N)
W. Odling podczas wykładu w Royal Institution w 1855 r. używał już tego typu wzorów, ale nie przyciągnęło to uwagi słuchaczy. W 1858 r. Kekule rozszerzył rodzaj gazu bagiennego na wszystkie związki węgla i ponownie przyjął masy atomowe Gerhardta, które reprezentował przekreślonymi symbolami C, O, H itp. „Ilość węgla, którą chemicy używali jako atomu zawsze łączy się z czterema atomami substancji jednoatomowej lub dwoma atomami pierwiastka dwuatomowego; ogólnie suma jednostek chemicznych pierwiastków połączonych z jednym atomem węgla wynosi 4.”
Kekulé uznał, że węgiel jest czterowartościowy (vierbasisch oder vieratomig), a także wprowadził fundamentalnie ważną koncepcję łączenia atomów węgla ze sobą. „W przypadku substancji, które zawierają kilka atomów węgla, należy przyznać, że przynajmniej niektóre atomy są utrzymywane w związku przez powinowactwo węgla i że atomy węgla łączą się ze sobą, przy czym część powinowactwo jednego jest naturalnie związana z równą częścią powinowactwa drugiego. Najprostszym, a zatem najbardziej prawdopodobnym przypadkiem takiego skojarzenia atomów węgla jest taki, w którym jedna jednostka powinowactwa jednego atomu jest związana z jedną jednostką drugiego. Z 2×4 jednostek powinowactwa dwóch atomów węgla, dwa są wykorzystywane do utrzymywania atomów razem; sześć pozostało, i mogą one być związane z atomami innych pierwiastków. Innymi słowy, grupa dwóch atomów węgla, C2, będzie heksatomowa i utworzy związek z sześcioma atomami pierwiastka monatomowego lub ogólnie z tak wieloma atomami, że suma ich jednostek chemicznych wynosi sześć.”
Dalej Kekulé mówi: „Muszę podkreślić, że nie uważam większości tych poglądów za pochodzące ode mnie, ale raczej jestem zdania, że oprócz wcześniej wymienionych chemików (Williamson, Odling, Gerhardt), którzy szczegółowo rozważali te sprawy a inni, zwłaszcza Wurtz, podzielali w zarysie te poglądy.” Pominięcie nazwiska Franklanda jest niezwykłe; Później Kekulé stwierdził: „O ile się nie mylę, to ja wprowadziłem ideę atomowości pierwiastków do chemii”. Oczywiście się mylił. Być może okoliczność, że uważał iż tak wiele jego teorii była wynikiem prac innych, skłoniła go, w dalszej części wykładu, do powiedzenia, że „przypisuje temu zagadnieniu jedynie podrzędną wartość.”
Kekulé podkreślał konieczność powrotu do atomów przy rozważaniu zdolności do łączenia: „natura rodników i ich związków musi wynikać z właściwości pierwiastków”. Wskazuje, że traktowanie podwójnego rozkładu Gerhardta jako typowej reakcji nie wystarcza, aby objąć nią wszystkie przypadki, i zaproponował następujące rodzaje reakcji chemicznych:
1. Bezpośrednia addycja: CO + Cl2 = COCl2.
2. Połączenie kilku cząsteczek przez przegrupowanie (Umlagerung) rodnika wieloatomowego:
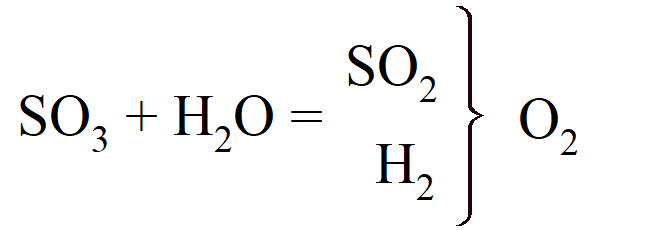
3. Zmiany, w których liczba cząsteczek (a w przypadku gazów objętości) pozostają takie same, tj. podwójne rozkłady, zwykle uważane za wymianę rodników, ale uważane przez Kekulégo za addycję połączoną z przegrupowaniem:
Wskazuje także na to, że działanie mas i siła katalityczna mają istotny wpływ na reakcje chemiczne. Zwykle siła, która powoduje asocjację cząsteczek (Aneinanderlagerung), również powoduje ich rozkład, ale zdarzają się też przypadki, w których to ostatnie nie zachodzi w odpowiednich warunkach, a produkt pośredni można wydzielić.
Czterowartościowość węgla została założona w 1858 r. niezależnie od Kekulé, przez Archibalda Scotta Coupera, urodzonego w Szkocji w 1831 r. Rysował również wiązania (dla których użył linii kropkowanych) łączących atomy oraz wzory strukturalne; tak więc (C = 12, O = 8):
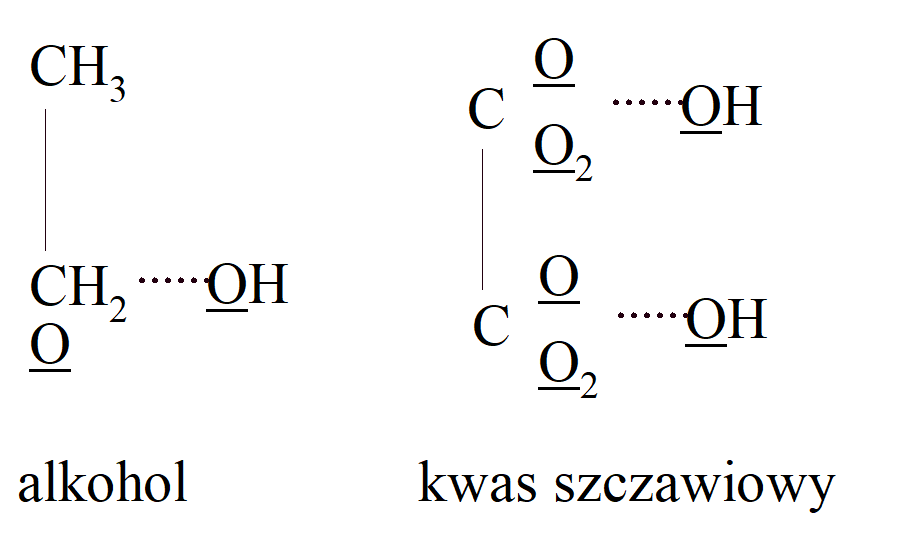
Wzór alkoholu A. S. Coupera możemy porównać ze wzorem Kolbego i współczesną:
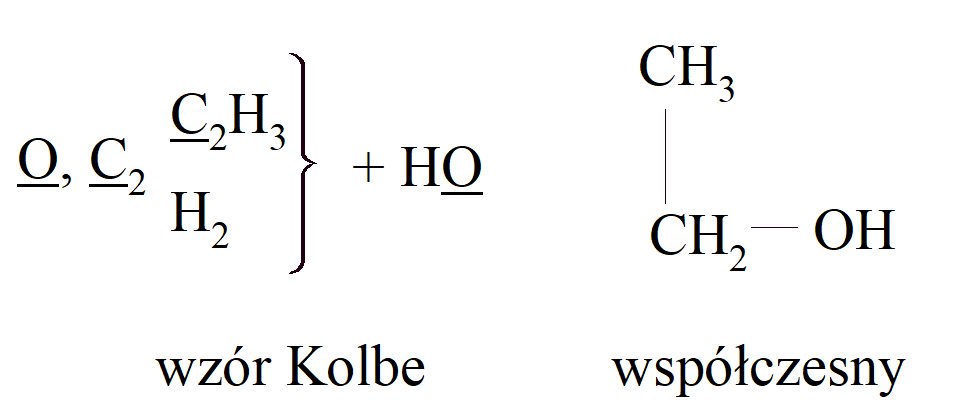
Couper przyjmował dwie wartościowości węgla, jedną w tlenku węgla i jedną w dwutlenku węgla: „najwyższą znaną mocą kombinacji węgla jest siła drugiego stopnia, tj. 4.” Frankland przyznał również, że wartościowość pierwiastka może się różnić, np. fosfor może mieć wartościowości 3 i 5, podczas gdy Kekulé uznał, że wartościowość jest stała, PCl5 na przykład, będący cząsteczkowym związkiem PCl3 i Cl2. Couper po powrocie do Szkocji zachorował co uniemożliwiło mu rozwinięcie swoich pomysłów.