 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Termodynamika - podstawowe pojęcia
Termodynamika - podstawowe pojęcia
W termodynamice, a szerzej w chemii fizycznej, wszechświat dzielimy na dwie części – układ i otoczenie. Układ jest tą częścią rzeczywistości, która interesuje nas w danym zagadnieniu, a rodzaj układu jest określony przez właściwości granicy jaka oddziela go od otoczenia. Jeżeli przez granicę pomiędzy układem a otoczeniem możliwy jest przepływ materii układ nazywamy otwartym. W przeciwnym wypadku układ jest układem zamkniętym. Obydwa rodzaje układów czyli otwarty i zamknięty mogą wymieniać energię z otoczeniem. Istnieje jeszcze jeden rodzaj układu ´ układ izolowany, który nie ma mechanicznego i energetycznego kontaktu z otoczeniem.
Podstawowymi pojęciami termodynamiki są praca i energia czyli zdolność wykonania pracy. Energia układu może zmieniać się nie tylko w wyniku wykonywanej pracy. Jeżeli energia układu zmienia się w wyniku różnicy temperatur pomiędzy układem a otoczeniem mamy do czynienia z przekazywaniem energii w postaci ciepła. Granice układu (np. ściany naczynia), które umożliwiają przekaz energii na sposób cieplny nazywamy diatermicznymi, a te które wymiany ciepła nie dopuszczają adiabatycznymi. Procesy, w których następuje uwalnianie energii w postaci ciepła noszą nazwę egzotermicznych, natomiast procesy w których pochłaniana jest energia w postaci ciepła noszą nazwę procesów endotermicznych. Przemiana endotermiczna w układzie diatermicznym zachodzi przy przepływie energii do układu w postaci ciepła. Przemiana endotermiczna w układzie adiabatycznym powoduje obniżenie temperatury układu, a w procesie egzotermicznym wzrost temperatury układu. W ujęciu cząsteczkowym ciepło jest formą przekazywania energii polegającym na chaotycznym ruchu cząsteczek. Praca jest natomiast przekazem energii związanym z uporządkowanym ruchem cząsteczek. Inaczej mówiąc praca jest przekazem energii powodującym uporządkowany ruch cząsteczek w układzie, a ciepło to przekaz energii wywołujący termiczny ruch w otoczeniu.
Energię układu określa jego energia wewnętrzna U, która jest suma energii kinetycznej i potencjalnej cząsteczek tworzących układ. Jeżeli układ przechodzi ze stanu początkowego o energii Up do stanu końcowego o energii Uk to zmianę energii definiuje się jako:
ΔU = Uk – Up
Energia wewnętrzna jest funkcją stanu w tym sensie, że jej wartość zależy jedynie od aktualnego stanu układu, a nie zależy od tego w jaki sposób stan ten został osiągnięty. Zmiana dowolnego parametru opisującego stan układu (np. ciśnienia) powoduje zmianę energii wewnętrznej. Energię wewnętrzną jednoatomowego gazu doskonałego wyraża równanie:
![]() gdzie Um(0) oznacza molową energię wewnętrzną w T = 0. 3/2RT jest średnią energią n atomów tworzących gaz. Z tego równania wynika, że energia wewnętrzna jednoatomowego gazu doskonałego rośnie liniowo z temperaturą. Dla gazu składającego się z cząsteczek wieloatomowych, które oprócz ruchów translacyjnych mogą wykonywać rotacje wokół trzech osi, energia kinetyczna wzrasta o czynnik 3/2kT. W takim wypadku energia wewnętrzna rośnie dwa razy szybciej z temperaturą niż w przypadku jednoatomowego gazu doskonałego. Uwzględnienie oscylacji cząsteczek tworzących gaz prowadzi do wzoru na energię wewnętrzną w postaci:
gdzie Um(0) oznacza molową energię wewnętrzną w T = 0. 3/2RT jest średnią energią n atomów tworzących gaz. Z tego równania wynika, że energia wewnętrzna jednoatomowego gazu doskonałego rośnie liniowo z temperaturą. Dla gazu składającego się z cząsteczek wieloatomowych, które oprócz ruchów translacyjnych mogą wykonywać rotacje wokół trzech osi, energia kinetyczna wzrasta o czynnik 3/2kT. W takim wypadku energia wewnętrzna rośnie dwa razy szybciej z temperaturą niż w przypadku jednoatomowego gazu doskonałego. Uwzględnienie oscylacji cząsteczek tworzących gaz prowadzi do wzoru na energię wewnętrzną w postaci:
 Jeżeli kT » hν to drugi człon tego równania zmierza do RT.
Jeżeli kT » hν to drugi człon tego równania zmierza do RT.
Pierwsza zasada termodynamiki
Energia wewnętrzna układu może się zmieniać poprzez wykonanie pracy nad układem albo poprzez jego ogrzanie. Ciepło i praca są równoważnymi drogami zmiany energii wewnętrznej układu. W układach izolowanych nie następuje zmiana energii wewnętrznej, a tym samym nie może on wykonywać pracy. Podsumowując powyższe stwierdzenia można zapisać:
ΔU = q + w
gdzie q oznacza energię przekazaną do układu w postaci ciepła, a w oznacza pracę wykonaną na układzie. Jest to równanie przedstawiające pierwszą zasadę termodynamiki. Z równania widać, ze energia wewnętrzna układu izolowanego (q = 0 i w = 0) jest stała. Zmiana energii układu zamkniętego jest równa energii jaka przepływa przez jego granice na sposób ciepła lub pracy.
Inne sformułowanie pierwszej zasady termodynamiki brzmi: Praca potrzebna do przejścia układu adiabatycznego z jednego wyróżnionego stanu w drugi, bez względu na rodzaj, jest taka sama. Z tego wynika, że mierząc pracę potrzebną do wywołania zmiany w układzie adiabatycznym uzyskujemy wartość zmiany energii wewnętrznej układu. Rozpatrując pracę jaką wykona układ gazowy podczas rozprężania się przeciw ciśnieniu zewnętrznemu możemy zapisać:
dw = –pdV
Znak minus wskazuje, że energia wewnętrzna układu wykonującego pracę ulega zmniejszeniu. Po scałkowaniu tego wyrażenia otrzymujemy:
 na pracę wykonaną przez układ przy zmianie objętości z V1 do V2. Inne rodzaje pracy opisywane są takimi samymi wzorami, przykładowo:
na pracę wykonaną przez układ przy zmianie objętości z V1 do V2. Inne rodzaje pracy opisywane są takimi samymi wzorami, przykładowo:
| Rodzaj pracy | dw | jednostka | |
| objętościowa | –pdV | p – ciśnienie zewnętrzne; dV – zmiana objętości |
Pa m3 |
| powierzchniowa | γdσ | γ – napięcie powierzchniowe dσ – zmiana pola powierzchni |
N·m–1 m2 |
| rozciągania | fdl | f – naprężenie dl – zmiana długości |
N m |
| elektryczna | φdq | φ – potencjał elektryczny dq – zmiana ładunku |
V C |
Wraz ze wzrostem temperatury układu rośnie jego energia wewnętrzna. Przyjmując, że układ nie zmienia swojej objętości w trakcie ogrzewania możemy zdefiniować wielkość zwaną pojemnością cieplną w stałej objętości, równa pochodnej cząstkowej po temperaturze z energii wewnętrznej układu:
 Tak zdefiniowana pojemność cieplna jest wielkością ekstensywną, czyli zależy od objętości układu. Intensywną wielkością jest molowa pojemność cieplna w stałej objętości.
Tak zdefiniowana pojemność cieplna jest wielkością ekstensywną, czyli zależy od objętości układu. Intensywną wielkością jest molowa pojemność cieplna w stałej objętości.
Jeżeli układ może zmieniać objętość to zmiana jego energii wewnętrznej nie jest równa ilości ciepła dostarczonego do układu. W takim wypadku dostarczone ciepło jest równe zmianie entalpii. Entalpię definiuje się jako:
H = U + pV
gdzie p jest ciśnieniem, V objętością układu. Ponieważ U, p i V zależą jedynie od aktualnego stanu układu to entalpia jest funkcją stanu. Entalpia jest równa ciepłu dostarczonemu do układu pod stałym ciśnieniem dopóki układ nie wykonuje żadnej pracy. Teraz możemy pojemność cieplną przedstawić w sposób analogiczny jak powyżej zastępując pochodną cząstkową energii wewnętrznej pochodną entalpii pod stałym ciśnieniem:
 Obydwa rodzaje pojemności cieplnej łączy prosta zależność spełniona dla gazu doskonałego:
Obydwa rodzaje pojemności cieplnej łączy prosta zależność spełniona dla gazu doskonałego:
Cp – CV = nRT
Zmiany energii wewnętrznej
Infinitezymalna zmiana energii wewnętrznej dU jest różniczką zupełną i dla układów zamkniętych o stałym składzie jest funkcją temperatury i objętości. W związku z tym zmianę energii wewnętrznej można zapisać w postaci:
![]() Z tego równania wynika, że w układzie zamkniętym o stałym składzie infinitezymalna zmiana energii wewnętrznej jest proporcjonalna do infinitezymalnych zmian objętości i temperatury, a współczynnikami proporcjonalności są odpowiednie pochodne cząstkowe. Druga pochodna cząstkowa w tym równaniu jest równa pojemności cieplnej w stałej objętości. Pierwsza pochodna nosi nazwę ciśnienia wewnętrznego (πV), które jest miarą sił kohezji. W przypadku gdy pomiędzy cząsteczkami w układzie występują oddziaływania, czyli energia wewnętrzna rośnie podczas izotermicznego rozprężania próbki (dV > 0), ciśnienie wewnętrzne jest dodatnie. Jeżeli brak jest oddziaływań pomiędzy cząsteczkami (gaz doskonały) to ciśnienie wewnętrzne jest równe zero i równanie przechodzi w standardowe pV = nRT.
Z tego równania wynika, że w układzie zamkniętym o stałym składzie infinitezymalna zmiana energii wewnętrznej jest proporcjonalna do infinitezymalnych zmian objętości i temperatury, a współczynnikami proporcjonalności są odpowiednie pochodne cząstkowe. Druga pochodna cząstkowa w tym równaniu jest równa pojemności cieplnej w stałej objętości. Pierwsza pochodna nosi nazwę ciśnienia wewnętrznego (πV), które jest miarą sił kohezji. W przypadku gdy pomiędzy cząsteczkami w układzie występują oddziaływania, czyli energia wewnętrzna rośnie podczas izotermicznego rozprężania próbki (dV > 0), ciśnienie wewnętrzne jest dodatnie. Jeżeli brak jest oddziaływań pomiędzy cząsteczkami (gaz doskonały) to ciśnienie wewnętrzne jest równe zero i równanie przechodzi w standardowe pV = nRT.
Rozpatrując zmianę energii wewnętrznej w zależności od temperatury pod stałym ciśnieniem znajdujemy, że pochodna δU/δT pod stałym ciśnieniem jest równa:
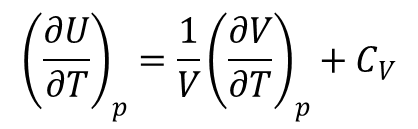 Różniczka po prawej stronie określa współczynnik rozszerzalności α. Duża wartość tego współczynnika oznacza, że objętość próbki zmienia się znacznie pod wpływem zmian temperatury.
Różniczka po prawej stronie określa współczynnik rozszerzalności α. Duża wartość tego współczynnika oznacza, że objętość próbki zmienia się znacznie pod wpływem zmian temperatury.
Druga zasada termodynamiki
Zgodnie z definicją podaną przez Kelvina drug zasada termodynamiki brzmi: Przemiana, której jedynym wynikiem jest pobranie ciepła ze zbiornika i jego całkowita zamiana w pracę jest niemożliwa. Z pierwszej zasady termodynamiki wynika, że energia układu w dowolnym procesie pozostaje zachowana. Z drugiej zasady wynika, że rozproszenie energii towarzyszące przemianom samorzutnym następuje w postaci bardziej nieuporządkowanej. Energia wewnętrzna wprowadzona pierwszą zasadą termodynamiki jest funkcją stanu., która pozwala określić czy dana przemiana jest dozwolona gdyż tylko takie przemiany mogą zachodzić, dla których energia wewnętrzna układu izolowanego jest stała. Druga zasada termodynamiki wskazuje kierunek przemian samorzutnych, który wyraża się za pomocą innej funkcji stanu noszącej nazwę entropii. i oznaczanej litera S. Druga zasada sformułowana przy użyciu entropii brzmi: W przemianach samorzutnych entropia układu izolowanego rośnie: ΔScałk > 0.
Termodynamiczna definicji entropii:
![]() jest powiązana z energią przekazywaną jako ciepło; dq we wzorze oznacza ciepło odwracalnego procesu zachodzącego w układzie. Dla każdej samorzutnej przemiany zmiany entropii opisuje nierówność Clausiusa:
jest powiązana z energią przekazywaną jako ciepło; dq we wzorze oznacza ciepło odwracalnego procesu zachodzącego w układzie. Dla każdej samorzutnej przemiany zmiany entropii opisuje nierówność Clausiusa:
![]() W układzie izolowanym dq = 0 i dS ≥ 0.
W układzie izolowanym dq = 0 i dS ≥ 0.
Teoremat cieplny Nernsta i trzecia zasada termodynamiki
W temperaturze T = 0K w idealnym krysztale wszystkie atomy lub jony tworzą jednorodną sieć, a wszelki ruch termiczny ulega wygaszeniu. W takim przypadku brak ruchów termicznych oraz brak nieporządku przestrzennego implikują zerową wartość entropii takiego kryształu. To ujęcie problemu entropii stanowi podstawę teorematu cieplnego Nernsta, zgodnie z którym:
Gdy temperatura zmierza do zera bezwzględnego, zmiana entropii towarzysząca dowolnemu procesowi fizycznemu lub chemicznemu dąży do zera, czyli ΔS → 0 gdy T → 0.
Z teorematu wynika treść trzeciej zasady termodynamiki:
Jeżeli entropię każdego pierwiastka w jego najbardziej trwałej postaci w T = 0 przyjmiemy za równą zero, to każda substancja ma entropię dodatnią, która w t = 0 może przyjmować wartość zero i która przyjmuje wartość zero dla wszystkich doskonale krystalicznych substancji , ze związkami chemicznymi włącznie.
Z definicji trzeciej zasady nie wynika, że entropia w zerze bezwzględnym jest równa zeru, a jedynie to, że w tej temperaturze wszystkie substancje doskonałe mają taką samą entropię. Wartość zero przyjęto w sposób arbitralny kierując się względami wygody. Teraz entropie wyznaczone po przyjęciu założenia, że S(0) = 0 nazywamy entropiami absolutnymi lub tez standardowymi. Analogicznie do standardowej entalpii, standardowa entropia reakcji ΔS° zdefiniowana jest jako różnica entropii pomiędzy czystymi rozdzielonymi produktami a czystymi rozdzielonymi substratami, przy czym wszystkie reagenty znajdują się w stanie standardowym dla danej temperatury.
Energia i entalpia swobodna
Rozpatrzmy układ, który w temperaturze T znajduje się w równowadze termicznej z otoczeniem. Gdy w układzie zachodzi przemiana, której towarzyszy przekazywanie energii na sposób cieplny pomiędzy układem a otoczeniem to:
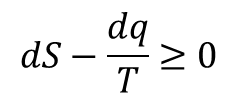 Jeżeli przekaz ciepła następuje w stałej objętości to dq = dU i wtedy kryterium przemiany samorzutnej przyjmuje postać:
Jeżeli przekaz ciepła następuje w stałej objętości to dq = dU i wtedy kryterium przemiany samorzutnej przyjmuje postać:
TdS ≥ dU (V = const., brak pracy objętościowej)
W przypadku gdy energia wewnętrzna układu lub jego entropia są stałe wyrażenie to przyjmuje postać:
dsU,V ≥ 0 i dUS,V ≤ 0,
gdzie indeksy oznaczają wartości stałe. Równania te podają kryteria przemian samorzutnych. Z pierwszego wynika, że w układach izolowanych (stała energia wewnętrzna i objętość) w przemianach samorzutnych entropia wzrasta. Z drugiego wynika, że jeżeli entropia i objętość układu jest stała to w wyniku przemiany samorzutnej energia wewnętrzna musi maleć. Nie należy tego rozumieć w ten sposób, że energia wewnętrzna układu maleje. Zgodnie z tym równaniem jeżeli entropia układu nie ulega zmianie to musi wzrastać entropia otoczenia. Energia jest przekazywana jako ciepło do otoczenia przez co energia układu maleje, a wzrasta entropia otoczenia..
Gdy przekazywanie ciepła z układu zachodzi pod stałym ciśnieniem to jedynym rodzajem pracy jest praca objętościowa. Wtedy dq =.dH i zależności powyższe przyjmują postać:
TdS ≥ dH (p = const., brak pracy nie objętościowej)
dSH,p ≥ 0 i dUH,p ≤ 0,
Interpretacja tych zależności jest analogiczna do tej podanej powyżej.
Powyższe równania można przedstawić prościej wprowadzając nowe wielkości termodynamiczne – energię swobodną A zwaną energią Helmholtza, zdefiniowaną jako:
A = U – TS
oraz entalpię swobodną (energię Gibbsa) G:
G = H – TS
Teraz kryteria dla przemiany samorzutnej można zapisać następująco:
dAT,V ≥ 0 i dGT,p ≤ 0,
Z tych zależności wynika, że układy zmieniają się samorzutnie gdy w trakcie procesu całkowita entropia układu i otoczenia rośnie, a nie dlatego, że wykazują tendencję do obniżania energii wewnętrznej. Dodatkowo zmiana energii wewnętrznej układu jest równa pracy maksymalnej jaką układ może wykonać. Jednocześnie maksymalna praca nie objętościowa jaką może wykonać układ jest równa zmianie entalpii swobodnej.
Relacje Maxwella
Równanie:
dU = TdS – pdV
wiąże pierwszą i drugą zasadę termodynamiki. Ponieważ jest to wyrażenie na różniczkę zupełną to korzystając z definicji możemy wskazać na równości wiążące poszczególne funkcje stanu:
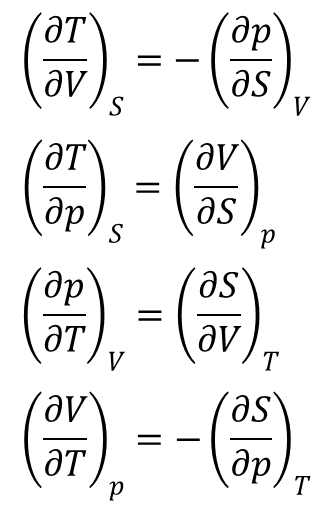
W podobny sposób można przedstawić zależności dla entalpii swobodnej:
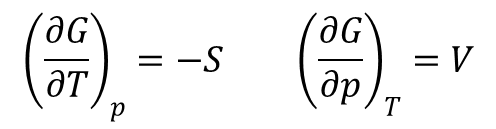 Związki te pokazują, że entalpia swobodna maleje gdy wzrasta temperatura pod stałym ciśnieniem i przy stałym składzie. Dodatkowo entalpia swobodna maleje szybciej gdy entropia układu jest duża.
Związki te pokazują, że entalpia swobodna maleje gdy wzrasta temperatura pod stałym ciśnieniem i przy stałym składzie. Dodatkowo entalpia swobodna maleje szybciej gdy entropia układu jest duża.
Z entalpią swobodną związana jest jeszcze jedna istotna wielkość zwana potencjałem chemicznym. Potencjał chemiczny substancji czystej określony jest wzorem:
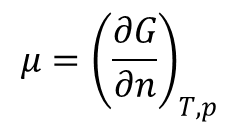 co oznacza, że określa on zmianę entalpii swobodnej układu gdy dodajemy do niego substancji. Dla substancji czystych jest to po prostu molowa entalpia swobodna.
co oznacza, że określa on zmianę entalpii swobodnej układu gdy dodajemy do niego substancji. Dla substancji czystych jest to po prostu molowa entalpia swobodna.