 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Cząsteczka dwuatomowa
Cząsteczka dwuatomowa
W teorii cząstek istotną rolę odgrywa fakt, że masy jąder są znacznie większe od masy elektronów. W związku z tym prędkość ruchu jąder jest mała w porównaniu z prędkością ruchu elektronów, co pozwala rozpatrywać ruch elektronów przy nieruchomych jądrach znajdujących się w stałych wzajemnych odległościach. Poziomy energetyczne takiego układu określane są nazwą termów elektronowych cząsteczki. W cząsteczce termy te są funkcjami odległości między jądrami. Energia termów zawiera w związku z tym człon energii elektrostatycznej oddziaływania jąder ze sobą. W cząsteczkach dwuatomowych termy są funkcjami tylko jednego parametru jakim jest odległość między jądrami. W atomach termy są klasyfikowane w zależności od wartości całkowitego orbitalnego momentu pędu. W cząsteczkach całkowity orbitalny moment pędu nie jest stałą ruchu gdyż pole elektryczne kilku jąder nie ma symetrii sferycznej. Natomiast w cząsteczkach dwuatomowych występuje symetria osiowa, w której oś symetrii przechodzi przez obydwa jądra. Z tego powodu zachowany jest rzut orbitalnego momentu pędu na tę oś i wartość tego rzutu stanowi podstawę klasyfikacji termów cząsteczkowych. Wartość bezwzględną rzutu orbitalnego momentu pędu oznacza się literą Λ, i przyjmuje ona wartości 0, 1, 2, ... . Termy o różnych wartościach Λ oznacza się dużymi literami greckimi, odpowiadającymi łacińskim symbolom termów atomowych. I tak gdy Λ = 0, 1, 2 mamy termy Σ, Π, Δ. Każdy stan elektronowy cząsteczki charakteryzuje się dodatkowo odpowiednim całkowitym spinem S elektronów w cząsteczce. Zaniedbując efekty relatywistyczne term elektronowy o spinie S jest 2S+1 krotnie zdegenerowany. Podobnie jak w przypadku termów atomowych krotność multipletu zapisujemy w indeksie górnym z lewej strony symbolu termu. I tak 3Π oznacza term o Λ = 1 i S= 1.
Symetria cząsteczki dwuatomowej oprócz obrotów o dowolny kat dookoła osi symetrii dopuszcza też odbicie w dowolnej płaszczyźnie przechodzącej przez tę oś. W wyniku takiego odbicia cząsteczka nie zmienia się, ale otrzymany w wyniku tej operacji stan nie będzie całkowicie identyczny z podstawowym, ponieważ ulega zmianie znak momentu pędu względem tej osi. W ten sposób wszystkie termy elektronowe o Λ różnym od zera są dwukrotnie zdegenerowane. Każdej wartości energii odpowiadają dwa stany różniące się kierunkiem rzutu orbitalnego momentu pędu na oś cząsteczki. Dla Λ = 0 stan cząsteczki nie ulega zmianie przy odbiciu, a w związku z tym termy Σ nie są zwyrodniałe. Jedyna zmiana jakiej podlega funkcja falowa termu Σ w wyniku odbicia polega na przemnożeniu przez pewną stałą. Ponieważ dwukrotne odbicie względem tej samej płaszczyzny prowadzi do przekształcenia tożsamościowego, to stała ta może mieć jedynie wartość ±1. W związku z tym należy rozróżnić funkcje falowe termów Σ, jedne z nich zmieniają znak przy odbiciu przez płaszczyznę, a drugie nie. Pierwsze oznacza się symbolem Σ+, a drugie Σ–.
Gdy cząsteczka jest zbudowana z dwóch takich samych atomów (homojądrowa) pojawia się nowy element symetrii – środek symetrii. W takim wypadku hamiltonian układu jest niezmienniczy względem zmiany znaku współrzędnych wszystkich elektronów (początek układu współrzędnych wybieramy w punkcie, w którym znajduje się środek inwersji) przy niezmienionych położeniach jąder. Operator takiego przekształcenia komutuje z operatorem orbitalnego momentu pędu, co prowadzi do klasyfikacji termów o określonych wartościach Λ ze względu na parzystość. Funkcja falowa stanów parzystych (g) nie zmienia się przy zmianie znaku współrzędnych elektronów, a nieparzysta (u) zmienia znak. Symbole g i u zapisuje się u dołu symbolu termu. Większość dwuatomowych cząsteczek w stanie podstawowym znajduje się w stanie 1Σ+, lub też gdy cząsteczka jest homojądrowa 1Σ+g. Wyjątkami są: cząsteczka tlenu O2, dla której term podstawowy to 3Σ–g i cząsteczka NO dla której stan podstawowy to 2Π.
Przecinanie się termów elektronowych
Termy elektronowe cząsteczek dwuatomowych są funkcjami odległości r pomiędzy jądrami. W związku z tym można je przedstawić graficznie w postaci wykresy zależności energii od r. Z tego powodu istotnym zagadnieniem jest przecinanie się krzywych przedstawiających różne termy. Jeżeli dwie funkcje U1(r) i U2(r) są różnymi termami elektronowymi i jeżeli przecinają się one w pewnym punkcie to w jego pobliżu obydwie funkcje U1 i U2 mają zbliżone wartości. Weźmy pod uwagę punkt r0, w którym U1(r) i U2(r) mają bliskie ale nie pokrywające się ze sobą wartości E1 i E2. Sprawdźmy, czy można uczynić funkcje U1 i U2 równymi sobie przez przesunięcie punktu r0 na odległość δr. Energie E1 i E2 są wartościami własnymi hamiltonianu Ĥ0 układu elektronów w polu jąder znajdujących się w odległości r0 od siebie. Zwiększając odległość r0 o δr zmieniamy hamiltonian na Ĥ0 + V, gdzie operator zaburzenia V = δrδĤ0/δr. Teraz wartości funkcji U1 i U2 w punkcie r0 + δr można uważać za wartości własne tego nowego hamiltonianu. Ponieważ traktujemy operat V jako zaburzenie to logicznym wydaje się próba wyznaczenia wartości termów U1(r) i U2(r) w punkcie r0 + δr za pomocą rachunku zaburzeń. Jednak Wartości własne energii E1 i E2 problemu niezaburzonego są bardzo bliskie siebie i ich różnica jest nieduża w porównaniu do wielkości zaburzenia, więc zastosowanie normalnego rachunku zaburzeń jest niemożliwe. W granicy E2 – E1 = 0 otrzymujemy przypadek zwyrodnienia wartości własnych. W związku z tym przyjmijmy, że φ1 i φ2 są funkcjami własnymi niezaburzonego operatora Ĥ0, którym odpowiadają energie E1 i E2. Teraz jako funkcje wyjściowe zerowego przybliżenia wybieramy ich kombinację liniową:
ψ = c1φ1+ c2φ2
i podstawiamy do równania z zaburzeniem:
![]() otrzymując:
otrzymując:
![]() Po przemnożeniu przez funkcje sprzężone ψ1* i ψ2* oraz scałkowaniu otrzymujemy:
Po przemnożeniu przez funkcje sprzężone ψ1* i ψ2* oraz scałkowaniu otrzymujemy:
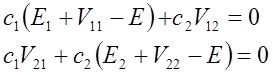 gdzie
gdzie
![]() Ponieważ operator zaburzenia jest hermitowski to wielkości V11 i V22 są rzeczywiste, a V12= V21*. Rozwiązania te mają rozwiązania c1 i c2 gdy spełniony jest warunek:
Ponieważ operator zaburzenia jest hermitowski to wielkości V11 i V22 są rzeczywiste, a V12= V21*. Rozwiązania te mają rozwiązania c1 i c2 gdy spełniony jest warunek:
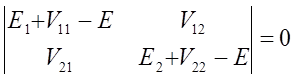 gdzie
gdzie
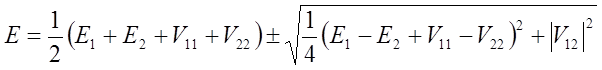 Są to szukane wartości własne energii w pierwszym przybliżeniu. Jeżeli wartości energii obu termów w punkcie r0 + δr zrównają się to obie wartości E określone powyższym wzorem są identyczne (termy się przecinają) i wyrażenie podpierwiastkowe znika. W takim wypadku warunek przecinania się termów określają równania:
Są to szukane wartości własne energii w pierwszym przybliżeniu. Jeżeli wartości energii obu termów w punkcie r0 + δr zrównają się to obie wartości E określone powyższym wzorem są identyczne (termy się przecinają) i wyrażenie podpierwiastkowe znika. W takim wypadku warunek przecinania się termów określają równania:
E1 – E2 + V11 – V22 = 0,
V12 = 0.
Równania są dwa, ale w rozważanym przypadku jest tylko jeden parametr dowolny określający zaburzenie i jest nim wielkość przesunięcia δr. W takim wypadku dwa równania nie mogą być jednocześnie spełnione.
Może się jednak zdarzyć sytuacja gdy element macierzowy V12 znika tożsamościowo i wtedy pozostaje tylko jedno równanie, które może być spełnione pod warunkiem wyboru odpowiedniego przesunięcia δr. Ma to miejsce wtedy gdy dwa rozpatrywane termy mają różne symetrie tak względem obrotów, odbić w płaszczyznach, inwersji jak i przestawień elektronów. Dla cząsteczki dwuatomowej oznacza to, że termy należą do różnych Λ, mają różną parzystość lub krotność multipletu, a dla termów typu Σ także różną symetrię względem odbić czyli Σ+ lub Σ–. Wynika to z tego, że operator zaburzenia, podobnie jak i sam hamiltonian komutuje ze wszystkimi operatorami symetrii cząsteczki. Z tego wynika, że wielkość skalarna, której operator komutuje z operatorami momentu pędu i inwersji ma elementy macierzowe różne od zera tylko dla przejść między stanami o tym samym momencie pędu i parzystości. W ten sposób stwierdzamy, że w cząsteczce dwuatomowej mogą przecinać się tylko termy o różnej symetrii.