 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
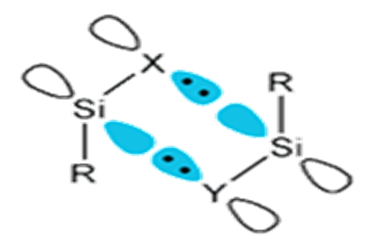 Symetria orbitali w reakcjach chemicznych
Symetria orbitali w reakcjach chemicznych
W szeregu reakcji, zwłaszcza katalitycznych, symetria orbitali reagujących cząsteczek biorących odgrywa istotną rolę w wyjaśnianiu mechanizmów. Weźmy pod uwagę typy reakcji jakie przedstawiono wcześniej i przyjrzyjmy się symetrii orbitali reagujących cząsteczek.
Przyłączanie utleniające
Mechanizm tego procesu polega zasadniczo na przyłączeniu do grupy MLn cząsteczki X–Y, w wyniku czego powstaje związek typu XYMLn. W cząsteczce powstającego związku można wyróżnić wiązania M–X i M–Y, a wiązanie X–Y jest osłabione. Przykładem takiego procesu może być reakcja PCl3 + Cl2 → PCl5, w której przyłączenie cząsteczki chloru jednoznacznie wskazuje na utlenienie fosforu. Natomiast w reakcji kationowego związku koordynacyjnego irydu [Ir(L)2]+ + H2 → [Ir(L)2H2]+, gdzie L jest ligandem difosfinowym, następuje nieznaczne przesunięcie gęstości elektronowej do ligandów wodorkowych przy jednoczesnym znacznym przemieszczenie elektronów w obrębie orbitali cząsteczkowych związku irydu. Oddziaływanie kationowego związku irydu z cząsteczką wodoru można przedstawić następującym schematem:
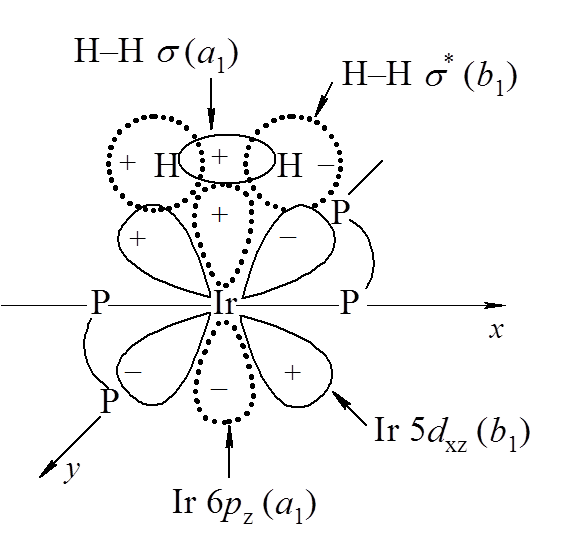 Wiązanie w cząsteczce wodoru jest osłabiane w wyniku mieszania orbitali dxz płasko kwadratowego związku irydu o konfiguracji d 8 z orbitalami σ* cząsteczki wodoru. Mieszanie orbitalu wiążącego σ wodoru z pustym orbitalem 6pz irydu powoduje dalsze osłabienie wiązania H–H. Wszystkie te orbitale posiadają symetrię a1 w grupie punktowej C2v. Powstające dwa wiązania Ir–H posiadają symetrię a1 + b1. W analogiczny sposób przebiega reakcja z cząsteczką tlenu przy czym uwzględnia się orbitale πz i π*z cząsteczki O2. Długość wiązania O–O w skoordynowanej cząsteczce tlenu jest większa niż w tlenie cząsteczkowym to można przyjąć, że albo nastąpiło przeniesienie gęstości elektronowej na antywiążący π* orbital tlenu, lub też usunięcie elektronów z wiążącego orbitalu π. Jeżeli przyjmiemy, że dwa elektrony z orbitalu dxz irydu zostały przeniesione do cząsteczki tlenu to formalnie iryd uległ utlenieniu do Ir(III).
Wiązanie w cząsteczce wodoru jest osłabiane w wyniku mieszania orbitali dxz płasko kwadratowego związku irydu o konfiguracji d 8 z orbitalami σ* cząsteczki wodoru. Mieszanie orbitalu wiążącego σ wodoru z pustym orbitalem 6pz irydu powoduje dalsze osłabienie wiązania H–H. Wszystkie te orbitale posiadają symetrię a1 w grupie punktowej C2v. Powstające dwa wiązania Ir–H posiadają symetrię a1 + b1. W analogiczny sposób przebiega reakcja z cząsteczką tlenu przy czym uwzględnia się orbitale πz i π*z cząsteczki O2. Długość wiązania O–O w skoordynowanej cząsteczce tlenu jest większa niż w tlenie cząsteczkowym to można przyjąć, że albo nastąpiło przeniesienie gęstości elektronowej na antywiążący π* orbital tlenu, lub też usunięcie elektronów z wiążącego orbitalu π. Jeżeli przyjmiemy, że dwa elektrony z orbitalu dxz irydu zostały przeniesione do cząsteczki tlenu to formalnie iryd uległ utlenieniu do Ir(III).
W podobny sposób może zachodzić przyłączanie utleniające w przypadku związków metali d 10–elektronowych o liczbie koordynacyjnej 2. W takim przypadku antywiążący orbital σ cząsteczki XY oddziałuje z obsadzonym orbitale d atomu metalu w związku ML2. Dozwolone jest przyłączenie cząsteczki XY w pozycji cis, gdyż w pozycji trans oddziaływanie orbitalu σ XY wymaga, ze względu na symetrię, uczestnictwa orbitalu dσ* , który jest skierowany w stronę wszystkich ligandów.
W przypadku wspomnianej powyżej reakcji cząsteczkowego chloru z PCl3 orbitale d z reguły nie występują, a najwyżej energetyczny orbital cząsteczkowy jest niewiążącym orbitalem zhybrydyzowanym utworzonym z orbitali s i p. W tym wypadku grupa XY musi zbliżyć się do cząsteczki EL3 w taki sposób aby mogło nastąpić oddziaływanie orbitalu σ* cząsteczki XY. W przypadku gdy cząsteczka XY zbliża wzdłuż osi trójkrotnej do cząsteczki EL3 nastąpi jedynie odpychanie wolnej pary elektronowej a wiążącym orbitalem XY. Ponieważ cząsteczka XY oddziałuje z orbitalami antywiążącymi σ* lub π* to muszą one posiadać niskie energie, co wskazuje jednoznacznie, że atomy X i Y muszą charakteryzować się dużą elektroujemnością.
 Migracja ligandów
Migracja ligandów
Migracja ligandu polega na przeniesieniu liganda od atomu centralnego i przyłączenia go do innego liganda w sferze koordynacyjnej. Dobrze przebadanym procesem tego typu jest migracja grupy metylowej w cząsteczce [(CH3)Mn(CO)5] przebiegająca według równania:
[(CH3)Mn(CO)5] → [(CH3CO)Mn(CO)4] + L → [(CH3CO)Mn(CO)4L], gdzie L jest dowolnym ligandem.
Grupa metylowa tworzy z cząsteczką CO ligand acylowy łączący się z manganem poprzez wiązanie σ Mn–C. W pierwszym etapie tej reakcji liczba koordynacyjna manganu zmniejsza się o jeden, a do niewysyconego koordynacyjnie związku pośredniego przyłącza się nowy ligand L. Grupa acylowa oraz ligand L znajdują się w pozycji cis względem siebie. Istotne jest, że grupa akceptorowa w tego typu reakcjach zawsze zawiera wiązanie podwójne. Orbitale biorące udział w tym procesie przedstawiono na schemacie:
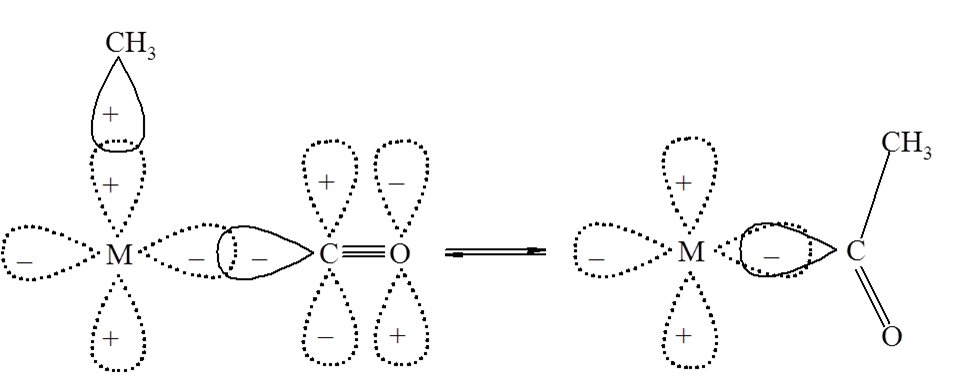 Wiążący orbital σ grupy metylowej oddziałuje z orbitalem dx2–y2 lub dz2 atomu centralnego, a funkcja falowa orbitalu σ skierowanego w stronę liganda L ma znak ujemny. Grupa metylowa migruje w kierunku dodatniego płata orbitalu π* cząsteczki CO, a ujemny płat tego orbitalu oddziałuje z orbitalem d atomu centralnego.
Wiążący orbital σ grupy metylowej oddziałuje z orbitalem dx2–y2 lub dz2 atomu centralnego, a funkcja falowa orbitalu σ skierowanego w stronę liganda L ma znak ujemny. Grupa metylowa migruje w kierunku dodatniego płata orbitalu π* cząsteczki CO, a ujemny płat tego orbitalu oddziałuje z orbitalem d atomu centralnego.
Podobna sytuacja występuje w przypadku migracji skoordynowanego ligandu do skoordynowanej cząsteczki alkenu. Tutaj odpowiednia (pionowa) orientacja cząsteczki alkenu umożliwia nakładanie się orbitali π* alkenu na orbital σ liganda i orbital d atomu centralnego. Powstający związek ma również konfigurację cis.
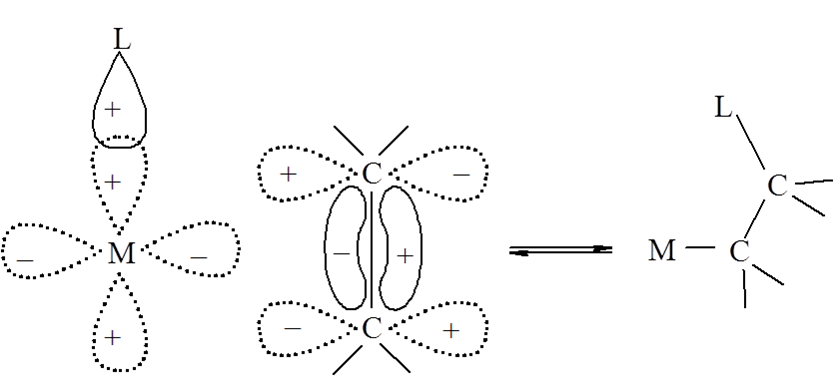 W przypadku obydwu tych reakcji do mieszania się orbitali dochodzi jedynie wtedy gdy ruchy jąder obniżą symetrię układu, inaczej mówiąc przebieg tych reakcji jest uzależniony od zaburzenia Jahna–Tellera drugiego rzędu. Analogiczny opis można stosować do reakcji, w których w związku metaloorganicznym z ligandem etylenowym atom wodoru przemieszcza się od liganda do metalu. Reakcje rozkładu związków koordynacyjnych z ligandami alkilowymi ulegają rozkładowi właśnie według takiej reakcji.
W przypadku obydwu tych reakcji do mieszania się orbitali dochodzi jedynie wtedy gdy ruchy jąder obniżą symetrię układu, inaczej mówiąc przebieg tych reakcji jest uzależniony od zaburzenia Jahna–Tellera drugiego rzędu. Analogiczny opis można stosować do reakcji, w których w związku metaloorganicznym z ligandem etylenowym atom wodoru przemieszcza się od liganda do metalu. Reakcje rozkładu związków koordynacyjnych z ligandami alkilowymi ulegają rozkładowi właśnie według takiej reakcji.
Weźmy pod uwagę reakcję, w której uczestniczy związek koordynacyjny, w którym wiązanie metal–ligand jest tworzone przy udziale orbitalu s atomu metalu. W takim przypadku nie jest możliwa bezpośrednia reakcja ligandu L z atomami węgla skoordynowanego alkenu. Jednak możliwy staje się atak nukleofilowy na atom C2 realizowany przez zewnętrzny atom N. W wyniku takiego ataku powstaje addukt o konfiguracji trans, nie zachodzi natomiast migracja ligandu L. Nie jest wykluczona, w tym przypadku, reakcja opisana powyżej chociaż dla związków koordynacyjnych wykorzystujących do worzenia wiązań M–L orbitale s reakcje migracji ligandów są wzbronione.
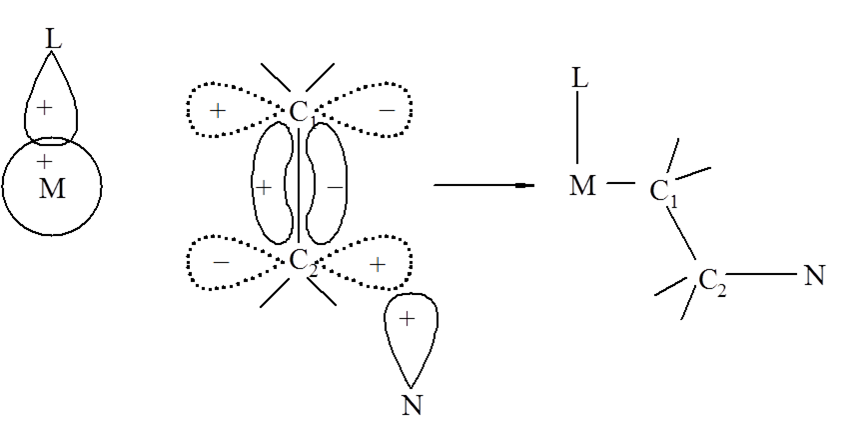 W wiązkach, w których do wiązania ligandów wykorzystywane są orbitale p nie ma takich ograniczeń.
W wiązkach, w których do wiązania ligandów wykorzystywane są orbitale p nie ma takich ograniczeń.