 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Wodór
Wodór
Odkrycie tego najlżejszego z gazów stanowiło niezbędny krok na drodze do rozwiązania wielu problemów chemii. Wodór jest pierwiastkiem, którego atom tracąc elektron staje się „gołym” protonem. A nade wszystko, chemia wodoru jest unikalna gdyż jest chemią cząstki elementarnej. D. Mendelejew nazwał wodór najbardziej typowym z typowych pierwiastków, mając na myśli to, że zaczyna on układ okresowy. Choć jest pierwiastkiem o unikalnych właściwościach to jego otrzymanie jest bardzo proste (wystarczy cynk i kwas solny), wykonywane praktycznie w każdym szkolnym laboratorium w ramach podstawowych zajęć z chemii. W czasach gdy chemia nie była jeszcze nauką, a istniała jako alchemia z jej poszukiwaniami kamienia filozoficznego, takie kwasy jak solny, siarkowy(VI) i azotowy(V) były znane. Dostępne były też metale jak cynk i żelazo, a w literaturze z okresu wieków XVI-XVIII znajdują się wzmianki, że alchemicy obserwowali wydzielanie się gazu podczas traktowania żelaza kwasem siarkowym(VI). Jednak nikt nie zadał sobie trudu sprawdzenia wydzielającego się gazu i uznawano go za palną odmianę powietrza.
Jednym z chemików obserwujących reakcje pomiędzy kwasami i metalami był Michaił Wasiljewicz Łomonosow, skądinąd prekursor chemii fizycznej, który w rozprawie z roku 1745 napisał: „rozpuszczanie niektórych metali w kwaśnych alkoholach prowadzi do powstawania palnego oparu wylatującego z otworu naczynia, który jest flogistonem”. Terminem „kwaśny alkohol” określano w tamtych czasach kwasy. Takie wyjaśnienie było zgodne z uznawaną w owych czasach teorią flogistonową, a roztwarzanie metalu w kwasie prowadziło do uwolnienia materia ignea czyli „palnej pary”. Jednak czas teorii flogistonowej z jej pokrętnym tłumaczeniem procesów przyrodniczych miał się ku końcowi. Nadszedł czas ekscentrycznego brytyjskiego uczonego Henry Cavendisha. Cavendish był samotnikiem i dziwakiem, stroniącym do ludzi. Nie miał przyjaciół, studia na Uniwersytecie Cambridge przerwał przed uzyskaniem dyplomu, i szczególną niechęć żywił do kobiet. Służba kobieca w jego domu musiała być niewidoczna, a dyspozycje dla służących zostawiał co rano w holu swojej posiadłości. Nie posiadał żadnych zainteresowań poza naukowymi i całe dnie spędzał we własnym laboratorium. Jego brak zainteresowania sławą spowodował, że większość z jego odkryć nie zostało opublikowane za jego życia. Ten fakt powoduje, że nie można dokładnie określić kiedy przeprowadził on badania dotyczące uwalniania gazów w reakcjach metali z kwasami. W każdym razie opis doświadczeń został opublikowany w roku 1766, ale biorąc pod uwagę, że zwykł on czekać z zapoznaniem opinii innych naukowców z wynikami swoich badań bez końca, należy przypuszczać, że eksperymenty przeprowadził lata wcześniej. Jego badania prowadzone w zakresie „chemii pneumatycznej” koncentrowały się na różnych rodzajach „powietrza” zawartego w związkach chemicznych w formie związanej i możliwościach jego wydzielenia. Zdając sobie doskonale sprawę z faktu, że wielokrotnie obserwowano wydzielanie gazu w reakcjach pomiędzy metalami i kwasami, Cavendish kolejny raz przeprowadził reakcje pomiędzy kwasami siarkowym(VI) i solnym i takimi metalami jak: żelazo, cynk i cyna, po raz pierwszy stwierdzając, że we wszystkich reakcjach produkt gazowy był tą samą substancją. Jednak, podobnie jak Łomonosow, opierając się na teorii flogistonowej opisał ten gaz jako „palne powietrze”. Podobnie jak Black odkrywca dwutlenku węgla, tak Cavendish odkrywca wodoru nie zdefiniował tych gazów w sposób właściwy. Natomiast zasługą 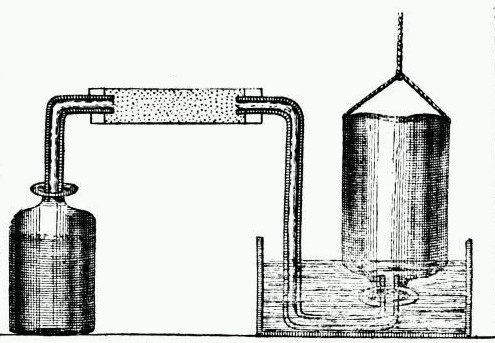 Cavendisha jest zbadanie właściwości fizycznych wydzielającego się gazu. Swoje eksperymenty przeprowadzał w sposób pozwalający mu na zbieranie gazu, a tym samym ważenie, wyznaczenie ciężaru właściwego i co najistotniejsze stwierdzenie palności tego gazu.
Cavendisha jest zbadanie właściwości fizycznych wydzielającego się gazu. Swoje eksperymenty przeprowadzał w sposób pozwalający mu na zbieranie gazu, a tym samym ważenie, wyznaczenie ciężaru właściwego i co najistotniejsze stwierdzenie palności tego gazu.
To co istotne, to fakt, że tak wodór Cavendisha jak i dwutlenek węgla Blacka różnią się od powietrza, które nas otacza jak i różnią się od siebie. Ponieważ Cavendish ważył gazy wydzielające się w badanych reakcjach, a znając ich objętość mógł wyznaczyć wartość liczbową, którą określił jako gęstość. To właśnie jemu zawdzięczamy wprowadzenie pojęcia gęstości gazu jako wartości charakteryzującej gazy. Przyjmując wartość gęstości powietrza za równą jeden, określił, że gęstość uzyskanego wodoru wynosi 0.09, a dwutlenku węgla 1.57. Tu pojawiła się wewnętrzna sprzeczność pomiędzy Cavendishem eksperymentatorem i Cavendishem wyjaśniającym zjawiska na gruncie teorii flogistonowej. Ponieważ w reakcjach pomiędzy metalami i kwasami uzyskiwał flogiston, który z założenia powinien być pozbawiony masy to otrzymywany gaz nie może być czystym flogistonem. Dodatkowo metale tracąc flogiston powinny stawać się lżejsze. Chcąc wybrnąć z mętliku jaki powodowała niezgodność eksperymentu z teorią zaproponował hipotezę, że otrzymywany w reakcjach gaz jest mieszaniną flogistonu i wody. Niemożność uwolnienia się od teorii flogistonu nie pozwoliła Cavendishowi dojść do wniosku, że otrzymany przez niego gaz jest nowym, nieznanym pierwiastkiem pomimo, że dokonał on jego charakterystyki, podając gęstość, właściwości fizyczne i stwierdzając jego różność od powietrza. Jednak niezwykle silne oparcie na błędnej teorii podstawowej doprowadziło w konsekwencji do stworzenia równie błędnego wyjaśnienia danych eksperymentalnych.
Stwierdzenie, że wodór został odkryty przez Cavendisha w roku 1766 wydaje się mylące z punktu widzenia dzisiejszego pojmowania odkrycia. Faktem jest, że opisał on sposób otrzymywania i określił właściwości wodoru, jednak można powiedzieć, patrząc z perspektywy lat, że „nie wiedział co robi”. Minie jeszcze wiele lat od eksperymentów Henry’ego Cavendisha, zanim opisany przez niego gaz stanie się wodorem i zajmie odpowiednie miejsce w szeregu pierwiastków chemicznych.
Łacińska nazwa wodoru – hydrogenum – wywodzi się z dwóch greckich słów hydro i gennao oznaczających „tworzący wodę”. Nazwę zaproponował w roku 1779 A. Lavoisier po tym jak skład wody został określony. Symbol wodoru – H – oczywiści wywodzący się jak wszystkie z nazwy łacińskiej został zaproponowany przez J. Berzeliusa
Wodór jest zadziwiającym pierwiastkiem gdyż jego izotopy, deuter i tryt, posiadają właściwości fizyczne i chemiczne odróżniające je od najbardziej rozpowszechnionego izotopu . Z chwilą odkrycia izotopów wodoru i stwierdzenia różnic we właściwościach fizykochemicznych uważano, że są one odrębnymi pierwiastkami i poszukiwano dla nich miejsca w układzie okresowym pierwiastków. Odkrycie izotopów wodoru chociaż znacznie późniejsze niż odkrycie wodoru to jednak stanowi kontynuację jego historii i warto o niej wspomnieć w tym miejscu. Rozpoczęła się ona na początku XX wieku jednak ówczesne badania nie pozwoliły na stwierdzenie występowania odmian izotopowych tego pierwiastka. Uznano, że wodór nie posiada odmian izotopowych. Jednak w roku 1931 pojawiła się sugestia, że wodór posiada izotop o masie atomowej równej 2 i rozpoczęły się próby wyizolowania tej odmiany metodami fizycznymi. W roku 1932 trzej amerykańscy uczeni Harold Clayton Urey, Ferdinand Graft Brickwedde i Georg M. Murphy odparowując ciekły wodór i badając pozostałość metodami spektroskopowymi stwierdzili na drodze eksperymentalnej występowanie ciężkiej odmiany wodoru – deuteru – . Występowanie tego izotopu w atmosferze stwierdzono dopiero w roku 1942. Deuter może zastępować prot, zwykłą odmianę wodoru, w związkach chemicznych i przykładowo w 1 litrze wody morskiej znajduje się około 0,02 g deuteru. Jądro deuteru składa się z jednego protonu i jednego neutronu, przez co jego masa wynosi nieco ponad 2, dokładnie 2,0140 jednostek masy atomowej. Nazwa deuter wywodzi się od greckiego słowa deuteros oznaczającego drugi, następny. Trzeci, radioaktywny izotop – tryt – którego jądro składa się z protonu i dwóch neutronów, został odkryty w 1934 roku przez Marcusa Oliphanta, Paula Harteca i Ernesta Rutherforda. Zawartość trytu w atmosferze jest śladowa, choćby ze względu na niestabilność jądra tego izotopu. O ile tryt występuje w atmosferze ziemskiej powstając w wyniku oddziaływania promieniowania kosmicznego z atmosferą to kolejne izotopy wodoru aż do zostały wytworzone sztucznie, a okresy połowicznego rozpadu charakteryzujące te izotopy są bardzo krótkie. Okres połowicznego rozpadu dla trytu wynosi 12,32 lat co jest długim czasem w porównaniu z czasami połowicznego rozpadu kolejnych cięższych izotopów wodoru liczonych w okresach wynoszących 10-22 sekundy.