 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
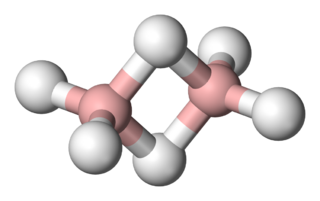 Cząsteczki z niedoborem elektronów
Cząsteczki z niedoborem elektronów
W cząsteczkach z niedoborem elektronów występują wiązania, których nie można zaklasyfikować do typów opisanych na poprzednich stronach. W cząsteczkach tych związków wszystkie atomy sąsiadujące ze sobą są pozornie powiązane zwykłymi wiązaniami kowalencyjnymi z tym, że ilość elektronów jest niewystarczająca do utworzenia wymaganej liczby par elektronowych. Inaczej mówiąc liczba elektronów walencyjnych jest mniejsza niż podwojona liczba wiązań. Pierwszymi związkami, w których zwrócono uwagę na występowanie tego zjawiska były borowodory, ale podobne układy zostały otrzymane dla takich pierwiastków jak beryl i glin. Fakt, że związki takie powstają dla pierwiastków grup 2 i 3 wynika z tego, że na powłoce walencyjnej atomów tych pierwiastków występują "puste miejsca". W przypadku zaangażowania w tworzenie wiązań orbitali s i p powłoki walencyjnej atomy berylu i boru dysponują czterema orbitalami, które mogą tworzyć wiązania, ale tylko dwoma (Be) lub trzema (B) elektronami. W przypadku związków koordynacyjnych jak na przykład BF42–, który ma budowę tetraedryczną, możemy przypuszczać, że dwa elektrony zostały przeniesione z fluoru na atom berylu i w ten sposób obsadzone zostały zhybrydyzowane orbitale sp3, które utworzyły wiązanie kowalencyjne z atomami fluoru. Natomiast nie można tego oczekiwać w przypadku połączeń boru z wodorem. Oczywiście w przypadku związków pierwiastków grupy pierwszej również można oczekiwać powstawania związków z niedoborem elektronów. Jednak posiadanie przez nie jednego elektronu walencyjnego powoduje, że uprzywilejowana formą wiązania chemicznego w ich związkach jest wiązanie jonowe lub metaliczne. Największą grupę związków z niedoborem elektronów tworzą pierwiastki grupy trzeciej.
Najprostszym przedstawicielem borowodorów jest diboran – B2H6. Początkowo sądzono, że ma on budowę analogiczną do cząsteczki etanu i zapisywano jego wzór w formie BH3•BH3 pomimo tego, że rodnik BH3 nie jet znany. Liczba elektronów walencyjnych w tym związku wynosi 12, co nie wystarcza do utworzenia siedmiu typowych wiązań tworzonych przez pary elektronowe. Dodatkowo ustalono, że budowa cząsteczki tego związku jest płaska, czyli cząsteczki BH2 leżą w jednej płaszczyźnie tak jak to widać na rysunku u góry strony. Obydwa atomy boru są połączone mostkowymi wiązaniami, z których każde zawiera atom wodoru leżące pod i nad płaszczyzną. Taka budowa geometryczna nie zgadzała się z koncepcją jej budowy analogicznej do etanu i wysunięto przypuszczenie, że diboran może być analogiem etylenu, w którym wiązanie podwójne zostało zastąpione dwoma protonami. Jednak takie podejście nie zgadzało się z właściwościami cząsteczki diboranu. Otóż długość wiązania podwójnego jest nieco większa niż występująca w diboranie, a ponadto cząsteczka diboranu nie wykazuje charakteru kwaśnego, który powinien występować w przypadku cząsteczki zawierającej dwa atomy wodoru praktycznie pozbawione elektronów (mostkowe atomy H). Rozwiązaniem problemu okazało się wprowadzenie do opisu wiązań mostkowych w tej cząsteczce orbitali cząsteczkowych składających się z atomowych orbitali boru i wodoru. Takie podejście zapewniło mostkowym atomom wodoru odpowiednią gęstość elektronową. Jednocześnie twórcy tej koncepcji wiązania pokazali, że można skonstruować funkcję falową ze zlokalizowanymi orbitalami cząsteczkowymi typu σ i π, z których dwa zostały przedstawione na rysunku.
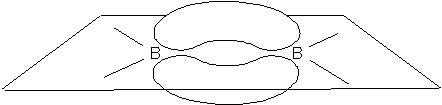 Trójcentrowe orbitale zlokalizowane wiązań mostkowychWprowadzenie tego rodzaju wiązań w cząsteczce związku bardzo dobrze opisywało jej właściwości.
Trójcentrowe orbitale zlokalizowane wiązań mostkowychWprowadzenie tego rodzaju wiązań w cząsteczce związku bardzo dobrze opisywało jej właściwości.
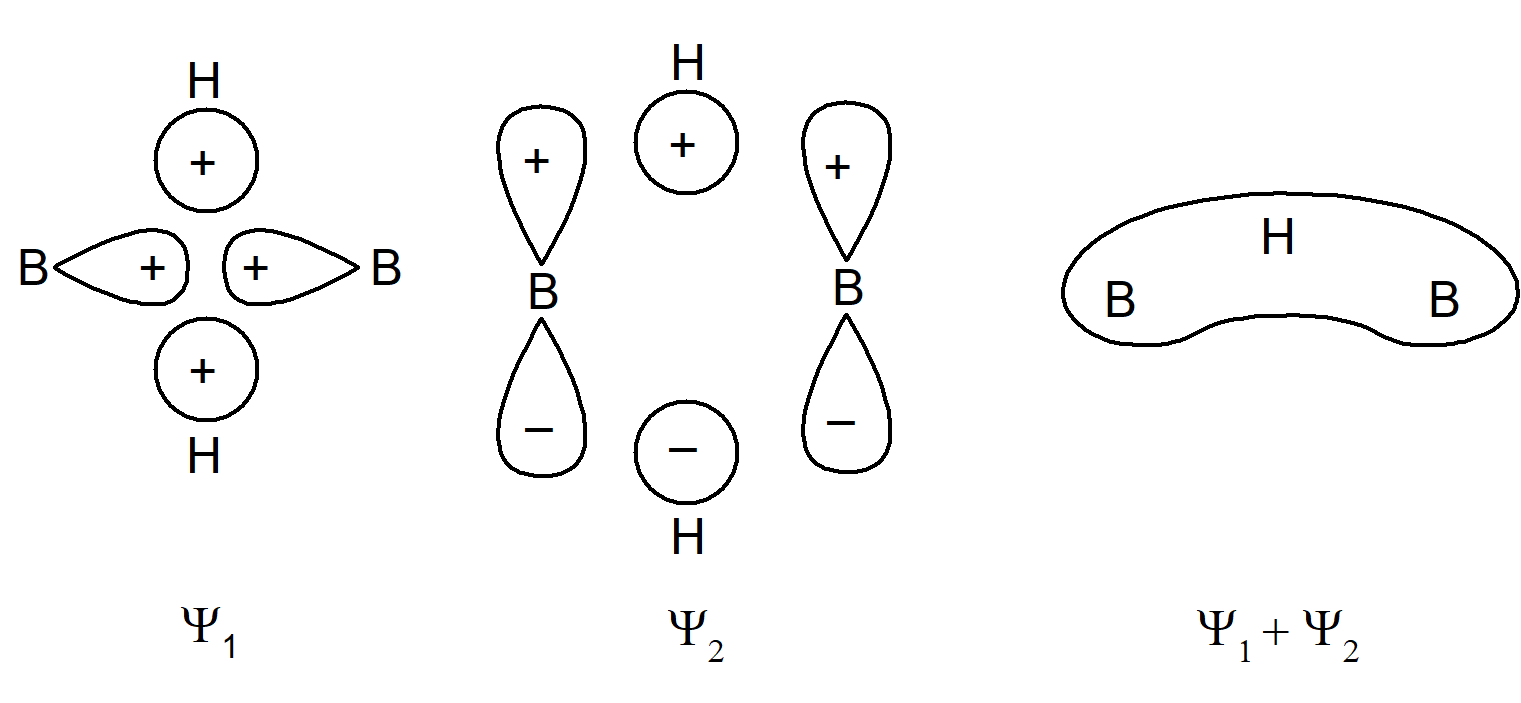
Przedstawmy bardziej szczegółowo powstawanie tego typu wiązania. Budowę cząsteczki B2H6 przedstawia poniższy rysunek:
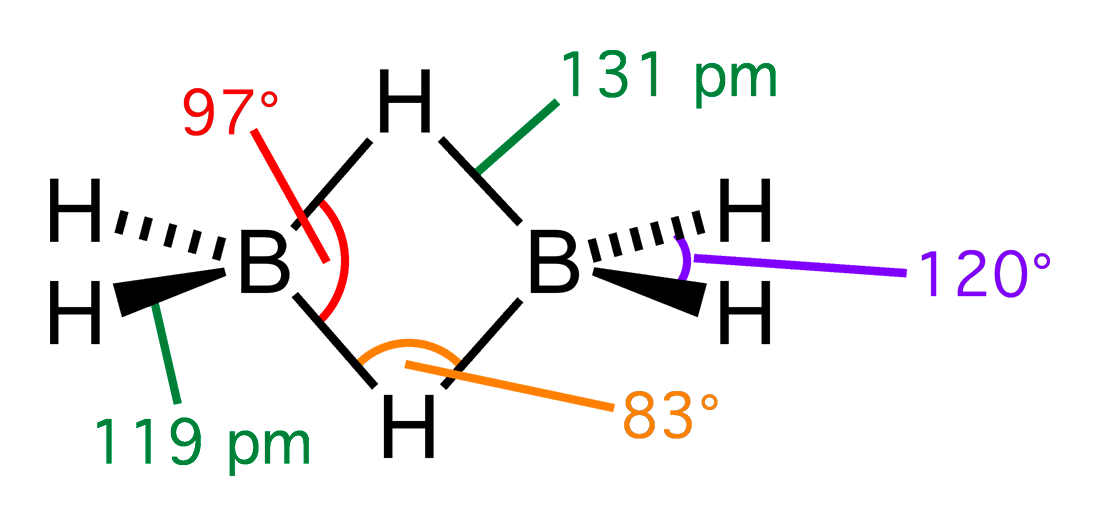
Orbitale atomowe diboranu(6) można przedstawić następująco:
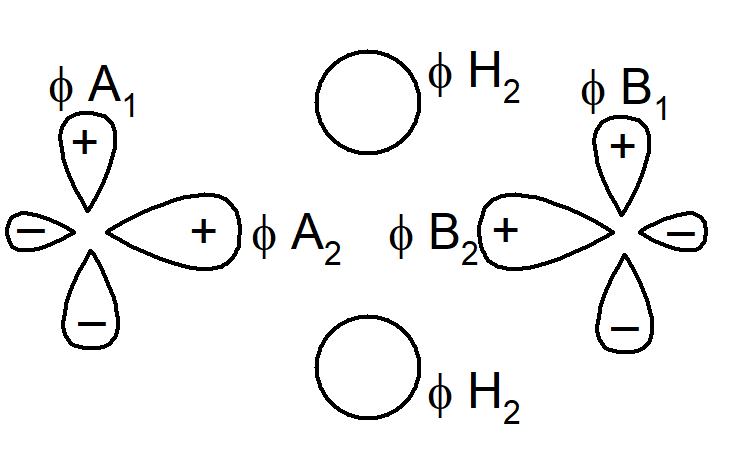
Z chemicznego punktu widzenia terminalne wiązania B–H nie wykazują żadnych odstępstw, w związku z czym można uprościć omawianie cząsteczki zakładając, że te wiązania mają typowy dwuelektronowy charakter. Ponadto wartość kąta H–B–H równa 120° sugeruje, że terminalne wiązania B–H są tworzone przez atom boru o hybrydyzacji sp2. W wiązaniach, w których udział biorą mostki wodorowe należy brać pod uwagę: zhybrydyzowane orbitale sp2 boru (oznaczone na rysunku jako fA2 i fB2) nie uczestniczące w wiązaniu końcowych atomów wodoru, orbitale p, które nie partycypują w orbitalach zhybrydyzowanych (φA1 iφfB1), oraz dwa orbitale mostkowych atomów wodoru (φH1 i φH2). Mamy zatem 6 orbitali, które w polu o symetrii D2h mogą ulegać rozszczepieniu. Pomijając rozszczepienie zauważmy, że φA2 i φB2 oraz kombinacja (φH1 + φH2) są symetryczne względem obrotu wokół osi B–B, podczas gdy φA1, φB1 oraz kombinacja (φH1 – φH2) są antysymetryczne. W związku z tym te dwa zbiory orbitali będą wzajemnie ortogonalne. W obrębie tych kombinacji trzy orbitale utworzą wiążące, niewiążące i antywiążące orbitale cząsteczkowe. Orbitale wiążące i niewiążące zostały przedstawione na poniższym schemacie:
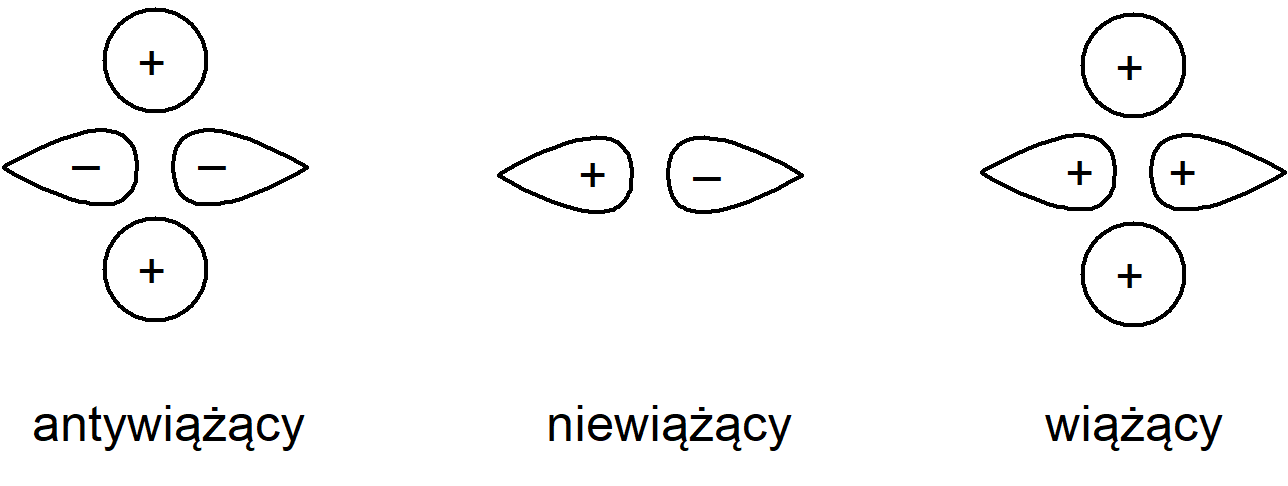
Atom boru zawiera trzy elektrony na powłoce walencyjnej, a atom wodoru jeden. Całkowita liczba elektronów walencyjnych cząsteczki B2H6 wynosi zatem 12. Osiem z nich jest zaangażowanych w tworzenie typowych dwuelektronowych terminalnych wiązań B–H, czyli pozostają 4 elektrony, które mogą zostać wykorzystane na utworzenie wiązań mostkowych. Te cztery elektrony zapełnią dwa orbitale wiążące mostkowego orbitalu cząsteczkowego. Cząsteczka jest trwała gdyż zajęte są tylko orbitale wiążące.
 Orbitale wiążące w mostku B–H–B
Orbitale wiążące w mostku B–H–B
Układ mostka wodorowego w cząsteczce B2H6 zawiera cztery atomy: dwa atomy boru i dwa wodoru.. Odpowiednia kombinacja dwóch zajętych orbitali wiążących opisuje wiązania mające maksima gęstości elektronowej wzdłuż krzywych B–H–B. Jedna para elektronowa, zdelokalizowana na trzech atomach wytwarza słabsze wiązania niż dwa dwucentrowe wiązania dwuelektronowe (wiązanie B–H mostkowe jest dłuższe niż terminalne, a im większa długość wiązania tym mniejsza jego siła). Układ mostka B–H–B łatwo zniszczyć za pomocą zasady Lewisa. Przykładowo reakcja:
B2H6 + 2Me3N → 2Me3NBH3
zachodzi łatwo, gdyż w wyniku oddziaływania dwóch wolnych par elektronowych i dwóch trójcentrowych, dwuelektronowych wiązań otrzymuje się cztery dwucentrowe, dwuelektronowe wiązania. Wszystkie borowodory zachowują się jak kwasy Lewisa, rozkładając się pod wpływem zasad.
Konstrukcję wiązań trójcentrowych można przeprowadzić na różne sposoby. Przykładowo można założyć występowanie w atomie boru hybrydyzacji sp3 i utworzyć wiązania zgięte, lub też posłużyć się hybrydami typu sp2 położonymi w płaszczyźnie cząsteczki, tworzącymi wiązanie σ a pozostałe orbitale p wykorzystać do utworzenia wiązań π.
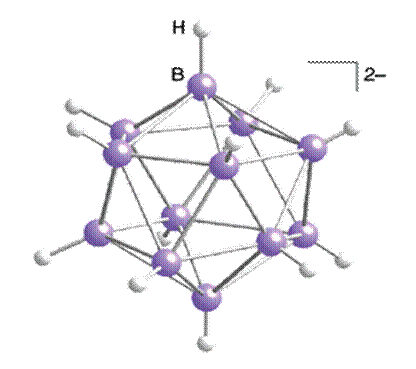
Klatka utworzona przez atomy boru bardziej przypomina metal niż cząsteczkę związku ale elektrony w niej występujące zachowują pewien stopień zlokalizowania. Struktury dziesięcio– ośmio– i sześcioboranów można przedstawić usuwając z dwudziestościanu odpowiednio dwa, cztery i sześć atomów boru i dodając odpowiednią liczbę protonów aby utworzyć mostki łączące odsłonięte atomy boru.
Podobne wiązania występują w wodorkach glinu(I) i galu(III). Natomiast borowodory tworzą szereg innych związków, w których wiązania mają charakter bardziej konwencjonalny. Przykładem może być BH3CO, w którym niedobór elektronów na powłoce walencyjnej boru jest uzupełniany donorową parą elektronowa zlokalizowaną na atomie węgla w cząsteczce CO. Analogiczna sytuacja występuje w związku BH3·NH3, w którym wolna para elektronowa azotu uzupełnia niedobór elektronów atomu boru.