 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Reakcje przeniesienia atomu
Reakcje przeniesienia atomu
W reakcjach redoks, w których uczestniczą substancje, które nie posiadają wyraźnie określonych orbitali niewiążących przeniesienie elektronu jest związane ze zmianami wiązań w cząsteczkach. Przykładem może być reakcja związków chromu(III) z chlorkiem benzylu, w której powstaje rodnik benzylowy.
[Cr(OH2)6]3+ + Cl–CH2C6H5 → [Cr(OH2)6Cl]2+ + CH2C6H5
W reakcji tej zerwanie wiązania chlor–węgiel następuje prawdopodobnie w wyniku przeniesienia elektronu na antywiążący orbital C–Cl. Z drugiej strony można oczekiwać procesu przeniesienia atomu chloru do jonu metalu. Podejście związane z przeniesieniem atomu w związku przejściowym było stosowane do reakcji redoks pomiędzy akwojonami metali przejściowych, jednak zostało ono zarzucone. Z drugiej strony podejście to jest przydatne przy wyjaśnianiu mechanizmów reakcji pomiędzy cząsteczkami, w których występują wiązania kowalencyjne. W takich przypadkach rozpatruje się symetrię orbitali substratów.
Dla przykładu weźmy pod uwagę reakcję pomiędzy manganianem(VII) i alkenem, dla której orbitale alkenu i jonu manganianowego(VII) zostały przedstawione na schemacie.
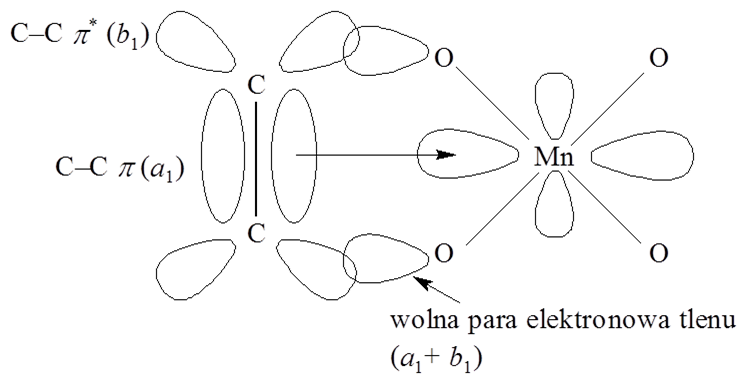 Wolne pary elektronowe dwóch atomów tlenu przekształcają się jak a1 + b1, a orbital b1 może się nakładać z antywiążącym orbitalem π* wiązania C–C. Takie oddziaływanie powoduje osłabienie wiązania π C–C, które dodatkowo zostaje osłabione w wyniku przeniesienia elektronu z orbitalu π alkenu na orbital dz2 manganu w wyniku czego mangan redukuj się do Mn(V) i następuje zerwanie wiązania podwójnego w aleknie i utworzenie dwóch wiązań C–O. W przypadku cyklicznych alkenów może zajść hydroliza prowadząca do alkoholu dihydroksylowego.
Wolne pary elektronowe dwóch atomów tlenu przekształcają się jak a1 + b1, a orbital b1 może się nakładać z antywiążącym orbitalem π* wiązania C–C. Takie oddziaływanie powoduje osłabienie wiązania π C–C, które dodatkowo zostaje osłabione w wyniku przeniesienia elektronu z orbitalu π alkenu na orbital dz2 manganu w wyniku czego mangan redukuj się do Mn(V) i następuje zerwanie wiązania podwójnego w aleknie i utworzenie dwóch wiązań C–O. W przypadku cyklicznych alkenów może zajść hydroliza prowadząca do alkoholu dihydroksylowego.