 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Teoria pola krystalicznego
Teoria pola krystalicznego
Teoria ta została ogłoszona w roku 1929 przez niemieckiego fizyka Hansa Bethe (szerszy opis teorii pola krystalicznego znajduje się na stronie Pole krystaliczne ). Podał on teoretyczne podstawy opisu konfiguracji elektronów obsadzających orbitale d i f atomu centralnego, koordynowanego przez grupy ligandów o różnej symetrii. U podstaw teorii CFT leżą tezy:
- siły odpowiedzialne za występowanie wiązania koordynacyjnego i jego trwałość mają charakter elektrostatyczny;
- ligandy niezależnie od ich realnej struktury traktuje się jako ładunki punktowe lub dipole. Przestrzenny układ tych ładunków wyznacza symetrię pola elektrostatycznego działającego na jon centralny;
- konfiguracja elektronowa jonu centralnego jest określana na podstawie zasad kwantowo-mechanicznych. Stosując się do formalizmu mechaniki kwantowej określa się też właściwości związków koordynacyjnych.
Orbitale d izolowanego atomu centralnego posiadają taką samą energię, czyli poziom nd jest pięciokrotnie zdegenerowany. Gdy atom centralny (o konfiguracji d5 lub d10) znajdzie się w otoczeniu ligandów, w polu o symetrii sferycznej, energia wszystkich pięciu orbitali d ulega zwiększeniu. Zmiana symetrii pola spowodo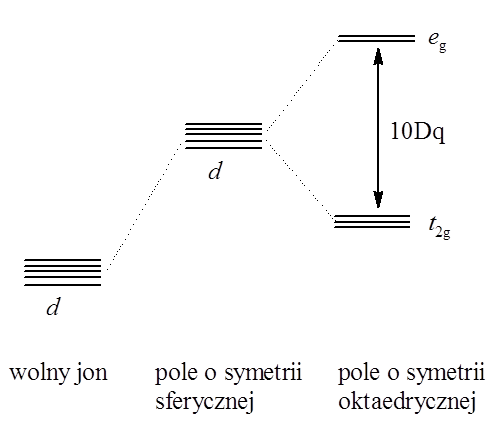 wana obecnością ligandów w związku koordynacyjnym prowadzi do zmiany degeneracji orbitali d.
wana obecnością ligandów w związku koordynacyjnym prowadzi do zmiany degeneracji orbitali d.
Zmiany te są wynikiem elektrostatycznego oddziaływania ligandów z orbitalami d atomu centralnego. Zmiana degeneracji w oktaedrycznym polu krystalicznym wynika z przestrzennego ułożenia orbitali d w stosunku do ligandów (Rysunek 6.8) – dwa z nich tj. dz2 i dx2–y2 są ułożone w stronę ligandów, a zatem uzyskują większą energię. Trzy pozostałe dxy, dxz, dyz są skierowane pomiędzy ligandy i ich energia ulegnie zmniejszeniu jak przedstawiono to na rysunku. Różnica poziomów energetycznych pomiędzy tymi rozszczepionymi poziomami, zgodnie z symboliką przejętą z teorii grup, eg i t2g, określana jest parametrem Δ lub 10Dq:
10Dq=E(eg) – E(t2g)
Obsadzenie elektronami orbitali na niższych energiach powoduje stabilizację energetyczną koordynowanego jonu centralnego w porównaniu z jonem izolowanym. W przypadku symetrii oktaedrycznej różnica energii pomiędzy eg a t2g nosi nazwę Energii Stabilizacji Pola Krystalicznego (ESPK). Energię tę można obliczyć następująco:
- przyjmujemy, że energia orbitali d w polu krystalicznym o symetrii sferycznej jest równa E= 0;
- przyjmujemy, że wszystkie orbitale t2g i eg są wypełnione elektronami (konfiguracja d10);
- w takiej sytuacji mamy spełnioną zależność na rozkład energii (rozkład punktów ciężkości) -4E(eg) + 6E(t2g) = 10E, gdzie E jest wyrażone w jednostkach 10Dq (Δ).
Współczynniki po lewej stronie równania odpowiadają liczbom elektronów obsadzających orbitale eg i t2g. Definiując energię stabilizacji jako E – E(t2g) = X i destabilizacji jako Y = E(eg) – E oraz uwzględniając 10Dq = E(eg) – E(t2g) otrzymujemy równania: X = 2/5Δ =4Dq;Y = 3/5Δ = 6Dq
Ogólny wzór można przedstawić następująco: Estab= (4n-6m)Δ, gdzie n i m oznaczają ilości elektronów na orbitalach eg i t2g. W tetraedrze rozmieszczenie orbitali d jest odmienne – zdegenerowany poziom orbitali e jest stabilizujący, a t2 destabilizujący. Jednak przyjmując Δ tetraedru jako 4/9Δ oktaedru oraz uwzględniając zmianę kolejności poziomów energetycznych daje się określić ESPK.
| Liczba elektronów d |
symetria oktaedryczna | symetria tetraedryczna | ||
|
|
słabe pole | silne pole | słabe pole | silne pole |
|
1 2 3 4 5 6 7 8 9 10 |
2 4 6 3 0 2 4 6 3 0 |
2 4 6 8 10 12 9 6 3 0 |
3 6 4 2 0 3 6 4 2 0 |
3 6 9 12 10 8 6 4 2 0 |
Rozpatrując zmiany energii stabilizacji w krystalicznych polach oktaedrycznych i tetraedrycznych można wyciągnąć pewne wnioski dotyczące stereochemii związków koordynacyjnych. Rozpatrując względną trwałość konfiguracji okta– i tetraedrycznej dla wysokospinowych związków koordynacyjnych metali pierwszego okresu przejściowego możemy spodziewać się monotonicznego wzrostu trwałości koordynacji tetraedrycznej związków metali od wapnia do cynku ze względu na malejący promień jonowy. Istotnie jony Zn(II) wykazują tendencję do występowania w otoczeniu tetraedrycznym (ESPK = 0), ale jeżeli przypatrzymy się danym w tabeli to widać, że w przypadku układów wysokospinowych (słabe pole) dla Ni(II) korzystniejsza jest koordynacja oktaedryczna. Rzeczywiście jon niklu(II) w większości związków koordynacyjnych ma otoczenie oktaedryczne, natomiast w przypadku kobaltu(II) mamy często do czynienia ze związkami o symetrii tetraedrycznej wielościanu koordynacyjnego. Energia stabilizacji znajduje odwzorowanie w danych eksperymentalnych takich jak ciepło hydratacji jonów oraz w zależnościach długości wiązania metal – tlen w tlenkach metali o geometrii Oh.
Wielkość energii stabilizacji wpływa na nadwyżkę ciepła hydratacji jonów, która jest największa dla jonów o konfiguracji d 3 i d 8; największe skrócenie wiązań obserwuje się dla tych samych konfiguracji. Jednak rozpatrywanie trwałości związków koordynacyjnych jedynie w oparciu o konfigurację elektronów d jonu centralnego jest zbyt dużym uproszczeniem chociażby z tego powodu, że różne jony mają różne wartości parametru rozszczepienia. W przypadku, gdy następuje sparowanie spinów należy ten proces uwzględnić w określaniu ESPK. Weźmy pod uwagę jon Mn2+ w otoczeniu oktaedrycznym w silnym i słabym polu krystalicznym. W przypadku słabego pola pięć elektronów zajmuje wszystkie dostępne orbitale d manganu i zgodnie z definicją energia stabilizacji dla takiego układu wynosi 0. W przypadku silnego pola wszystkie 5 elektronów znajdzie się na poziomie t2g. W związku z tym mamy dwie pary elektronowe i jeden niesparowany elektron. Wkład od pojedynczego elektronu na poziomie t2g to 2/5Δo, a energia sparowania spinów obniża wartość energii stabilizacji. ESPK dla takiego układu: 5(elektronów) × 2/5Δo – 2P = 2Δo –2P (P – energia sparowania spinów). Rozpatrzmy jeszcze dwa jony mające odpowiednio konfiguracje d5 i d6. W słabym polu mają one konfiguracje t2g3eg2 i t2g4eg2, a w silnym polu krystalicznym t2g5 i t2g6. W obu przypadkach mamy do czynienia z jednakowym wzrostem energii stabilizacji pola krystalicznego. Należy jeszcze uwzględnić zmianę energii związaną ze sparowaniem spinów. Energia oddziaływania elektronów o spinach przeciwnie skierowanych może być obliczona za pomocą całki kulombowskiej, natomiast energia oddziaływania dwóch elektronów o spinach zgodnie skierowanych jest zmniejszana o wartość całki wymiany. Energia wymiany w przybliżeniu jest proporcjonalna do liczby par elektronów o zgodnie skierowanych spinach. Dla pięciu elektronów, z których trzy mają spin równy ½ a dwa –½ mamy cztery pary elektronów o równych spinach (dla spinu ½: pary 1–2; 1–3; 2–3, a dla –½: 4–5). Dla sześciu elektronów, takich par możemy utworzyć sześć. W związku z tym strata energii w przypadku sparowania spinów jest niższa w przypadku konfiguracji d 6 co pozwala skompensować energię słabego pola krystalicznego. Dla jonów o konfiguracji d 5 stany niskospinowe są możliwe w przypadku silnych pól krystalicznych. Rozważania te są prawdziwe dla jonów metali przejściowych czwartego okresu. Dla jonów metali z okresu piątego i szóstego związki koordynacyjne jonów o konfiguracji d 5 są niskospinowe ze względu na wyższe wartości parametru Δ.
Rozpatrzmy teraz związek o liczbie koordynacyjnej 4 i geometrii kwadratu. Przyjmijmy, że powstaje on przez odsunięcie dwóch ligandów, znajdujących się na osi z, w związku o symetrii oktaedrycznej do nieskończoności.
 W wyniku zwiększenia odległości pomiędzy ligandami na osi z przy jednoczesnym zbliżeniu czterech ligandów w płaszczyźnie xy, aby energia układu nie uległa zmianie, następuje dalsza zmiana degeneracji poziomów energetycznych. Oddziaływanie elektronów na orbitalu dz2 z ligandami zmniejsza się w porównaniu z orbitalem dx2-y2. W związku z tym poziom eg oktaedru ulega rozszczepieniu na dwa poziomy: niżej położony a1g i b1g o wyższej energii. Podobna sytuacja ma miejsce dla poziomu t2g. Maksima gęstości elektronowej orbitalu dxy leżą w płaszczyźnie ekwatorialnej, a dxz i dyz w płaszczyznach aksjalnych i dodatkowo przechodzą jedne w drugie przy obrocie o kąt 90°. Czyli odsunięcie ligandów wzdłuż osi z ma jednakowy wpływ na te orbitale. Ostatecznie poziom t2g oktaedru ulegnie rozszczepieniu na niżej położony dwukrotnie zdegenerowany poziom eg oraz wyższy b2g. Gdyby deformacja oktaedru polegała nie na odsuwaniu ligandów wzdłuż osi z a na ich zbliżaniu otrzymamy takie samo rozszczepienie poziomów t2g i eg z tą różnicą, że ich kolejność ulegnie odwróceniu. Czyli w przypadku skróconej bipiramidy o podstawie kwadratowej energia poziomów jest następująca: b2g < eg < b1g < a1g. Dalsza zmiana geometrii polegająca na umieszczeniu ligandów na każdej osi współrzędnych w innych odległościach (geometria koordynacyjna bipiramidy rombowej) spowoduje dalszą zmianę degeneracji poprzez rozszczepienie poziomu eg. Symetria płaskiego kwadratu jest szczególnym przypadkiem wydłużonej bipiramidy o podstawie kwadratowej w związku z czym schemat poziomów energetycznych jest taki sam. Jednak, ponieważ zaburzenie symetrii oktaedru w tym przypadku jest znacznie większe, to i rozszczepienie poziomów t2g jest znacznie silniejsze. W niektórych przypadkach poziom a1g może mieć niższą energię niż dwukrotnie zdegenerowany eg.
W wyniku zwiększenia odległości pomiędzy ligandami na osi z przy jednoczesnym zbliżeniu czterech ligandów w płaszczyźnie xy, aby energia układu nie uległa zmianie, następuje dalsza zmiana degeneracji poziomów energetycznych. Oddziaływanie elektronów na orbitalu dz2 z ligandami zmniejsza się w porównaniu z orbitalem dx2-y2. W związku z tym poziom eg oktaedru ulega rozszczepieniu na dwa poziomy: niżej położony a1g i b1g o wyższej energii. Podobna sytuacja ma miejsce dla poziomu t2g. Maksima gęstości elektronowej orbitalu dxy leżą w płaszczyźnie ekwatorialnej, a dxz i dyz w płaszczyznach aksjalnych i dodatkowo przechodzą jedne w drugie przy obrocie o kąt 90°. Czyli odsunięcie ligandów wzdłuż osi z ma jednakowy wpływ na te orbitale. Ostatecznie poziom t2g oktaedru ulegnie rozszczepieniu na niżej położony dwukrotnie zdegenerowany poziom eg oraz wyższy b2g. Gdyby deformacja oktaedru polegała nie na odsuwaniu ligandów wzdłuż osi z a na ich zbliżaniu otrzymamy takie samo rozszczepienie poziomów t2g i eg z tą różnicą, że ich kolejność ulegnie odwróceniu. Czyli w przypadku skróconej bipiramidy o podstawie kwadratowej energia poziomów jest następująca: b2g < eg < b1g < a1g. Dalsza zmiana geometrii polegająca na umieszczeniu ligandów na każdej osi współrzędnych w innych odległościach (geometria koordynacyjna bipiramidy rombowej) spowoduje dalszą zmianę degeneracji poprzez rozszczepienie poziomu eg. Symetria płaskiego kwadratu jest szczególnym przypadkiem wydłużonej bipiramidy o podstawie kwadratowej w związku z czym schemat poziomów energetycznych jest taki sam. Jednak, ponieważ zaburzenie symetrii oktaedru w tym przypadku jest znacznie większe, to i rozszczepienie poziomów t2g jest znacznie silniejsze. W niektórych przypadkach poziom a1g może mieć niższą energię niż dwukrotnie zdegenerowany eg.
Obniżenie symetrii pola krystalicznego powoduje zmianę degeneracji (orbitale zdegenerowane składają się z coraz mniejszej liczby orbitali atomowych) i co za tym idzie konieczność wprowadzenia innych poza 10Dq parametrów opisujących rozszczepienie orbitali d atomu centralnego. Najprostszym sposobem obniżenia symetrii oktaedrycznej jest zaburzenie tetragonalne lub trygonalne, czyli zmiana długości wiązań metal–ligand wzdłuż osi cztero– lub trójkrotnej (C4 lub C3). Nie wnikając w szczegółowe rozważania matematyczne zaburzenia te są reprezentowane poprzez wprowadzenie do równania Schrödingera odpowiednich operatorów opisujących oddziaływanie jonu centralnego z wytworzonym przez ligandy krystalicznym polem tetragonalnym lub trygonalnym. W konsekwencji poza parametrem rozszczepienia Dq pojawiają się dwa dodatkowe parametry oznaczane jako Ds i Dt w polu krystalicznym tetragonalnym i Dσ, Dτ w polu krystalicznym trygonalnym. Parametry te charakteryzują różnice miedzy ekwatorialnymi (podstawa wielościanu koordynacyjnego) i aksjalnymi polami krystalicznymi. W tabeli przedstawione zostało rozszczepienie poziomów energetycznych dla geometrii oktaedrycznej i jej podgrup.
|
Oh |
Td |
D4h |
D2d |
D3 |
C4v |
C2h |
C2v |
|
A1g A2g Eg T1g T2g A1u A2u Eu T1u T2u |
A1 A2 E T1 T2 A2 A1 E T2 T1 |
A1g B1g A1g + B1g A2g + Eg B2g + Eg A1u B1u A1u + B1u A2u + Eu B2u + Eu |
A1 B1 A1 + B1 A2 + E B2 + E B1 A1 A1 + B1 B2 + E A2 + E |
A1 A2 E A2 + E A1 + E A1 A2 E A2 + E A1 + E |
A1 B1 A1 + B1 A2 + E B2 + E A2 B2 A2 + B2 A1 + E B1 + E |
Ag Bg Ag + Bg Ag + 2Bg 2Ag + Bg Au Bu Au + Bu Au + 2Bu 2Au + Bu |
A1 A2 A1 + A2 A2 + B1 + B2 A1 + B1 + B2 A2 A1 A1 + A2 A1 + B1 + B2 A2 + B1 + B2 |