 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Teoria pola ligandów
Teoria pola ligandów
Opracowanie teorii pola krystalicznego i pola ligandów jest dostępne w postaci dokumentu pdf w tym miejscu.
Związki o geometrii tetraedrycznej
Rozważmy związek o tetraedrycznej geometrii wielościanu koordynacyjnego. Grupa punktowa dla tetraedru to Td i potrzebujemy tabeli charakterów tej grupy punktowej.
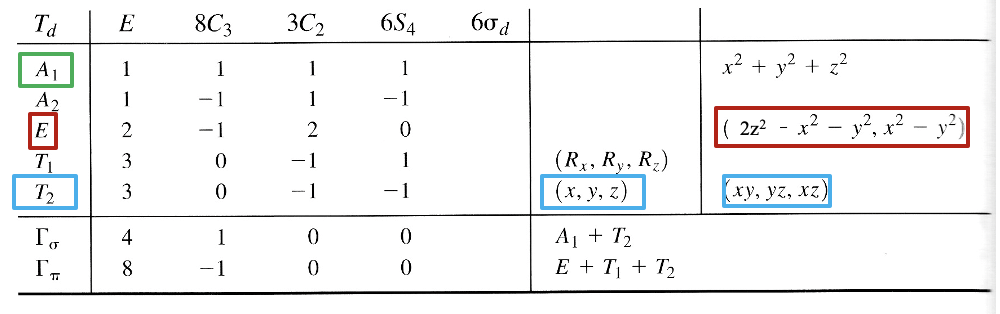 Tabela charakterów grupy Td
Tabela charakterów grupy Td
Wybieramy układ współrzędnych wpisując czworościan w sześcian, wstawiając w co drugi wierzchołek sześcianu ligand. Osie współrzędnych przebiegają prostopadle do ścian sześcianu.
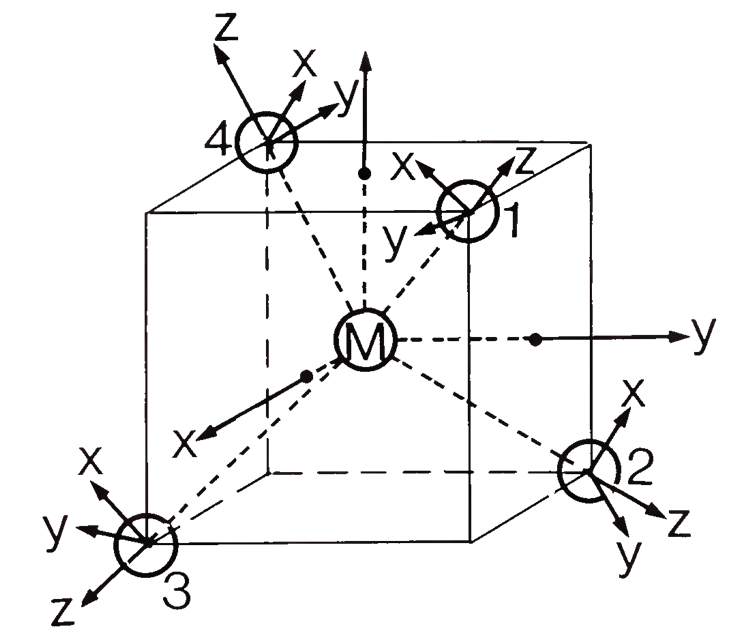
Teraz musimy określić typy symetrii orbitali granicznych metalu. W przypadku czwartego okresu orbitalami walencyjnymi są 3d, 4s i 4p. Orbital 4s jest pełnosymetryny typu A1, Znajdujemy litery x, y i z w nawiasach w niprzywiedlnej reprezentacji typu T2, a to oznacza, że orbitale 4p są potrójnie zdegenerowane i mają typ symetrii T2. Orbitale 3dxy, 3dyz i 3dxz znajdują się w tej samej reprezentacji, są również potrójnie zdegenerowane i też mają symetrię T2. Orbitale 3dx2-y2 i 3dz2 mają symetrię typu E zgodnie z tabelą charakterów dla tej grupy punktowej. Zajmiemy się ligandami. Ponieważ najpierw musimy rozważyć wiązanie σ, należy znaleźć HOMO liganda odpowiednie do utworzenia wiązania σ. Wybierzemy ligand karbonylowy jako przykładowy, w tym przypadku HOMO ligandów CO powinny być w stanie uczestniczyć w wiązaniach σ z metalem. W rzeczywistości nie jest to od razu oczywiste. Gdybyśmy wybrali ten sam układ współrzędnych metalu i ligandów, to oś wiązania CO, którą zdefiniowaliśmy jako oś z, nie wskazywałaby na metal i żadne nakładanie typu σ z orbitalami metalu nie mogłoby zajść. Dlatego musimy nadać każdemu ligandowi inny układ współrzędnych z osiami z skierowanymi w stronę metalu, jak na powyższym schemacie. Dopiero wtedy cząsteczka CO byłaby zorientowana tak, aby utworzyć wiązanie σ z metalem. Generalnie, konstruując MO, ligandy powinny być zawsze zorientowane w taki sposób aby umożliwić maksymalne nakładanie orbitali. Ponieważ mamy cztery ligandy, będziemy mieć cztery orbitale HOMO ligandów, które grupujemy i określamy typ symetrii znajdując, że orbitale HOMO czterech ligandów rozkładają się na dwie grupy: A1 i T2.
Możemy teraz skonstruować molekularny diagram orbitalny dla wiązania σ. Orbital 4s i jeden z orbitali grupy ligandów mają symetrię A1, co po połączeniu daje wiążący orbital 1a1 i orbital antywiążący 2a1. Orbitale 4p i trzy orbitale d metalu mają typ symetrii T2, tak jak trzy orbitale grupy ligandów. Daje to w sumie dziewięć orbitali, co oznacza, że musimy skonstruować dziewięć orbitali cząsteczkowych o symetrii t2. Z powodu trójkrotnej degeneracji tych orbitali muszą istnieć trzy zestawy potrójnie zdegenerowanych orbitali cząsteczkowych. Możemy założyć, że jedna ich grupa będzie wiążąca, jedna w przybliżeniu niewiążąca, a jedna antywiążąca. Możemy je nazwać odpowiednio 1t2, 2t2 i 3t2. 2t2 ma właściwie charakter antywiążący. Pozostały nam orbitale metalu o symetrii e, które ze względu na symetrię nie oddziałują z orbitalami ligandów pozostając niewiążące. Pozostaje umiejscowienie elektronami orbitali cząsteczkowych. Orbitale HOMO ligandów są zapełnione, co daje 4 × 2 = 8 elektronów. Elektrony te lokalizują się na 1t2 i 1a1 co pokazuje istnienie czterech wiązań σ metal-ligand. Wszystkie elektrony d metalu, których może być do dziesięciu, musiałyby znaleźć się na orbitalu e i/lub t2. Poziom e w tetraedrze to niewiążące orbitale dz2 i dx2-y2, a poziom 2t2 jest słabo antywiążący o silnie zaznaczonym charakterze orbitali d metalu (dxy, dyz i dxz). Możemy zatem powiedzieć, że poziomy e i 2t2 są orbitalami metalu w tetraedrycznym polu ligandów. Różnica energii między orbitalami e i 2t2 to energia stabilizacji pola ligandów tetraedru Δt.
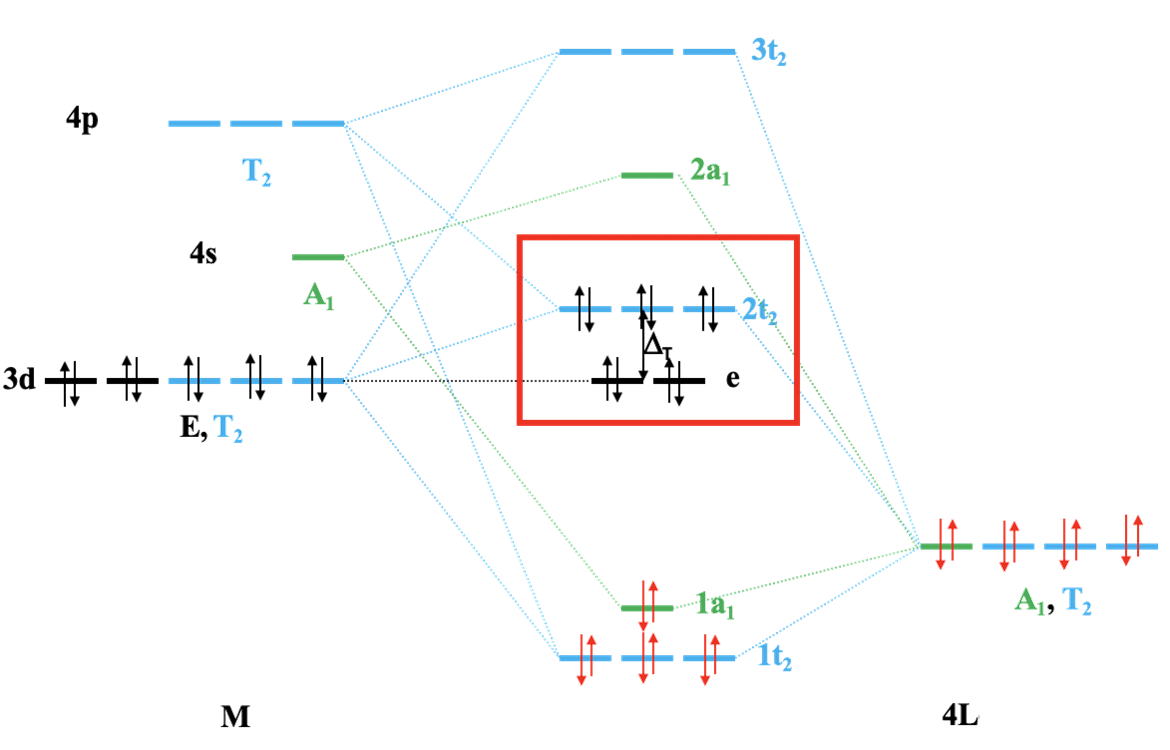 Diagram MO odzwierciedlający wiązanie σ w tetraedrycznym kompleksie metalu przejściowego czwartego okresu
Diagram MO odzwierciedlający wiązanie σ w tetraedrycznym kompleksie metalu przejściowego czwartego okresu
Wiązania π w kompleksie tetraedrycznym
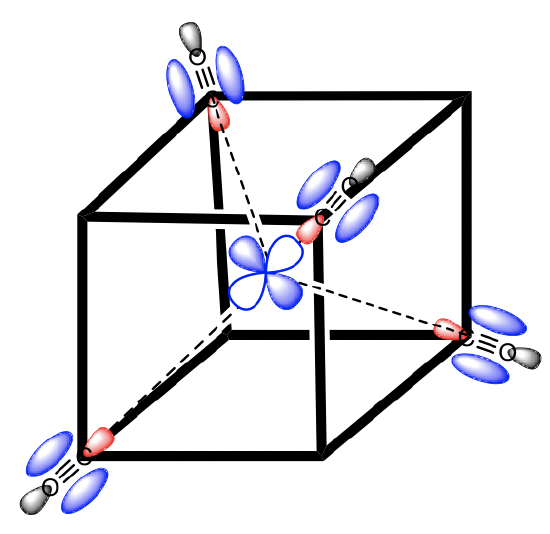
Najpierw musimy zdecydować, czy istnieją orbitale ligandów, które są zorientowane tak, aby nakładały się na orbitale atomu metalu na sposób π. Widzimy, że żaden orbital liganda nie zachodzi na orbital d metalu dokładnie w sposób umożliwiający powstanie wiązania π, jednak orbitale e typu π metalu i 2e typu π* ligandów nakładają się na siebie umożliwiając powstanie oddziaływania typu π. Z tego powodu możemy określić to oddziaływanie jako wiązanie π. Musimy jednak wziąć pod uwagę, że ze względu na mniejsze nakładanie się orbitali, wiązanie π w kompleksach tetraedrycznych jest słabsze niż w związkach o oktaedrycznym wielościanie koordynacyjnym. Ponieważ rozpatrujemy związek z CO jako ligandem, orbitali o symetrii π będzie cztery na każdy ligand, a zatem w sumie 4 × 4 = 16. Spośród nich będzie osiem orbitali wiążących eπ i osiem antywiążących eπ*. Grupujemy orbitale wiążące i antywiążące, aby utworzyć dwa zestawy po osiem orbitali, i określamy ich symetrie. W każdej grupie orbitali ligandów mamy dwa orbitale typu E, trzy orbitale typu T1 i trzy orbitale typu T2. Ponieważ znamy teraz symetrię orbitali grup ligandów, możemy połączyć je z orbitalami metalu o tej samej symetrii w tetraedrycznym polu ligandów, tworząc orbitale cząsteczkowe typu π. Zróbmy to na przykładzie tetrakarbonylkuniklu(0). Użyjemy diagramu MO układu z wiązaniami σ jako punktu wyjścia i zmodyfikować go tak, aby uwzględniał wiązanie π. Dodając do diagramu nowe orbitale grupy ligandów bierzemy pod uwagę tylko e o symetrii E i T2 pomijając T1 ponieważ żaden orbital metalu nie ma symetrii t1. Następnie musimy wziąć pod uwagę, że ligand CO jest silnym ligandem π-akceptorowym. Oznacza to, że należy brać pod uwagę tylko orbitale antywiążące π* ligandów (LUMO cząsteczki CO).
Teraz łączymy orbitale typu π grupy ligandów i orbitale d metalu o tej samej symetrii, aby utworzyć orbitale cząsteczkowe typu π. Możemy połączyć orbitale ligandów typu e z niewiążącymi orbitalami typu e (dz2 i dx2-y2) metalu, tworząc parę wiążących MO i parę antywiążacych orbitali o symetrii e, która oznaczamy odpowiednio 1e i 2e. Teraz musimy zastanowić się nad wpływem orbitali typu π grupy ligandów czyli T2. Najpierw musimy zdać sobie sprawę, że mamy już trzy zestawy potrójnie zdegenerowanych orbitali cząsteczkowych t2 powstałych w wyniku oddziaływania σ. Teraz oddziaływanie orbitali T2 grupy ligandów z orbitalami cząsteczkowymi t2 typu σ musi stworzyć inny zestaw potrójnie zdegenerowanych orbitali, tak aby całkowita liczba orbitali o symetrii t2 pozostała taka sama. Oddziaływanie zachodzi głównie między cząsteczkowym 2t2 i T2 grupy ligandów, ponieważ energia poziomu 2t2 jest zbliżona do energii orbitali T2 ligandów. Prowadzi to do obniżenia energii 2t2, w wyniku czego wcześniej słabo antywiążące orbitale stają się słabo wiążącymi. Dodatkowo powstają słabo antywiążące orbitale t2. Możemy je nazwać 3t2. Dawny orbital antywiążący 3t2 oznaczymy jako 4t2. Aby się upewnić czy poprawnie skonstruowaliśmy cząsteczkowe poziomy o symetrii t2 sprawdzamy, czy liczba orbitali T2 grupy ligandów, w tym σ i π, plus liczba orbitali T2 metalu równa się liczbie orbitali cząsteczkowych t2. Suma orbitali T2 metalu + liczba orbitali o symetrii T2 grupy ligandów wynosi 6 + 6 = 12. Liczba cząsteczkowych orbitali t2 wynosi 4 × 3, czyli również 12.
 Diagram MO tetraedrycznego kompleksu metalu przejściowego IV okresu (z ligandem π-akceptorowym)
Diagram MO tetraedrycznego kompleksu metalu przejściowego IV okresu (z ligandem π-akceptorowym)
Pozostaje wypełnienie poziomów elektronami. Orbitale π grupy ligandów, jako LUMO, są puste, a zatem ligand nie wnosi żadnych elektronów do wiązania π. Nikiel jest na zerowym stopniu utlenienia, a zatem wnosi 10 elektronów. Konfiguracja elektronowa atomu Ni(0) to 3d 84s 2. Poziomy 1t1 i 1a1 są już zapełnione elektronami ligandów co wynika z wiązania σ. Zatem elektrony metalu znaleźć się na orbitalach cząsteczkowych 2e i 2t2. Zarówno orbitale e, jak i 2t2 są wiążące, a zatem możemy stwierdzić, że elektrony d metalu doznały stabilizacji w wyniku π-akceptorowych właściwości liganda. Widzimy tutaj analogię do oktaedrycznego pola ligandów. Podobnie jak w oktaedrycznym polu ligandów, ligandy π-akceptorowe mają tendencję do obniżania energii elektronów d metalu. Podobnie parametr rozszczepienia Δt rośnie w tetraedrycznym polu ligandów π-akceptorowych. Jednak wzrost jest znacznie mniejszy w porównaniu z polem oktaedrycznym. Dzieje się tak dlatego, że w oktaedrycznym polu ligandów energia poziomu eg nie zmienia się w wyniku odziaływania π-akceptorowego, a jedynie energia orbitali t2g ulega obniżeniu. W przypadku tetraedrycznego pola ligandów obniża się zarówno energia orbitali e, jak i t2, przy czym energia poziomu e ulega tylko nieznacznie większemu obniżeniu niż energia orbitali t2. Fakt ten może również służyć jako dodatkowe wyjaśnienie, dlaczego kompleksy tetraedryczne nigdy nie tworzą kompleksów niskospinowych, nawet z ligandami o silnie zaznaczonych właściwościach π-akceptorowych. Wpływ liganda na wartość Δt jest zbyt mały, ponieważ zarówno energia orbitali e, jak i t2 ulega obniżeniu.
 Diagram MO tetraedrycznego kompleksu metalu przejściowego IV okresu (π-donor)
Diagram MO tetraedrycznego kompleksu metalu przejściowego IV okresu (π-donor)
Zastanówmy się teraz, jak ligand będący π-donorem wpływa na wielkość parametru rozszczepienia Δt. W tym przypadku musimy tylko wziąć pod uwagę wiążące orbitale ligandów o symetrii E i T2, jeśli ligand tworzy wiązania π. Te orbitale będą energetycznie znajdować się poniżej orbitali grupy ligandów tworzących wiązanie σ. Jeśli ligand jest prostym jonem, takim jak Cl–, rozważymy orbitale grupy ligandów składające się z zapełnionych orbitali p o symetrii odpowiedniej do nakładania się typu π z orbitalami metalu. Orbitale grupy ligandów miałyby zasadniczo taką samą energię jak orbitale σ LGO. Skonstruujmy diagram MO TiCl4, czyli dla układu z ligandami chlorkowymi jako typowymi ligandami π-donorowymi. Ponownie zaczniemy od diagramu MO obejmującego tylko wiązania σ, a następnie go zmodyfikujemy. Orbitale grupy ligandów E będą teraz oddziaływać z orbitalami e metalu. Ta interakcja prowadzi do pary wiążących i pary antywiążących MO o symetrii e. Oznacza to, że efektywnie, niewiążące orbitale e metalu stają się antywiążącymi i przemieszczają się w górę na skali energii. Dodatkowy poziom wiążący e musi mieć mniejszą energię niż orbitale π grupy ligandów o symetrii E. Oddziałyanie orbitali o symetrii T2 grupy ligandów z orbitalami t2 metalu tworzy dodatkowy zestaw wiążących orbitali t2. Energia orbitali 2t2 rośnie i stają się one w konsekwencji bardziej antywiążące. Teraz wprowadzamy elektrony na orbitale cząsteczkowe. Orbitale typu π grupy ligandów mają w sumie osiem elektronów. Te elektrony trafią do nowo utworzonych orbitali cząsteczkowych wiążących 1e i 1t2, c prowadzi do ich stabilizacji. Tytan w TiCl4 jest na +4 stopniu utlenienia, więc formalnie mamy tutaj konfigurację d 0, czyli metal nie dostarcza elektronów. To wyjaśnia stabilność TiCl4, który nie spełnia reguły 18 elektronów. Mamy tylko 8 elektronów, ale wszystkie wiążące orbitale cząsteczkowe są zapełnione elektronami, a wszystkie pozostałe są puste. Gdyby atom Ti miał elektrony d, musiałby znaleźć się na orbitalach 2e i 3t2, które są antywiążące, co zdestabilizowałoby cząsteczkę związku. Ogólnie ligandy będące donorami π zwiększają energię elektronów d metalu i jest to kolejna analogia do oktaedrycznego pola ligandów. Zastanówmy się jaki jest wpływ liganda π-donorowego na wartość parametru rozszczepienia Δt. Energie orbitali granicznych metalu, e i t2, wzrosły, ale energia poziomy e wzrosła bardziej niż poziomu t2. Oznacza to, że Δt ogólnie zmalało, czyli ligandy π-donorowe prowadzą do zmniejszenia parametru rozszczepienia.
Planarne kompleksy kwadratowe
Jako ostatni przykład omówimy teraz molekularny diagram orbitalny kwadratowego kompleksu płaskiego. Będzie to najbardziej skomplikowany diagram MO, jaki omówimy. Większa złożoność wynika z niższej symetrii związku, który należy do grupy punktowej D4h, natomiast kompleksy tetra– i oktaedryczne należą do grup punktowych o wysokiej symetrii Td i Oh.
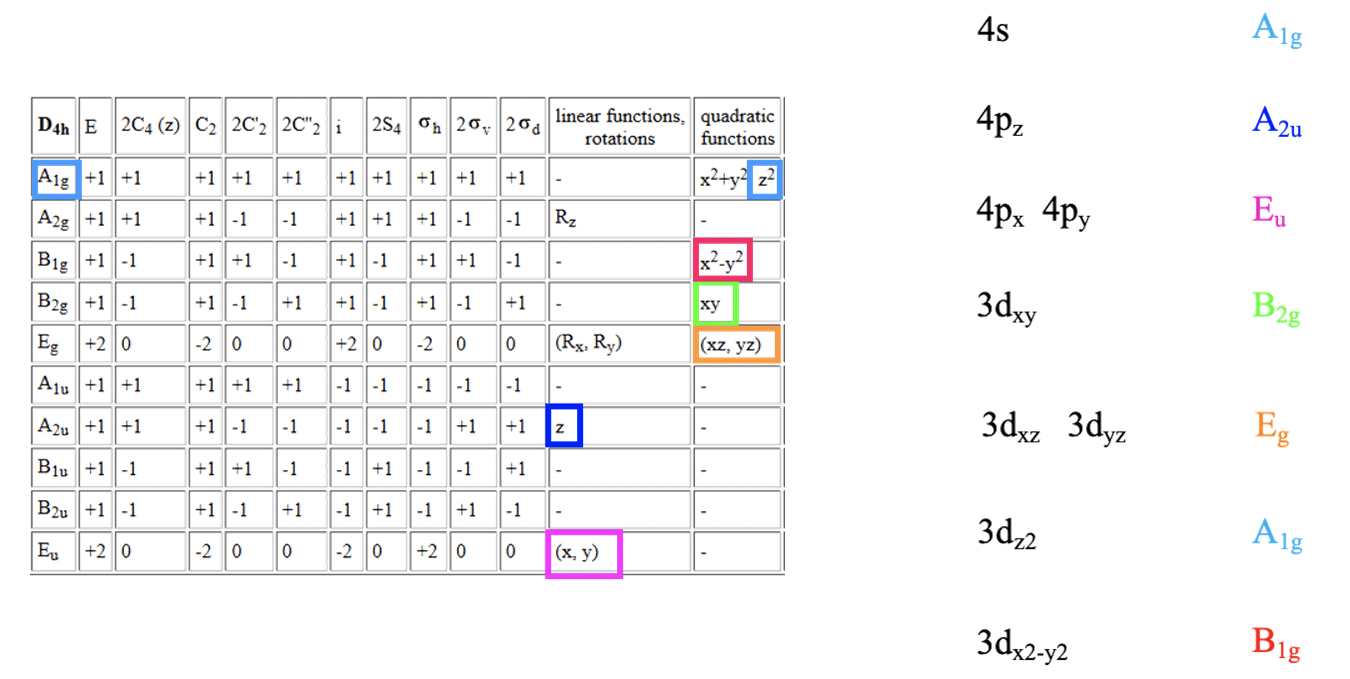 Tabela charakterów dla grupy punktowej D4h i symetria orbitali metalu.
Tabela charakterów dla grupy punktowej D4h i symetria orbitali metalu.
Niższa symetria prowadzi do większego zniesienia degeneracji orbitali cząsteczkowych. Na początek zdefiniujmy osie układu współrzędnych. Rozsądnie byłoby zdefiniować płaszczyznę xy jako płaszczyznę cząsteczki ze współrzędnymi x i y przechodzącymi przez wiązania. Oś z byłaby prostopadła do płaszczyzny cząsteczki. Zakładając, że mamy kompleks metalu przejściowego czwartego okresu, orbitale 3d, 4s i 4p są orbitalami granicznymi. Tabela charakterów grupy punktowej D4h pokazuje, że symetria orbitalu 4s to A1g, orbitali 4p to A2u dla orbitalu 4pz i eu dla 4px i 4py. Orbitale d mają typy symetrii A1g, B1g, B2g i Eg odpowiednio dla 3dz2, dx2-y2, 3dxy i 3dxz, 3dyz.
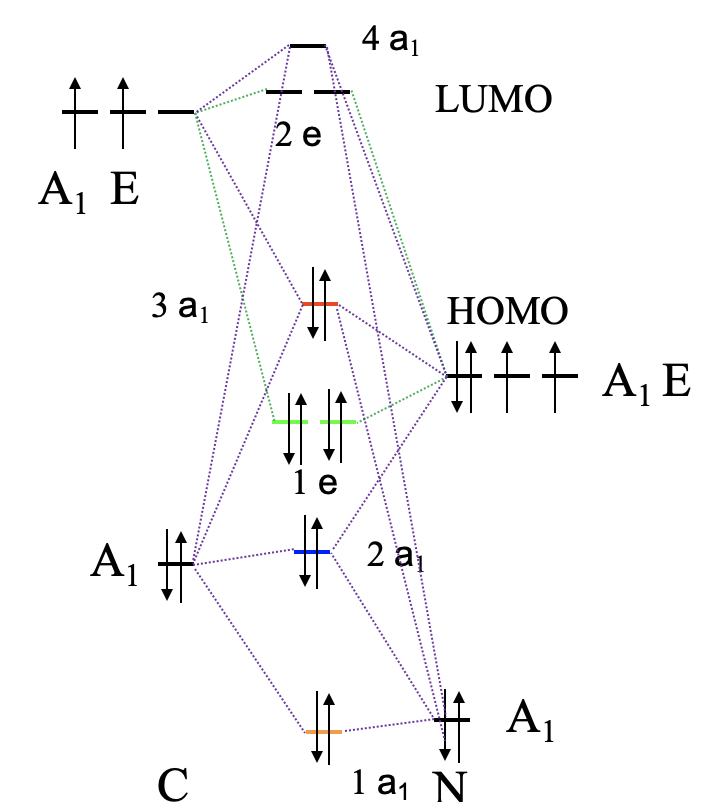 Diagram orbitali cząsteczkowych jonu CN–
Diagram orbitali cząsteczkowych jonu CN–
W kolejnym kroku określamy poziomy HOMO ligandów zdolne tworzyć wiązania σ. Nie istnieją kwadratowe planarne kompleksy karbonylowe, dlatego zamiast CO użyjemy liganda cyjanowego. Ligand cyjanowy jest izoelektronowy z ligandem karbonylowym, ale ponieważ azot ma o jeden elektron mniej niż O, musimy dodać jeden elektron do liganda cyjanowego tworząc anion CN–. Liczba, symetria i kolejność energii MO dla CN– i CO są takie same. Dlatego ligand cyjanowy ma orbitale HOMO odpowiednie do utworzenia wiązania σ i możemy je użyć do budowy wiązań cząsteczkowych σ. Każdy ligand ma jedno HOMO, dlatego mamy w sumie cztery HOMO, które wykazują symetrię: Γσ =A1g + Eu + B1g. mamy zatem orbital grupy ligandów o symetrii A1g, dwa o symetrii Eu i jeden o symetrii B1g. Mamy teraz wszystkie informacje niezbędne do skonstruowania diagramu orbitali cząsteczkowych dla związku z wiązaniami σ. Orbitale 4s i 3dz2 mają typ symetrii A1g, taki sam jak jeden z orbitali grupy ligandów. Otrzymamy zatem trzy orbitale cząsteczkowe tego typu symetrii, jeden wiążący, jeden niewiążący i jeden antywiążący, oznaczymy je odpowiednio 1a1g, 2a1g i 3a1g. Symetrię B1g mają orbital 3dx2-y2 i jeden z orbitali grupy ligandów, a zatem ich kombinacja utworzy cząsteczkowy orbital wiążący i antywiążący. Orbitale 4px i 4py mają symetrię Eu, jak pozostałe dwa orbitale grupy ligandów. W wyniku kombinacji otrzymujemy dwa dwukrotnie zdegenerowane wiążące i dwa antywiążące orbitale cząsteczkowe o symetrii eu. Pozostały nam orbitale dxy, dxz i dyz o symetrii odpowiednio B2g i Eg. Ponadto mamy orbital pz metalu o symetrii a2u. Te orbitale metalu nie mają odpowiedników co do symetrii wśród orbitali grupy ligandów. Dlatego pozostają jako niewiążące na diagramie MO. Wypełnijmy elektronami orbitale cząsteczkowe. Orbitale HOMO ligandów są zajęte przez elektrony, a ponieważ mamy cztery ligandy, musimy wziąć pod uwagę osiem elektronów. Elektrony te będą wypełniać orbitale cząsteczkowe 1a1, 1b1g i 1eu. Wszystkie te orbitale są wiążące. Zatem teoria pola ligandów jest w stanie wyjaśnić cztery wiązania i kwadratowy płaski kształt cząsteczki. Pora na elektrony jonu centralnego. Możemy mieć do dziesięciu elektronów d, w zależności od jonu metalu, a te dziesięć elektronów zajmie niewiążące orbitale b2g i eg oraz niewiążący orbital 2a1g i antywiążący 2b1g. Te orbitale możemy rozpatrywać jako orbitale metalu w kwadratowym płaskim polu ligandów. Orbital b2g to dxy w kwadratowym planarnym polu ligandów, eg to dxz i dyz, poziom 2a1g to dz2, a 2b1g to dx2-y2. W teorii pola krystalicznego największą energię miał orbital dx2-y2. Orbital dz2 miał mniejszą energię niż dxy, który nie był zdegenerowany z orbitalami dxz i dyz. Różnica wynika z faktu, że w teorii pola ligandów orbital dxy jest uważany za niewiążący, w ogóle nie oddziałujący z ligandami, podczas gdy w teorii pola krystalicznego zakłada się silne odpychanie elektrostatyczne między dxy a ligandami, ponieważ orbital dxy znajduje się w płaszczyźnie cząsteczki.
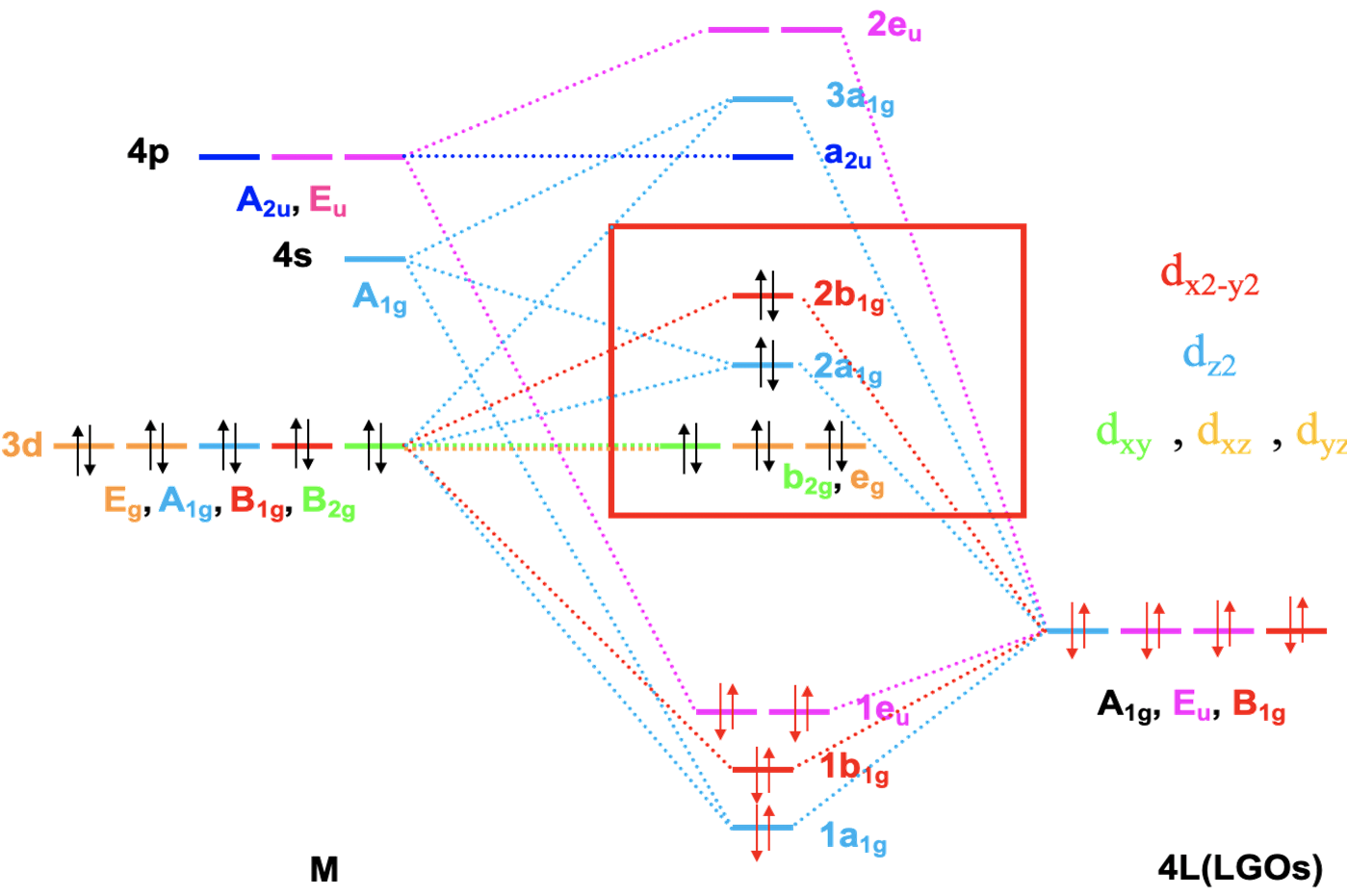 Diagram MO dla kwadratowego płaskiego kompleksu metali przejściowych czwartego okresu (wiązania σ)
Diagram MO dla kwadratowego płaskiego kompleksu metali przejściowych czwartego okresu (wiązania σ)
Przyjrzyjmy się teraz wiązaniu π w kwadratowym płaskim kompleksie metalu przejściowego. Dla liganda CN– orbitale, które mają odpowiednią symetrię, aby nakładać się z orbitalami metalu tworząc wiązanie π to orbitale 1e i 2e (π i π*) na diagramie MO dla CO. Ponieważ mamy cztery ligandy, w sumie mamy osiem orbitali π i osiem π*. Teraz musimy wziąć pod uwagę, że cztery z orbitali π znajdują się w płaszczyźnie xy, podczas gdy pozostałe cztery znajdują się powyżej i poniżej płaszczyzny xy. Te pierwsze nazywamy orbitalami równoległymi, a drugie prostopadłymi, ponieważ są zorientowane odpowiednio równolegle i prostopadle do płaszczyzny xy. Musimy je rozróżnić, ponieważ mają inną symetrię i inaczej nakładają się z orbitalami d metalu. Analogicznie zachowują się orbitale antywiążące. Zgrupujemy orbitale, aby utworzyć cztery zestawy orbitali ligandów π⊥, π||, π*⊥ i π*||. Naszym następnym zadaniem jest określenie typów symetrii tych orbitali. Zarówno π⊥, jak i π*⊥ zawierają jeden orbital o symetrii A2u, dwa Eg i jeden B2u; π|| i π*|| przekształcają się jako jeden A2g, dwa Eu i jeden B2g.
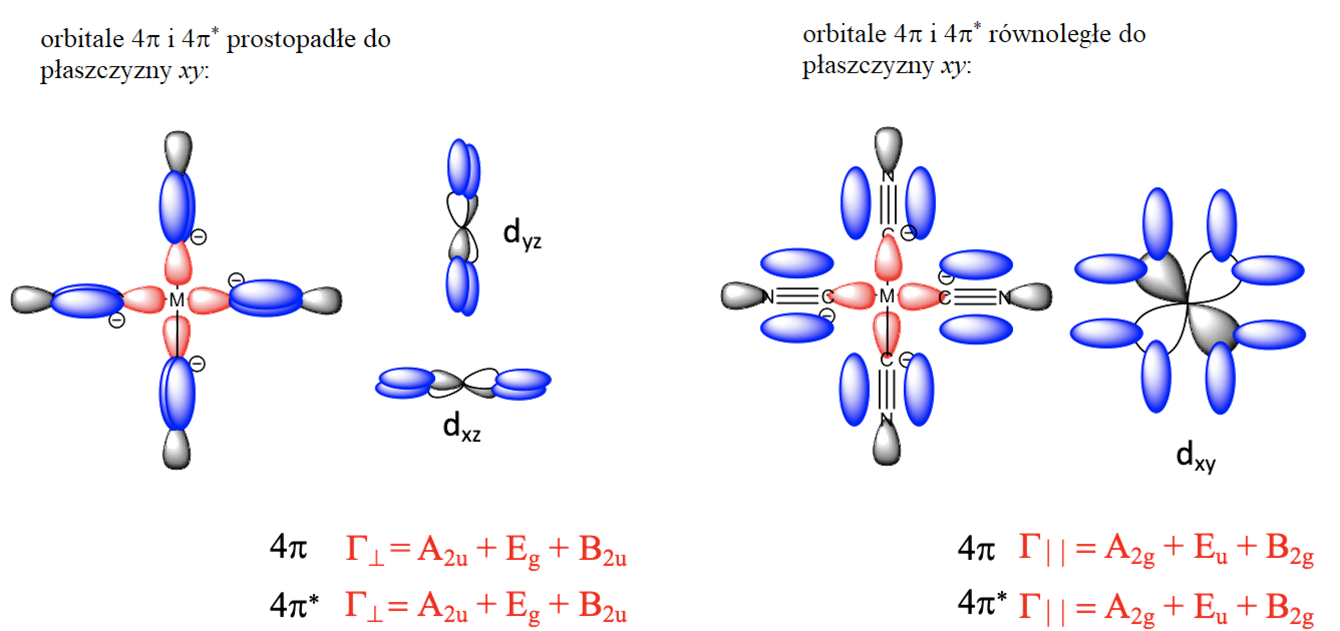
Teraz musimy wprowadzić orbitale cząsteczkowe π do diagramu uwzględniającego jedynie wiązania σ. Po pierwsze, musimy rozważyć, które z orbitali π ligandów mają odpowiednią symetrię do kombinacji z orbitalami d metalu.
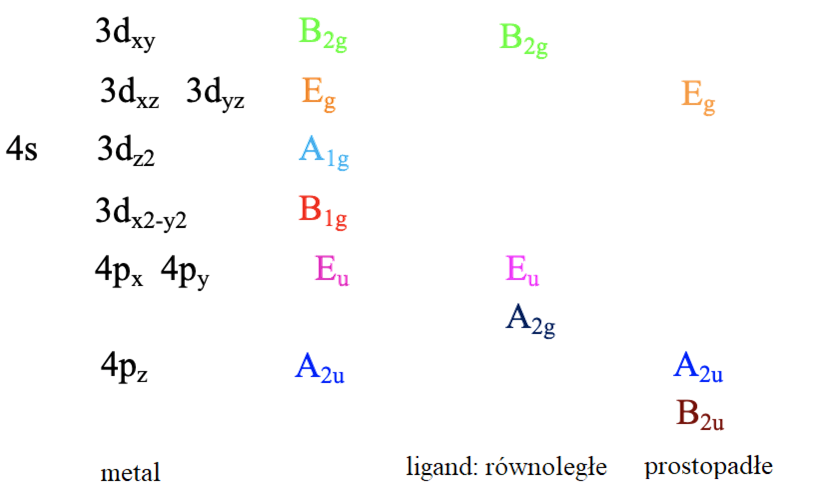 Typy symetrii orbitali granicznych metalu, oraz orbitali ligandów zdolnych do tworzenia wiązań π
Typy symetrii orbitali granicznych metalu, oraz orbitali ligandów zdolnych do tworzenia wiązań π
Widzimy, że wśród orbitali ligandów leżących w płaszczyźnie xy tylko A1g i B1g, a wśród prostopadłych do płaszczyzny xy tylko orbitale Eg mają odpowiednią symetrię. Dlatego bierzemy pod uwagę tylko A1g, B1g i Eg grupy ligandów. W celu uzyskania właściwego diagram dla kwadratowego kompleksu z ligandami cyjanowymi, konieczne jest rozważenie oddziaływania orbitali 4s i 4p z orbitalami π ligandów. Orbital 4s przekształca się jako A1g, a 4p jako A2u i Eu.
Skonstruujmy teraz diagram MO dla kompleksu o symetrii D4h z ligandami cyjanowymi, biorąc pod uwagę zarówno wiązania σ, jak i π na przykładzie anionu kompleksowego [Ni(CN)4]2–. Ze względu na złożoność diagramu nie będziemy modyfikować diagramu MO dla wiązania σ, jak to zrobiliśmy wcześniej, ale skonstruujemy kompletny diagram od podstaw. W przypadku kompleksu [Ni(CN)4]2– orbitale σ grupy ligandów są energetycznie umiejscowione poniżej orbitali d niklu, orbitale π ligandów mają mniej więcej taką samą energię jak orbitale d, a antywiążące orbitale π* ligandów mają energię znacznie wyższa niż orbitale 4p niklu. Widzimy, że jest tylko jeden orbital σ ligandów, o symetrii A1g, może kombinować z 4s i 3dz2, które również mają ten sam typ symetrii. Prowadzi to do utworzenia poziomów wiążącego, nie wiążącego i antywiążącego a1g, które możemy oznaczyć odpowiednio 1a1g, 2a1g i 3a1g. Następnie weźmy pod uwagę orbitale B2g. Jest jeden orbital d o takiej symetrii, i dwa orbitale grupy ligandów (LGO). Oddziaływanie zachodzi praktycznie tylko z wiążącym orbitalem B2g ligandów ponieważ energie dxy i orbitalu wiążącego ligandów są podobne. Prowadzi to do cząsteczkowego orbitalu wiążącego i anty wiążącego typu π o symetrii B2g. Energia antywiążącego orbitalu o symetrii B2g ligandów jest zbyt duża aby w znaczący sposób oddziaływać z orbitalem dxy metalu. Dlatego pozostaje na diagramie z niemal niezmienioną energią. Przejdźmy teraz do orbitali B1g. Mamy orbital dx2-y2 o symetrii B1g i orbital σ ligandów o symetrii B1g. Daje to wiążący i antywiążący orbital cząsteczkowy o symetrii B1g. Dalej rozpatrujemy orbitale Eg. Istnieją dwa orbitale d, dwa π i dwa π* ligandów o tej symetrii. Ponownie, π* ligandów mają zbyt dużą energię, tak że oddziaływanie występuje głównie między dxz, dyz metalu a π ligandów. Prowadzi to do pary wiążących i pary antywiążących orbitali cząsteczkowych; π* ligandów pozostawiamy z niezmienioną energią. Orbitale 4p metalu mają typy symetrii, których jeszcze nie rozważaliśmy: A2u i Eu. Zacznijmy od orbitali Eu. Istnieją dwa orbitale σ, dwa π i dwa π* ligandów o symetrii Eu. Ogólnie mamy cztery pary orbitali o tej symetrii i spodziewamy się czterech par orbitali cząsteczkowych o symetrii Eu. Możemy przyjąć, że będą to poziomy wiążący, słabo wiążący, słabo antywiążący i silnie antywiążący. Możemy je nazwać odpowiednio 1eu, 2eu, 3eu i 4eu. 4eu ma prawie wyłącznie charakter antywiążącego orbitalu π* -EU ligandów ze względu na energię. Przejdźmy teraz do orbitali A2u: istnieją orbitale π i π* ligandów o symetrii A2u, które mogą kombinować z orbitalami 4p o symetrii A2u. Prowadzi to ogólnie do trzech MO A2u, jednego wiążącego, jednego w przybliżeniu niewiążącego i jednego antywiążącego wiązaniu. Wykorzystaliśmy wszystkie orbitale d metalu. Zauważamy, że nadal istnieją pewne niewykorzystane orbitale ligandów, są to π i π* o symetrii A2g oraz B2u, pozostają one niewiążące.
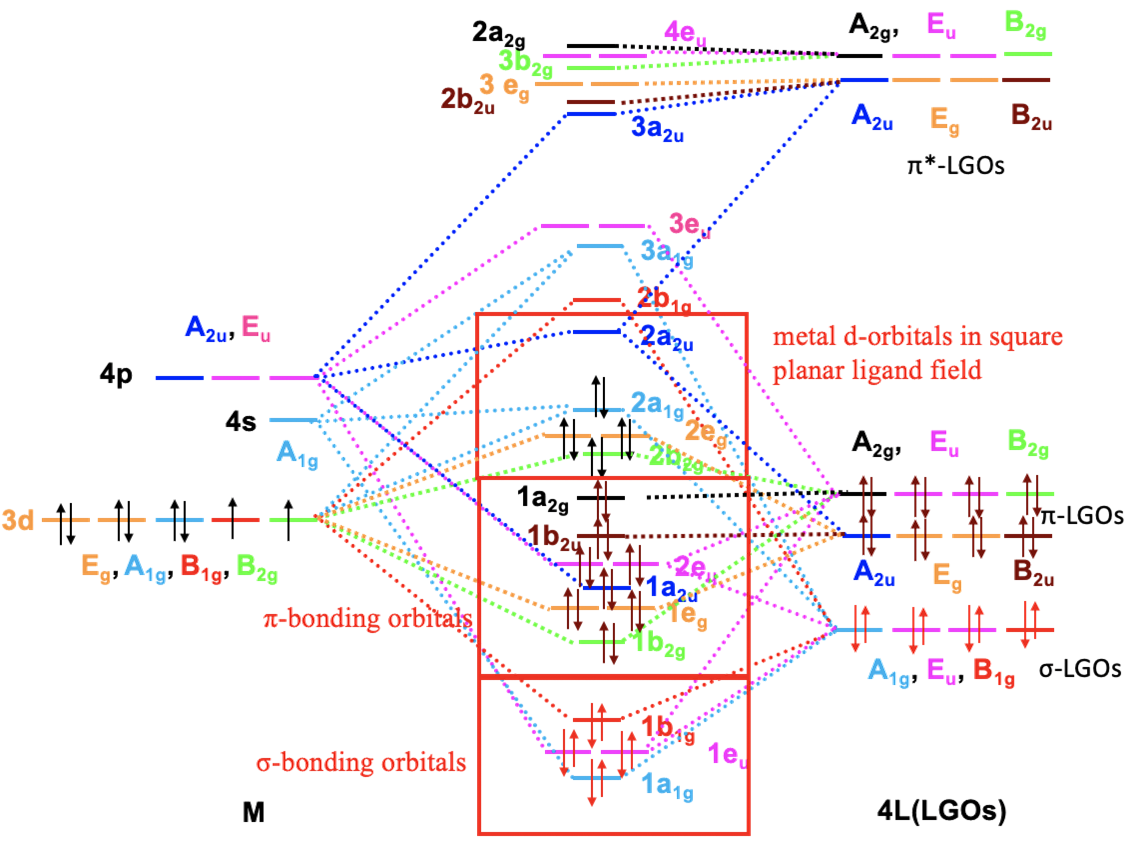 Diagram OM kompleksu płaskokwadratowego z ligandami cyjanowymi z uwzględnieniem wiązania π.
Diagram OM kompleksu płaskokwadratowego z ligandami cyjanowymi z uwzględnieniem wiązania π.
Teraz musimy wypełnić diagram elektronami. Po pierwsze, należy wziąć pod uwagę elektrony σ. W sumie jest osiem elektronów pochodzących z czterech zajętych orbitali σ ligandów. Umieszczamy je na orbitalach cząsteczkowych o najniższej energii, czyli 1a1, 1eu i 1b1. W ten sposób mamy cztery wiązania σ w cząsteczce kompleksu (blok wiązań σ). Następnie musimy rozważyć elektrony π ligandów. W sumie jest osiem takich orbitali zawierających 16 elektronów. Umieszczamy je na diagramie na kolejnych orbitalach 1b2g, 1eg, 1a2u, 2eu, 1b2u i 1a2g. Orbitale te są albo wiążące, albo niewiążące, a zatem ogólnie elektrony π liganda ulegają stabilizacji dzięki oddziaływaniom π metal–ligand. Pozostają nam elektrony d metalu. Konfiguracja jonu Ni2+ to d 8, te elektrony trafiają na orbitale 2b2g, 2eg i 2a1g, które są albo niewiążące, albo antywiążące. Oznacza to, że elektrony metalu są ogólnie zdestabilizowane. Takie zachowanie jest zgodne z charakterem liganda cyjanowego będącym donorem π. Wyjaśnia to również fakt, że planarne kompleksy kwadratowe są najczęściej 16– a nie 18–elektronowe. Gdybyśmy mieli jeszcze dwa elektrony, musiałyby one znaleźć się na znacznie wyżej energetycznym orbitalu 2a2u. Różnica energii między orbitalami 2a2u i 2a1g jest znacznie większa niż między orbitalami 1a1g, 2b2g i 2eg. Ogólnie rzecz biorąc, możemy nazwać orbitale 2au, 2a1g, 2eg i 2bg rozszczepionymi orbitalami d w kwadratowym płaskim polu ligandów. W takim polu ligandów mamy trzy parametry rozszczepienia ∆. ∆3 to różnica energii orbitali 2b2g i 2eg, ∆2 to różnica energii orbitali 2eg i 2a1g, a ∆1 to różnica energii orbitali 2a1g i 2a2u. ∆1 jest znacznie większe niż pozostałe dwa parametry rozszczepienia. Jest również prawie zawsze większa niż energia sparowania spinów, dlatego planarne kompleksy kwadratowe są prawie zawsze kompleksami niskospinowymi. Ogólnie widzimy, że diagram MO może stać się bardzo złożony, nawet dla stosunkowo prostej cząsteczki o stosunkowo wysokiej symetrii.