 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Grupa 14 – Węglowce
Grupa 14 – Węglowce
Węgiel
Pod względem rozpowszechnienia w skorupie ziemskiej zajmuje czternaste miejsce z udziałem 0,08%. Głównie występuje w postaci węglanów oraz wolnego dwutlenku węgla. Węgle kopalne nie są czystą postacią tego pierwiastka, a produktami mineralizacji drewna. Najstarszym węglem kopalnym (pod względem czasu powstania) jest antracyt zawierający 92% C. Następnie węgiel kamienny - 85%, brunatny - 70% i torf do 50% C.
Czysty węgiel występuje w kilku odmianach alotropowych. Najważniejsze z nich to: grafit, diament i karbin. Ze względu na strukturę krystaliczną ich właściwości fizyczne znacznie się różnią. W diamencie każdy z atomów węgla połączony jest z czterema innymi tworząc bardzo sztywną i wytrzymałą strukturę, będącą faktycznie jedną wielką cząsteczkę. Jest najtrwalszym znanym w przyrodzie minerałem. Czysty diament jest izolatorem, domieszkowany wykazuje cechy półprzewodnika. Kryształy diamentu są bezbarwnymi, przezroczystymi ciałami o gęstości 3,51 g·cm–3. Są jednocześnie bardzo twarde i kruche. Niewielkie domieszki powodują zabarwienia kryształu (znane są również czarne diamenty).
Grafit to najczęściej spotykana forma węgla. Atomy tej formy węgla tworzą luźno połączone ze sobą płaszczyzny zbudowane z sześciokątów. Sadza (bezpostaciowy węgiel), koks, węgiel drzewny są różnymi formami grafitu o większym lub mniejszym uporządkowaniu i wielkości kryształów. Grafit tworzy ciemnoszarą, łuskowatą, łatwo łupliwą masę, lekko tłustawą w dotyku. Dobrze przewodzi prąd i ciepło. Przemiana grafitu w diament zachodzi przy wysokim ciśnieniu i temperaturze.
Trzecią, niedawno poznaną formą węgla jest karbin. Atomy węgla w tej odmianie tworzą ze sobą długie łańcuchy. Znane są dwa ich rodzaje, o podwójnym i mieszanym wiązaniu. W pierwszym przypadku pomiędzy atomami węgla występują podwójne wiązania, w drugim, naprzemiennie pojedyncze i podwójne. W naturze karbiny znaleziono w kraterze meteorytowym w Niemczech.
Innymi postaciami węgla są fulereny, będące sferycznymi układami atomów węgla zbudowanymi z kilkudziesięciu atomów węgla. Podejrzewa się występowanie takich struktur w przestrzeni kosmicznej.
Węgiel ma najwyższą ze wszystkich pierwiastków temperaturę topnienia (ok. 3700°C). W temperaturze pokojowej charakteryzuje się słabą reaktywnością. W wysokiej temperaturze reaguje bezpośrednio z większością pierwiastków. Węgiel, ze względu na tendencję do tworzenia skomplikowanych struktur, tworzy wielką grupę związków na bazie węglowodorów (miliony).
Węgiel występuje w stanie wolnym w postaci grafitu i diamentu. Jest składnikiem materii ożywionej i minerałów. Większość ważniejszych skał to sole kwasu węglowego (np. kreda). Węgiel kamienny jest pozostałością roślin karbońskich, ropa naftowa i gaz ziemny to głównie produkty rozkładu organizmów zwierzęcych. W atmosferze i oceanach występuje głównie jako dwutlenek węgla. Głównym źródłem diamentów są złoża w Rosji i RPA. Naturalny, "czysty" grafit występuje m.in. na Cejlonie, Madagaskarze i w Kalifornii, a w postaci węgla kamiennego – na całym świecie. W wierzchniej warstwie skorupy ziemskiej (litosfera, hydrosfera, atmosfera) zajmuje pod względem występowania ok. 14 miejsca (procenty wagowe).
Głównym źródłem węgla są kopaliny. Diamenty, zarówno naturalne jak i syntetyczne, powstają z grafitu pod wysokim ciśnieniem i w wysokiej temperaturze (3000K i 1,25 MPa). Czysty grafit syntetyczny otrzymuje się przez podgrzewanie związków węgla do wysokich temperatur (ok. 2500K).
Najbardziej popularnym sposobem jego wykorzystania było i jest nadal, używanie go jako paliwa do ogrzewania i produkcji energii elektrycznej. Czysty grafit jest szeroko stosowany w przemyśle. Ze względu na żaroodporność i dobre przewodzenie ciepła używa się go do wyrobu tygli do topienia oraz elektrod. Produkuje się z niego smary i barwniki. W energetyce jądrowej używany jest jako moderator w niektórych typach starszych reaktorów. W procesie odgazowania węgla powstaje koks, którego używa się w hutnictwie w procesie wielkopiecowym i jako paliwo opałowe. Sadzę wykorzystuje się przede wszystkim do barwienia i podczas produkcji kauczuku. Postać węgla, zwana węglem aktywnym cechuje się dużą zdolnością adsorpcyjną. Znalazł on zastosowanie w różnego rodzaju filtrach. Węgiel, a właściwie jego izotop o masie atomowej 14, zużywany jest przy datowaniu skamieniałości i innych organicznych substancji. Jedna dwunasta masy atomu węgla (izotop 12C) została uznana za jednostkę masy atomowej.
| Konfiguracja elektronowa | He 2s2p2 | |
| Masa atomowa | 12,011 | |
| Gęstość [kg·m–3] | 3513 (diament) 2260 | |
| Główny stopień utlenienia | -4; +2; +4 | |
| Izotopy: | masa - zawartość - okres półrozpadu | |
| 12C 13C 14C |
12,000 - 98,892% - stabilny 13.003 - 1,108% 14.003 - ślady - 5730 lat |
|
| Temperatura topnienia [K] | 3820 | |
| Temperatura wrzenia [K] | 5100 | |
| Promień atomowy [pm] | 77 | |
| Promień jonowy C4+ | 30 | |
| Energia jonizacji [kJ·mol–1] |
1086,2 C → C+ 2352,8 C+→ C2+ 4620 C2+ → C3+ 6222 C3+ → C4+ |
|
| Powinowactwo elektronowe [kJ×mol-1] | 121,9 | |
| Elektroujemność (Pauling) | 2,55 | |
| Energia wiązań kowalencyjnych [kJ·mol–1] | C - H C - C C = C C = N C = O |
411 348 614 615 745 |
Krzem
Ten półmetaliczny pierwiastek tworzy szaroczarne, silnie błyszczące kryształy, podobne w strukturze do diamentu lub brązową postać amorficzną. Jest ważnym półprzewodnikiem. Ze względu na dużą reaktywność, w odróżnieniu od będącego w tej samej grupie węgla nie występuje w przyrodzie w stanie wolnym. W pokojowych temperaturach jest bardzo obojętny, wiąże się tylko z fluorem. W wyższych temperaturach reaguje z wieloma metalami, azotem, chlorem i tlenem atmosferycznym tworząc z nim warstewkę dwutlenku krzemu (krzemionki). Jest praktycznie nierozpuszczalny we wszystkich kwasach. Wyjątek stanowi tu tylko mieszanina kwasu azotowego i fluorowodorowego. Łatwo rozpuszcza się w gorących ługach tworząc krzemiany. Wdychanie w dużych ilościach pyłu krzemiennego prowadzi do poważnej choroby płuc. Krzem jest, po tlenie, najbardziej rozpowszechnionym pierwiastkiem na Ziemi. Jego zawartość w skorupie ziemskiej wynosi 27,7%. Najważniejsze jego związki to krzemiany (szczególnie litowców i berylowców), oraz dwutlenek krzemu czyli popularna krzemionka (Si02), występująca w wielu postaciach i będąca podstawowym składnikiem niemal wszystkich skał i piasków. Meteory zawierają duże ilości tego pierwiastka. Wolny krzem otrzymuje się przez redukcję krzemionki magnezem, glinem, węglem lub węglikiem wapnia. Czyste kryształy tego pierwiastka, używane w technice półprzewodnikowej, uzyskuje się poprzez powolne ich narastanie w specjalnych piecach (metoda Czochralskiego). Krzem dodawany do stali zmienia jej właściwości powodując zmniejszenie pętli histerezy (budowa rdzeni transformatorów) czy zwiększenie odporności na substancje żrące (pojemniki). Dodawany jest także do stopów miedzi, brązu i mosiądzu. Półprzewodzący krzem, ze względu na dostępność, jest podstawowym budulcem półprzewodnikowych urządzeń elektronicznych. Krzemionka oraz jej równie trwałe i odporne chemicznie pochodne są podstawą takich przemysłów jak: szklarski (emalie, szkło) czy budowlany (cementy, cegły). Tworzy ona wiele odmian i struktur krystalicznych, spośród których najbardziej popularny jest kwarc używany do produkcji m.in. szkła laboratoryjnego i lamp ultrafioletowych (ze względu na przepuszczani promieniowania ultrafioletowego). Najważniejszą solą kwasu krzemowego jest bezbarwny i amorficzny krzemian sodowy Na2SiO3. Rozpuszczony w wodzie tworzy tzw. szkło wodne używane do konserwowania jaj, jako klej, niepalny dodatek do ogniotrwałych substancji, wypełniacz oraz składnik substancji czyszczących i mydła. Twardy karborund, związek krzemu i węgla, stosuje się go jako materiał ścierny.
Związki krzemu:
- –4 stopień utlenienia
Na tym stopniu utlenienia krzem tworzy połączenia z metalami – krzemki. Otrzymuje się je w wyniku reakcji substancji prostych w temperaturach 973-1473K, lub w wyniku działania krzemem na tlenki metali w wyższych temperaturach i atmosferze obojętnej:
2Mg + Si → Mg2Si
6MnO + 5Si → 2Mn3Si + 3SiO
W zależności od rodzaju metalu charakter wiązania M-Si zmienia się od jonowo-kowalencyjnego do metalicznego. Krzemki metali alkalicznych i ziem alkalicznych oraz metali d-elektronowych I i II grupy układu okresowego są półprzewodnikami. Pod względem chemicznym nie są trwałe, ulegają rozkładowi pod wpływem wody i kwasów. Często mają skład odpowiadający ułamkowym stopniom utlenienia pierwiastków. Krzemki zawierające dużą ilość krzemu są odporne na działanie kwasów i utlenianie. Znaczna ilość krzemków metali d- i f-elektronowych charakteryzuje się dużą twardością i wysokimi temperaturami topnienia. Są stosowane przy otrzymywaniu stopów odpornych na działanie kwasów i wysokich temperatur oraz jako wysokotemperaturowe półprzewodniki. Krzemki metali f-elektronowych znalazły zastosowanie w energetyce jądrowej jako pochłaniacze neutronów.
- +4 stopień utlenienia
Halogenki krzemu(IV) – SiHal4– w temperaturze pokojowej krzem reaguje tylko z fluorem:
Si + 2F2 → SiF4
Tetrafluorek krzemu można też otrzymać w wyniku reakcji krzemionki z fluorowodorem wobec kwasu siarkowego(VI). Pozostałe halogenki otrzymuje się w podwyższonych temperaturach w wyniku syntezy z substancji prostych.
| SiF4 - gaz | SiCl4 - ciecz | SiBr4 - ciecz | SiJ4 - ciało stałe | |
| Temperatura topnienia [K] | – | 205 | 278,5 | 393,5 |
| Temperatura wrzenia [K] | 177,5 | 330,8 | 425,8 | 560,5 |
| dSi-Hal [nm] | 0,155 | 0,201 | 0,215 | 0,243 |
Halogenki mają charakter kwaśny, łatwo ulegają hydrolizie. Kwaśny charakter tych związków widoczny jest w reakcjach z halogenkami metali alkalicznych:
SiF4 + 2KF → K2SiF6
Odpowiadający tej soli kwas – H2SiF6 – jest silnym kwasem o mocy porównywalnej do kwasu siarkowego(VI). W stanie czystym ulega rozkładowi na tetrafluorek krzemu i fluorowodór. Z roztworów w obniżonej temperaturze daje się wydzielić kryształy H2SiF6·2H2O, o temperaturze wrzenia 292K. Fluorokrzemiany metali otrzymuje się działając fluorowodorem na mieszaninę krzemionki i fluorku metalu. Większość z nich jest dobrze rozpuszczalna w wodzie. Największe znaczenia ma sześciofluorek sodu stosowany przy produkcji cementów kwasoodpornych i emalii. Znajduje też zastosowanie jako środek przeciw szkodnikom w gospodarstwach domowych oraz do zabezpieczania konstrukcji drewnianych przed gniciem i pożarem.
Krzemowodory – SinH2n+2 – silany – otrzymuje się je w wyniku redukcji polimerycznych chlorków krzemu za pomocą LiAlH4:
SinCl2n+2 + nLiAlH4 → SinH2n+2 + nLiCl + nAlCl3
lub w wyniku redukcji krzemionki glinowodorkiem litu w bardziej drastycznych warunkach. Ewentualnie można je otrzymać w wyniku hydrolizy krzemków: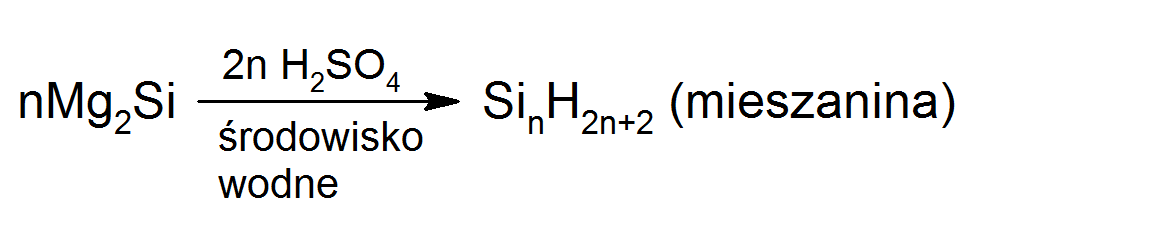
Silany pod względem składu i właściwości fizycznych są podobne do węglowodorów:
| SiH4 - gaz | Si2H6 - gaz | Si3H8 - ciecz | Si4H10 - ciało stałe | |
| Temperatura topnienia [K] | 88,3 | 140,5 | 156 | 179,5 |
| Temperatura wrzenia [K] | 161 | 258 | 326 | 359 |
Większość silanów w powietrzu ulega samozapaleniu z wydzieleniem znacznych ilości ciepła. Z fluorowcami reagują wybuchowo. Wykazują właściwości kwaśne o czym świadczy reakcja z zasadami:
SiH4 + 2KOH + H2O → K2SiO3 + H2
W środowisku kwaśnym i obojętnym silany są trwałe.
Tlenek krzemu(IV) – SiO2 – bezwodnik kwasów krzemowych, bezbarwne ciało stałe o temperaturze topnienia 1710oC, nierozpuszczalne w wodzie i kwasach (oprócz fluorowodorowego). Tworzy odmiany krystaliczne (kwarc, trydymit, krystobalit). Występuje jako minerał, główny składnik piasków i piaskowców, w formie uwodnionej – jako chalcedon i jego odmiany. Znajduje zastosowanie przy produkcji szkła i materiałów budowlanych.
Jako bezwodnik kwasów krzemowych tworzy krzemiany o ogólnym wzorze mSiO2·nH2O, które występują w przyrodzie w stanie wolnym, są one nierozpuszczalne w wodzie i kwasach. Krzemiany naturalne odpowiadają kwasom o m = 1 i n = 2, H2SiO4 – kwas ortokrzemowy; m = 2 i n = 1 H2Si2O3 – kwas dwumetakrzemowy; m = 2 i n = 3 H2Si2O7. Głównymi krzemianami są: wolastonit CaSiO3, oliwiny – (Mg,FeII)2SiO4, baryzalit – Pb3Si2O7. Złożone krzemiany mają różne struktury zbudowane z czworościanów SiO44–, przykładowo łańcuchowe, wstęgowe, warstwowe. Laboratoryjnie otrzymuje się metakrzemiany o ogólnym wzorze Me2ISiO3 stapiając z sodą lub wodorotlenkami krzemionkę. Rozpuszczalnymi w wodzie są jednie krzemiany sodu i potasu, które tworzą tzw. szkło wodne. Szkło jest złożonym krzemianem sodowo-wapniowym.
Kwasy krzemowe – ponieważ krzemionka nie rozpuszcza się w wodzie, kwasy krzemowe można otrzymać poprzez działanie kwasami na krzemiany lub hydrolizę niektórych związków Si(IV):
Na2SiO3 + 2HCl → H2SiO3 (kwas metakrzemowy) + NaCl
SiS2 + 4H2O → H4SiO4 (kwas ortokrzemowy) + 2H2S
Kwasy krzemowe ulegają polimeryzacji co prowadzi do wydzielenia ich w postaci żelu. Ogrzewanie żelu kwasów polikrzemowych powoduje ich odwodnienie z utworzeniem krzemionki tzw. silikażelu stosowanego jako adsorbent.
Siarczek krzemu(IV) – SiS2 – bezbarwny, krystaliczny związek, otrzymywany w reakcji substancji prostych w temperaturze 873K bez dostępu powietrza lub w wyniku reakcji pomiędzy krzemem i siarkowodorem w temperaturze 1573K. Temperatura topnienia 11363K, wrzenia 1403K. Ulega działaniu wody:
SiS2 + 2H2O → SiO2 + 2H2S
i alkalicznych siarczków z utworzeniem tiokrzemianów:
SiS2 + Na2S → Na2SiS3
Węglik krzemu(IV) – SiC – karborund – występuje w dwóch odmianach – kubicznej typu diamentu i heksagonalnej. Jest substancją trudnotopliwą (temp. topnienia 3103K) i twardą (9 w skali Mosha). Otrzymuje się go w piecach elektrycznych prażąc mieszaninę krzemionki i koksu w temperaturze 2273-2473K.
Azotek krzemu(IV) – Si3N4 – biały proszek. Sublimuje w temperaturze około 2173K. Trwały chemicznie, odporny na działanie HF i zasad. Jedynie stapiany z zasadami wchodzi w reakcje z utworzeniem ortokrzemianów i amoniaku. Wykazuje własności półprzewodnikowe.
Diazotokrzemian wodoru – H2SiN2 – analog cyjanamidu. Jest związkiem polimerycznym, otrzymywanym w wyniku amonolizy tetrachlorku krzemu:
SiCl4 + 6NH3 → H2SiN2 + 4NH4Cl
| Konfiguracja elektronowa | Ne 3s23p2 | |
| Masa atomowa | 28,09 | |
| Gęstość [kg·m–3] | 2329 (293K) | |
| Główny stopień utlenienia | +2; +4 | |
| Izotopy: | masa - zawartość - okres półrozpadu | |
| 28Si 29Si 30Si 32Si |
27,977 - 92,23% - stabilny 28,976 - 4,67% - stabilny 29,974 - 3,10% - stabilny 31,974 - 0% - 650 lat |
|
| Temperatura topnienia [K] | 1683K | |
| Temperatura wrzenia [K] | 2628K | |
| Promień atomowy [pm] | 117 | |
| Powinowactwo elektronowe [kJ·mol–1] | 133,6 | |
| Energia jonizacji [kJ·mol–1] | 786,5 Si → Si+ + e– 1577,4 Si+ → Si2+ + e– 3231,4 Si2+ → Si3+ + e– 4355,5 Si3+ → Si4+ + e– |
|
| Elektroujemność (Pauling) | 1,90 | |
| Energia wiązań kowalencyjnych [kJ·mol–1] | Si-H Si-C Si-O Si-F Si-Cl Si-Si |
326 301 486 582 391 226 |
German
German jest bardzo kruchym, szarobiałym i błyszczącym metalem. Pierwiastek ten tworzy kryształy o sieci krystalicznej podobnej do sieci diamentu. Jest bardzo popularnym półprzewodnikiem. Własności chemiczne germanu są zbliżone do własności innych członków jego grupy (węgiel, krzem, cyna). German jest pierwiastkiem śladowym. Ze względu na własności podobne do krzemu czasami zastępuje krzem w krzemianach tworząc germanit. Występuje w rudach srebra, cynku i miedzi. Dobrym źródłem germanu są popioły węglowe. Minerałami germanu są argyrodyt 4Ag2S·GeS2 i germanit Cu3(Ge,Fe)S4. Zawartość w skorupie ziemskiej 0,0007% wagowych. Większość spotykanych metod otrzymywania germanu polega na utlenieniu jego rud do tlenku germanu (GeO2). Następnym krokiem jest oczyszczenie tlenku poprzez przereagowanie go ze stężonym kwasem solnym. Produktem tej reakcji jest chlorek germanu (GeCl4), z którego można otrzymać tlenek. Czysty german uzyskuje się poprzez redukcję tego tlenku wodorem. Dziedziną, w której wykorzystuje się półprzewodzący german jest elektrotechnika. Pierwiastek ten pełnił w niej ważną rolę w momencie rodzenia się technologii półprzewodnikowych (II wojna światowa - detektory sygnałów radarowych). Pierwszy tranzystor zbudowany był na bazie germanu. Obecnie wypiera go tańszy i bardziej dostępny krzem. German pozostał jednak w użyciu wszędzie tam, gdzie właściwości krzemu są nie wystarczające (detektory podczerwieni, odbiorniki w technice światłowodowej, baterie słoneczne). W stopach z aluminium zwiększa podatność na walcowanie. Tlenek germanu (GeO2) dodany do szkła zwiększa współczynnik załamania światła. Ze względu na tę właściwość stosuje się go w technice światłowodowej. Związki germanu dodane do akumulatorów zwiększają ich trwałość.
Związki germanu:
- +2 stopień utlenienia (związki germanu(II) są silnymi reduktorami)
Chlorek germanu(II) – GeCl2 – powstaje w wyniku przepuszczenia par GeCl4 nad rozgrzanym germanem:
GeCl4 + Ge ↔ 2GeCl2
Jest substancją stałą o silnym zapachu. Podczas ogrzewania rozpada się na chlorek germanu(IV) i german. Jego roztwór w kwasie solnym jest silnym reduktorem.
Tlenek germanu(II) – GeO – powstaje jako żółty hydrat po zmieszaniu soli germanu(II) z wodorotlenkiem sodowym:
GeCl2 + 2NaOH → GeO·H2O + 2NaCl
- +4 stopień utlenienia
Wodorki germanu(IV) – Ge tworzy szereg związków z wodorem. Germanowodór otrzymuje się w wyniku reakcji tetrachlorku germanu z tetrahydroglinianem litu w eterze:
GeCl4 + LiAlH4 → GeH4 + LiAlCl4
Jest on gazem o temperaturze topnienia 107K i wrzenia 185K. Następne w szeregu germanowodory są cieczami: dwugermanowodór (temp. top. 164K, wrzenia 303K) i trójgermanowodór (temp. top. 167K, wrzenia 384K). Obok tych połączeń znane są nienasycone germanowodory powstające w wyniku hydrolizy germanku wapnia (CaGe) lub germanku sodu (NaGe): poligermanowodór (GeH2)n – żółty i (GeH)n – ciemnobrunatny, są związkami ulegającymi samozapłonowi.
– otrzymuje się w wyniku działania fluorowców na german. Gazowy fluorek germanu(IV) tworzy z wodą hydrat GeF4·3H2O. W reakcji z fluorkiem potasu powstaje bezbarwny K2GeF6. Chlorek germanu(IV) jest bezbarwną cieczą, która w obecności wilgoci powoli hydrolizuje, tworząc hydraty dwutlenku germanu i chlorowodór. Jodek germanu w temperaturach powyżej temperatury topnienia rozkłada się na GeJ2 i jod.
Tlenek germanu(IV) – GeO2 – powstaje w wyniku ogrzewania germanu w formie białego proszku o temperaturze topnienia 1388K. Jest związkiem trudno rozpuszczalnym w kwasach. W zasadach rozpuszcza się łatwo tworząc germaniany typu M4GeO4 lub M3GeO3.
| Konfiguracja elektronowa | Ar 3d104s24p2 | |
| Masa atomowa | 72,61 | |
| Gęstość [kg·m–3] | 5323 (293K) | |
| Główny stopień utlenienia | +2; +4 | |
| Izotopy: | masa - zawartość - okres półrozpadu | |
| 68Ge 70Ge 71Ge 72Ge 73Ge 74Ge 76Ge 77Ge |
67,928 - 0% - 287 dni 69,924 - 20,5% - stabilny 70,925 - 0% - 11,4 dni 71,923 - 27,4% - stabilny 72,923 - 7,8% - stabilny 73,922 - 36,5% - stabilny 75,921 - 7,8% - stabilny 0% - 11,3 godz. |
|
| Temperatura topnienia [K] | 1210,6 | |
| Temperatura wrzenia [K] | 3103 | |
| Promień atomowy [pm] | 122,5 | |
| Powinowactwo elektronowe [kJ·mol–1] | 116 | |
| Energia jonizacji [kJ·mol–1] | 762,1 Ge → Ge+ 1537 Ge+ → Ge2+ 3302 Ge2+ → Ge3+ |
|
| Elektroujemność (Pauling) | 2,01 | |
| Energia wiązań kowalencyjnych [kJ·mol–1] | Ge-H Ge-C Ge-O Ge-F Ge-Cl Ge-Ge |
288 237 363 646 340 163 |
Cyna
Pierwiastek ten jest miękkim, kowalnym, srebrzystym metalem. Nie występuje w stanie wolnym. Minerałami cyny są kasyteryt SnO2 oraz stannin - Cu2FeSnS4. Zawartość w skorupie ziemskiej to około 0,004% wagowych. Ze względu na niską temperaturę topnienia, łatwość odlewania oraz dobre własności mechaniczne cyna była dość powszechnie używana do wyrobu przedmiotów codziennego użytku. Przedmioty cynowe były bardzo popularne od wczesnego średniowiecza; największy rozkwit produkcji przedmiotów z cyny miał miejsce pomiędzy XIV i XVI w. Cyny używa się do pokrywania innych metali cienką warstwą antykorozyjną. Proces cynowania stosowany jest do zabezpieczania naczyń stalowych, stosowanych w przemyśle spożywczym, np. puszek do konserw. Stop cyny i ołowiu ma niską temperaturę topnienia (np. przy 61,9% wag. cyny jest to temperatura 183 °C) i stosowany był w przemyśle i elektrotechnice jako lut do łączenia innych metali poprzez lutowanie. Po 1 lipca 2006 w związku z wycofywaniem w krajach Unii Europejskiej produktów zawierających ołów przechodzi się na lutowanie bezołowiowe, zastępując ołów niewielkim dodatkiem srebra, miedzi i bizmutu. Cyna jest również składnikiem stopu drukarskiego do wyrobu czcionek. Występuje w nim wraz z ołowiem (głównym składnikiem) oraz antymonem. Stopami cyny i miedzi są brąz cynowy oraz spiż (zawierający także cynk i ołów), używany do odlewania dzwonów.
W warunkach standardowych występuje w odmianie β, zwanej cyną białą, trwałej powyżej 13,2 °C. Odmiana ta ma sieć krystaliczną w układzie tetragonalnym, o gęstości 7,3 g/cm3. W niższej temperaturze przechodzi w odmianę regularną α o gęstości 5,85 g/cm3. Zmiana gęstości jest równoznaczna ze zmianą objętości, co powoduje, że cyna rozpada się, tworząc szary proszek zwany cyną szarą. Zjawisko to nazywane jest zarazą cynową. Czysta cyna biała jest ciągliwa i kowalna, odporna na korozję.
Związki cyny:
Halogenki– Znane są wszystkie halogenki cyny na obydwu tj. +4 i +2 stopniach utlenienia. SnF2 i SnCl2, otrzymywane są przez ogrzewanie cyny z gazowym HF lub HCl. Fluorek cyny(II), trudno rozpuszczalny w wodzie, jest stosowany do fluorowania pasty do zębów. SnCl2 ulega pod działaniem wody hydrolizie do zasadowego chlorku, z rozcieńczonych kwaśnych roztworów można jednak wykrystalizować SnCl2·2H2O. Obydwa halogenki rozpuszczają się w roztworach zawierających nadmiar jonów halogenkowych z utworzeniem [MX3]–.
Wodorek cyny(IV) – SnH4 – jest bezbarwnym, nietrwałym gazem, który mo.zna uważać za analog metanu.
Metaloorganiczne związki cyny – pierwszym ootrzymanym związkiem tego rodzaju był jodek dietylocyny (C2H5)2SnI2 zsyntezowany przez Edwarda Franklanda w 1849 roku. Większość związków tego rodzaju występuje w formie ciekłej lub ciał stałych nie ulegających rozkładowi pod wpływem wody i powierza. Niektóre z nich są silnie toksyczne i znajdują zastosowanie jako biocydy.
| Konfiguracja elektronowa | Kr 4d105s2 |
| Masa atomowa | 118,71 |
| Gęstość [kg·m–3] | 7365 (β) 5769 (α) |
| Główny stopień utlenienia | +4, +2 |
| Temperatura topnienia [K] | 505,05 |
| Temperatura wrzenia [K] | 2875 |
| Promień atomowy [pm] | 145 |
| Powinowactwo elektronowe [kJ·mol–1] | 1.11 |
| Energia jonizacji [kJ·mol–1] | 708,6 Sn → Sn+ 1411,8 Sn+ → Sn2+ 2943 Sn2+ → Sn3+ |
| Elektroujemność (Pauling) | 1,96 |
Ołów
Jest miękkim, kowalnym metalem. Tworzy związki na +2 i +4 stopniu utlenienia. Świeża powierchnia metalu ma kolor białawo-niebieski, na powietrzu matowieje do barwy szarej. Ma najwyższą liczbę atomową ze wszystkich stabilnych pierwiastków, kończy trzy szeregi rozpadu cięższych pierwiastków promieniotwórczych. Wystawiony na działanie wilgotnego powietrza pokrywa się warstwą o zmiennym składzie, w którym znajdują się węglamn ołowiu(II), siuarczan(VI) ołowiu(II) i chlorek ołowiu(II). Z fluorem reaguje już w temperaturze pokojowej, a z chlorem po podgrzaniu. Z tlenowcami reaguje po stopieniu. W reakcjach tworzą się związki na +2 stopniu utlenienia. Metaliczny ołów jest odporny na działanie kwasów siarkowego(VI) i fosforowego(V), ale nie chlorowodorowego i azotowego(V). Wynik działania kwasów zależy od nierozpuszczalności i następującej pasywacji powstającej soli. Kwasy organiczne, jak kwas octowy, roztwarzają ołów w obecności tlenu. Stężone zasady roztwarzają ołów z wytworzeniem ołowianów. Tworzenie związków na _2 stopniu ulenienia wynika z inertności pary elektronowej na orboitalu 6s. Jony ołowiu(II) są bezbarwne w roztworach i ulegają częściowej hydrolizie w wodzie z wytworzeniem [Pb(OH)]+. Fluorek ołowiu(II) odkryty przez M. Faradaya w 1934 roku, był pierwszym jonowym związkiem chemicznym, przewodzącym prąd w ciele stałym. Inne dwuhalogenki rozkładają się pod działaniem ultrafioletu bądź światła widzialnego - zwłaszcza jodek ołowiu(II). Tlenek ołowiu(II) występuje w dwóch formach, czerwonej α-PbO i żółtej β-PbO, ta ostatnia jest stabilna tylko powyżej około 488 °C. Na +4 stopniu utlenienia ołów tworzy nieliczne związki nieorgancizne istniejące w silnie kwaśnych roztworach. Natomiast tlenek PbO utleniany tworzy mieszany tlenek Pb3O4 o wzorze 2PbO·PbO2.
| Konfiguracja elektronowa | [Xe]4f145d106s26p2 |
| Masa atomowa | 207,2 |
| Gęstość [kg·m–3] | 11340 (293K) |
| Główny stopień utlenienia | +2; +4 |
| Temperatura topnienia [K] | 600,65 |
| Temperatura wrzenia [K] | 2022 |
| Promień atomowy [pm] | 180 |
| Energia jonizacji [kJ·mol–1] | 715,6 (I) 1450 (II) 3081 (III) |
| Elektroujemność (Pauling) | 2,33 |