 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Równowaga chemiczna
Równowaga chemiczna
Doświadczalnie stwierdzono, że gdy zachodzi reakcja chemiczna to przekształcenie substratów w produkty nie zachodzi do końca, bez względu na czas trwania reakcji. W stanie początkowym stężenie substratów jest ściśle określone, a w czasie przebiegu reakcji zmniejsza się osiągając pewną wartość, która pozostaje stała. Stan taki trwający tak długo jak długo nie ulegają zmianie zewnętrzne czynniki oddziałujące na układ nosi nazwę stanu równowagi (Równowagi w roztworach wodnych zostały omówione w innym miejscu serwisu).
Stan równowagi i działanie mas
Jak przykład reakcji osiągającej stan równowagi rozpatrzmy proces opisany równaniem:
A + B → C + D
w której jedna cząsteczka A reaguje z jedną cząsteczką B i powstają jedna cząsteczka C oraz jedna cząsteczka D. Początkowo stężenie A ma określoną wartość determinowaną liczbą moli substancji A oraz objętością naczynia (roztworu). W miarę upływu czasu stężenie A maleje, początkowo szybko, a później coraz wolniej. W końcu stężenie A osiąga pewien poziom i pozostaje stałe. Podobnie zmienia się stężenie substratu B. Początkowe stężenia produktów C i D są równe zeru, a z upływem czasu reakcji rosną, początkowo szybko, aż do osiągnięcia pewnej stałej wartości. W momencie gdy zostaje osiągnięty stan równowagi pomiędzy reakcjami przebiegającymi od lewej do prawej i od prawej do lewej, przeciwne reakcje przebiegają z taką samą szybkością. Tym samym odwracalność i równowaga chemiczna są ze sobą ściśle związane. Doświadczalnie stwierdzono, że każdej reakcji odpowiada ściśle pewien określony stan równowagi. W ogólnym przypadku dla reakcji:
nA + mB + … ↔ pC + qD + ...
można zapisać wyrażenie na zależność, która jest stała w stanie równowagi, i ma postać:
![]()
Ułamek po lewej stronie równości nosi nazwę wyrażenia na działanie mas, a nawiasy w nim przedstawione oznaczają stężenia wyrażone w molach na dm3; współczynniki są wykładnikami potęgi do jakich należy podnieść stężenia. W stanie równowagi ułamek zawierający w liczniku iloczyn stężeń produktów podniesionych do odpowiednich potęg, a w mianowniku stężenia substratów, jest liczbowo równy stałej równowagi K danej reakcji. Zgodnie z przedstawionym zapisem można prawo działania mas podać w formie: W układzie w stanie równowagi stężenia substancji biorących udział w reakcji muszą spełniać warunek taki, że wyraz działania mas musi mieć wartość stałą. Poza tym nie ma żadnych ograniczeń co do stężeń substancji.
Prawo działania mas można wyprowadzić z kinetyki reakcji. Weźmy pod uwagę reakcję: A + B ↔ C + D i rozpatrzmy dwa przypadki:
1. reakcja zachodzi jednostopniowo – w takim przypadku szybkość reakcji biegnącej od substratów do produktów zapisujemy jako równą k[A][B]. Szybkość reakcji odwrotnej wyraża zapis k’[C][D]. W stanie równowagi obydwa wyrażenia są sobie równe czyli k[A][B]=k’[C][D] czyli [C][D]/[A][B]=k/k’ = wartość stała. Czyli wyrażenie na działanie mas jest stałe.
2. Reakcja przebiega przez więcej niż jeden etap odwracalny – przyjmijmy, że w reakcji powstaje jeden produkt przejściowy Q:
A + B ↔ C + Q
Q + B ↔ A + D
dodając do siebie obydwa równania otrzymujemy sumaryczny zapis A + B ↔ C + D. Przyjmijmy, że k1 i k1’ są stałymi szybkości reakcji pierwszej przebiegającej w przeciwnych kierunkach, a k2 i k2’ są stałymi szybkości reakcji drugiej. W stanie równowagi szybkości te będą jednakowe:
k1[A][B]=k1’[[C][Q]
k2[Q][[B]=k2’[A][D]
Po odpowiednim przekształceniu tych równań otrzymuje się zależność:
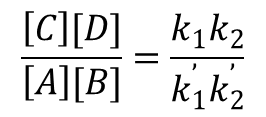
pokazującą, że działanie mas ma wartość stałą.
W układach wielofazowych (reakcje heterogeniczne) w ogólnym przypadku stężenie substancji występującej jako czyste ciało stałe lub czysta ciecz w kontakcie z gazem pozostaje wartością stałą. W związku z tym w równaniu na stałą równowagi wyrażenie na działanie mas nie zawiera stężeń czystych faz skondensowanych.
Przesunięcie równowagi
Jedną z podstawowych reguł dotyczących równowag dynamicznych jest reguła przekory (reguła Le Chateliera-Brauna), mówiąca, że układ, na który działa jakiś bodziec, odpowiada w taki sposób aby przeciwdziałać bodźcowi. Reguła przekory dotyczy układów w stanie równowagi, na które działa czynnik zewnętrzny.
Rozpatrzmy wpływ różnych czynników na reakcję syntezy jodowodoru H2 + I2 ↔ 2HI zachodzącą w fazie gazowej w zamkniętym naczyniu, dla której wyrażenie na stałą równowagi ma postać: K = [HI]2/[H2][I2]. Stężenia składników reakcji w stanie równowagi są niezmienne do momentu aż nie nastąpi jakaś ingerencja z zewnątrz. Przyjmijmy, że do naczynia wprowadzono pewną ilość jednego ze składników. Wzrost stężenia wodoru w układzie spowoduje, że wartość ułamka w wyrażeniu na stałą równowagi będzie mniejsza od wartości równowagowej. Układ dążąc do uzyskania równowagi może postąpić dwojako, albo zmniejszając stężenie jodu lub tez zwiększając stężenie HI. W jednym przypadku następuje zmniejszenie wartości mianownika, a w drugim zwiększenie wartości licznika. Ponieważ jod występuje w układzie w postaci cząsteczek I2 lub HI to zmniejszenie stężenia I2 i wzrost stężenia HI następują równocześnie. Podobnie możemy ten proces rozpatrzeć w oparciu o regułę Le Chateliera-Brauna. Jeżeli równowaga układu zostanie zaburzona przez dodanie wodoru, to układ będzie przeciwdziałał zaburzeniu poprzez zmniejszenie ilości jodu i zwiększenie ilości HI. Inaczej mówiąc równowaga reakcji zostanie przesunięta w kierunku tworzenia produktów. Gdy natomiast zmniejszy się stężenie jednego z substratów to w układzie równowaga reakcji zostanie przesunięta w lewo, w kierunku tworzenia substratów z HI. Zmiana objętości naczynia w tym przypadku nie wpływa na stężenia równowagowe gdyż liczba cząsteczek po lewej i prawej stronie równania jest taka sama. W przypadku reakcji gdzie liczba cząsteczek substratów i produktów jest różna zmiana objętości wpływa na stałą równowagi. Z tego powodu na przykład syntezę amoniaku z wodoru i tlenu prowadzi się w możliwe małych objętościach, tak aby przesunąć równowagę reakcji w kierunku powstawania produktu. Wpływ ciśnienia na równowagę reakcji w fazie gazowej jest połączony ze zmianami liczby cząsteczek po stronie substratów i produktów. W przypadku gdy Vprod.=Vsubstr. zmiany ciśnienia nie wpływają na równowagę reakcji. Gdy Vprod.< Vsubstr. wzrost ciśnienia powoduje przesunięcie równowagi w prawo, a gdy Vprod.> Vsubstr. wzrost ciśnienia przesuwa równowagę w układzie w lewo. Zmiana temperatury zawsze powoduje przesunięcie stanu równowagi chemicznej układu, gdyż zmienia się wartość liczbowa stałej równowagi. W przypadku reakcji egzotermicznych ze wzrostem temperatury maleje wartość stałej K,a tym samy równowaga w układzie przesuwa się w kierunku tworzenia substratów. W reakcjach endotermicznych wzrost temperatury sprzyja tworzeniu produktów.
Reguła przekory nie dotyczy reakcji, w których występuje katalizator, który przecież nie zmienia składu układu w stanie równowagi. Katalizator zwiększa bowiem wartość stałych równowagi reakcji w obydwu kierunkach.