 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Grupa 11 – Miedziowce
Grupa 11 – Miedziowce
Miedź
Miedź jest brązowo-czerwonym, średniotwardym, kowalnym i ciągliwym metalem przejściowym. Jest doskonałym przewodnikiem ciepła i elektryczności, ustępuje jedynie srebru. Jej własności fizyczne zależą w dużej mierze od zawartości tlenu i technologii produkcji. Domieszki pogarszającej przewodnictwo, lecz zwiększają wytrzymałość. Wykazuje, jako metal półszlachetny, dużą odporność na korozję. Pod wpływem tlenu atmosferycznego pokrywa się chroniącą warstwą tlenku. Reaguje z fluorowcami, wilgotnymi fluorowcowodorami, siarką i dwutlenkiem siarki. W wyniku działania substancji zawartych w atmosferze, pokrywa się charakterystyczną zielonkawą patyną będącą mieszaniną zasadowego węglanu (CuCO3(OH)2), siarczanu (VI) miedzi (CuSO4(OH)6) oraz chlorku miedzi(II) (CuCl2). Kwasy nieutleniające atakują miedź tylko w obecności powietrza. Szybko rozpuszcza się w stężonym kwasie siarkowym i azotowym. Miedź i jej związki są zabójcze dla wielu mikroorganizmów. Występuje głównie w postaci siarczków, czasem tlenków. Sporadycznie spotyka się grudki czystego metalu (około 1 % ogólnej ilości miedzi) głównie na terenach Ameryki Północnej (Jezioro Górne, USA). Znajdowano tam bryły miedzi o wadze dochodzącej nawet kilkudziesięciu ton. Najważniejsze złoża miedzi występują w Chile, USA, Rosji, Polsce i niektórych państwach afrykańskich. Zawartość w skorupie ziemskiej 0,01% wagowego. Głównymi minerałami są: chalkozyn Cu2S, kowelin CuS, chalkopiryt CuFeS2, kupryt Cu2O, malachit CuCO3.Cu(OH)2, azuryt 2CuCO3.Cu(OH)2. Produkcja miedzi jest skomplikowanym i dość kosztownym procesem. Głównym jej źródłem są siarczki, które metodami termicznymi i reakcjami redoks doprowadza się do tlenku miedzi, rozkładanego potem termicznie z wydzieleniem tzw. miedzi czarnej. Miedź taką można następnie rafinować dwoma metodami: suchą (stopienie miedzi i utlenienie zanieczyszczeń przy użyciu drewna) i mokrą, gdzie bardzo czystą miedź uzyskuje się dzięki elektrolizie. Ta ostatnia metoda, mimo że droższa, pozwala na odzysk szlachetnych domieszek, występujących w rudzie miedzi (srebro, złoto, platynowce). Z powodu wysokich kosztów produkcji część miedzi jest na powrót odzyskiwana z odpadów. Rosnące zapotrzebowanie na ten metal powoduje powstawanie coraz to nowych metod pozwalających na ekonomiczne wykorzystywanie coraz mniej zasobnych złóż. Istnieje nawet metoda wykorzystywania drobnoustrojów do wzbogacania rud tego pierwiastka. Miedź jest obecnie, obok żelaza i aluminium, jednym z najważniejszych metali używanych przez człowieka. Używa się jej głównie w elektrotechnice, choć zastępuje ją powoli aluminium. Duże przewodnictwo cieplne miedzi znalazło zastosowanie przy produkcji elementów grzejnych i wymienników ciepła. Odporność na korozję wykorzystuje się m.in. na morzu, w budownictwie i przemyśle. Metal ten jest także ważnym katalizatorem. Stopy miedzi znane były od tysiącleci. Najważniejsze z nich to brązy - stopy miedzi z cyną. Zawartość cyny waha się w nich od kilku do około 25 procent. Im większa jest zawartość cyny, tym brąz jest twardszy i wytrzymalszy. Brązy o zawartości cyny do 10% są jeszcze kowalne. Brąz, z którego produkuje się dzwony, zawiera około 25% cyny. Dodawanie niewielkich ilości innych pierwiastków znacznie zmienia właściwości brązu np. fosfor (0,3%) znacznie zwiększa ciągliwość (brąz fosforowy), a dodanie kilku procent krzemu znacznie zwiększa wytrzymałość stopu przy stosunkowo niewielkim wzroście oporności (produkcja styków elektrycznych). Stopy miedzi z cynkiem to tzw. mosiądze. Dzieli się je na kilka rodzajów w zależności od zawartości cynku. Mosiądz czerwony o zawartości cynku 5=20% cechuje się znaczną ciągliwością i odpornością chemiczną. Mosiądz żółty (20% cynku) jest bardziej trwały i twardszy od czerwonego. Kruchy mosiądz biały (>50% cynku) znalazł zastosowanie jako formy odlewnicze. Inne stopy miedzi to np. jednocześnie wytrzymały i ciągliwy stop z glinem (5-10% Al), czy też bardzo odporny chemicznie i wytrzymały stop Monela (70% Ni i 30 Cu). Popularny konstantan jest stopem miedzi z niklem (40% Ni) i dzięki dużemu oporowi właściwemu, praktycznie niezależnemu od temperatury, stosowany jest w elektrotechnice. Związki miedzi są szeroko stosowane w różnych dziedzinach. Cyjanki tego metalu są ważnymi katalizatorami organicznymi. Związki kompleksowe miedzi używane są m.in. przy przetwarzaniu ropy naftowej. Związki miedzi (III) stosowane są jako utleniacze. Roztwór siarczanu(VI) miedzi(II) (CuSO4) jest środkiem grzybobójczym. Wodorotlenek miedzi(II) (Cu(OH)2) ma właściwości rozpuszczania celulozy, którą można później wytrącić w postaci nitek tzw. jedwabiu miedziowego. Tlenek miedzi(I) (Cu2O), ze względu na własności trujące dla niektórych organizmów, jest używany jako składnik farby do pokrywania dna statków. Utrudnia to przyczepianie się do niego wodorostów. Tlenek ten jest także stosowany w chemii analitycznej (wykrywanie reduktorów organicznych).
Związki miedzi:
+1 stopień utlenienia
tlenek miedzi(I) – Cu2O – występuje w przyrodzie jako minerał - kupryt. Powstaje podczas ogrzewania miedzi przy ograniczonym dostępie powietrza, a także podczas ogrzewania CuO w temperach powyżej 1300K. Można go też otrzymać strącają z zasadowych roztworów związków miedzi(II) środkami redukującymi jak: hydrazyna, hydroksyloamina, cukry z grupą aldehydową. Powstający w tym procesie jon Cu+ ulega natychmiast reakcji:
2Cu+ + 2OH– → Cu2O + H2O
Reakcja ta jest podstawą metody wykrywania i oznaczania ilościowego cukrów. Wykorzystuje się roztwór zwany płynem Fehlinga - otrzymuje się go poprzez zmieszanie roztworów CuSO4 i winianu potasowo-sodowego (KNaC4H4O6) z dodatkiem NaOH. W trakcie ogrzewania płynu Fehlinga z glukozą wytrąca się Cu2O w postaci osadu wykazującego początkowo barwę żółtą, a następnie przybierającego barwę czerwoną.
Tlenek miedzi(I) roztwarza się w amoniaku:
Cu2O + 4NH3 + H2O → 2[Cu(NH3)2]OH
Pod działaniem kwasu siarkowego(VI) ulega dysproporcjonowaniu. Ze stężonym kwasem solnym tworzy związek koordynacyjny:
Cu2O + 4HCl → 2H[CuCl2] + H2O
dobrze rozpuszczalny w wodzie.
wodorek miedzi(I) – CuH – czerwonobrunatne ciało stałe powstające w reakcji pomiędzy siarczanem(VI) miedzi(II) i kwasem fosfinowym(I) (H₃PO₂). W stanie wilgotnym łatwo ulega utlenieniu. Czysty związek można otrzymać w wyniku reakcji pomiędzy CuI z LiAlH4 w pirydynie lub eterze.
halogenki miedzi(I) – CuX – gdzie X = Cl, Br, I, związki trudno rozpuszczalne w wodzie; w obecności nadmiaru jonów halogenkowych tworzą rozpuszczalne aniony koordynacyjne [CuX2]– i [CuX3]2–. Suche są odporne na działanie tlenu, ale w obecności wilgoci chlorek i bromek utleniają się do zasadowych soli typu CuCl2·2Cu(OH)
+2 stopień utlenienia
halogenki miedzi(II) – CuX2 – można otrzymać w bezpośredniej reakcji pomiędzy pierwiastkami, jak również rozpuszczając tlenek miedzi(II) w roztworach odpowiednich fluorowodorów. Z roztworów krystalizują związki dwuwodne. Jodek miedzi(II) rozkłada się na jod i CuI. Chlorek i bromek miedzi(II) w stanie stałym tworzą polimeryczne struktury łańcuchowe. Dobrze rozpuszczalne w wodzie i rozpuszczalnikach organicznych. W roztworze wodnym chlorku miedzi występuje równowaga pomiędzy różnymi formami w zależności od stężenia jonów chlorkowych:
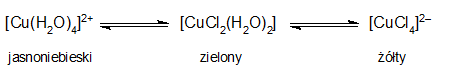 wodorotlenek miedzi(II) – Cu(OH)2 – powstaje jako niebieski galaretowaty osad po dodaniu wodorotlenku litowców do roztworów soli miedzi(II). W wyniku ogrzewania lub pod działaniem nadmiaru jonów wodorotlenkowych ulega odwodnieniu do czarnego tlenku.
wodorotlenek miedzi(II) – Cu(OH)2 – powstaje jako niebieski galaretowaty osad po dodaniu wodorotlenku litowców do roztworów soli miedzi(II). W wyniku ogrzewania lub pod działaniem nadmiaru jonów wodorotlenkowych ulega odwodnieniu do czarnego tlenku.
siarczan(VI) miedzi(II) – CuSO4 – powstaje w wyniku rozpuszczania miedzi w rozcieńczonym kwasie siarkowym(VI) i krystalizuje z pięcioma cząsteczkami wody. W wyniku ogrzewania traci wodę zmieniając barwę z niebieskiej do białej.
azotan(V) miedzi(II) – Cu(NO3)2 – w wyniku rozpuszczania miedzi w kwasie azotowym(V) otrzymuje się hydraty azotanu(V) miedzi(II). Bezwodny związek można otrzymać w wyniku reakcji miedzi z N2O4 rozpuszczonym w octanie etylu.
octan miedzi(II) – Cu(CH3COO)2 – w stanie stałym uwodniony związek ten występuje jako dimer
 Srebro
Srebro
Srebro jest białym, lśniącym metalem przejściowym o przewodności cieplnej i elektrycznej lepszej niż jakikolwiek inny metal. Ten wartościowy i piękny metal znany był już w starożytności. Pierwsze udokumentowane ślady wydobywania srebra pochodzą z Azji Mniejszej z 2500 r. p.n.e. Alchemicy nazywali ten metal Luną lub Dianą i przyporządkowali mu symbol sierpu księżyca. Srebro, pod względem kowalności i plastyczności, ustępuje jedynie złotu. Jest twardsze niż złoto, lecz bardziej miękkie niż miedź. Pierwiastek ten nie jest aktywny chemicznie. Jest nierozpuszczalny w rozcieńczonych kwasach i w alkaliach lecz rozpuszcza się w stężonym kwasie siarkowym(VI) i azotowym(V). W normalnych temperaturach z wodą i tlenem nie reaguje. Siarka i siarczki atakują srebro i niszczą jego powierzchnię tworząc siarczek srebra(I) (Ag2S). Przekonać się o tym mogą ci, którzy używają srebrnych łyżeczek do jedzenia jajek (żółtko jaj zawiera duże ilości siarki). Powstający czarny siarczek srebra(I) jest jedną z najbardziej nierozpuszczalnych soli i dlatego reakcja z siarką wykorzystywana jest w chemii analitycznej do oznaczania ilości jonów srebra. Srebro tworzy związki na +1, +2 i +3 stopniu utlenienia. Metal występuje najczęściej w postaci związków razem z rudami ołowiu, miedzi, cynku i złota. Jako czysty spotyka się je dość rzadko. Najbardziej znane, eksploatowane od wieków złoża, występują w Peru i Norwegii. Srebro można spotkać również w postaci naturalnego stopu ze złotem nazywanego elektrum. Głównymi minerałami są: argentyt Ag2S, pirargiryt Ag3SbS3, prustyt Ag3AsS3, chlorargiryt AgCl(Br;I). Zawartość w skorupie ziemskiej 1·10–6% wag. Metalurgia srebra polega głównie na przekształceniu w wysokiej temperaturze siarczków srebra w siarczany(VI), a następnie redukcji i wytrąceniu metalicznego srebra. Jedną z metod wyizolowywania srebra jest metoda amalgamatowa. Do rudy, która zawiera ten metal, dodaje się rtęć, która tworzy ze srebrem amalgamat. Amalgamat ten jest następnie wydzielany, a czyste srebro otrzymywane jest drogą destylacji. Inną metodą ekstrakcji metalicznego srebra jest tzw. metoda liksydacyjna, w której zawarty w rudzie pierwiastek rozpuszcza się w soli np. cyjanku sodu (NaCN), a następnie wydziela na powierzchni metalicznego cynku lub glinu. Z rud miedzi i ołowiu srebro izoluje się, wykorzystując proces Parkera. Srebro techniczne otrzymuje się najczęściej metodami elektrolitycznymi. Powszechnie znanym wykorzystaniem srebra jest użycie go w wyrobach jubilerskich. Metal ten zwykle stapia się z innymi w celu zwiększenia twardości i wytrzymałości stopu. Srebro wykorzystywane jest również jako warstwa odbijająca w niektórych lustrach. Ze względu na mały opór elektryczny używane jest w przemyśle elektrotechnicznym. Niektóre związki tego pierwiastka są stosowane są jako środki antyseptyczne i bakteriobójcze. Ciemniejące na świetle związki srebra z fluorowcami używane były do produkcji błon światłoczułych. Rozpuszczają się one w tiosiarczanie sodu (Na2S2O3), który pełni rolę utrwalacza.
Związki srebra:
Jest to najczęściej spotykany stopień utlenienia wśród związków srebra. Są one najczęściej trudno rozpuszczalne i krystalizują w postaci soli bezwodnych. Do rozpuszczalnych związków Ag+ należą: fluorek AgF, azotan(V) AgNO3, chloran(V) AgClO3 i chloran(VII) AgClO4. Siarczan(VI) i octan srebra(I) są umiarkowanie rozpuszczalne.
halogenki srebra(II) – można otrzymać w wyniku bezpośredniej syntezy z pierwiastków, lub też, z wyjątkiem fluorku, w postaci osadów po dodaniu jonów halogenkowych do roztworu soli srebra. Fluorek otrzymuje się przez rozpuszczenie tlenku lub węglanu srebra(I) w kwasie fluorowodorowym. Z roztworu wydziela się sól solwatowana, którą przez odwodnienie przeprowadza się w bezwodną, żółtą substancję stałą. Przez rozpuszczenie proszku srebra w roztworze fluorku srebra(I) zakwaszonym HF daje się otrzymać Ag2F. Pozostałe halogenki są trudno rozpuszczalne w wodzie. Rozpuszczalność maleje od białego chlorku (2·10–10) przez żółtawy bromek (5·10–13) do żółtego jodku (8·10–17). Jednak halogenki srebra(I) rozpuszczają się w roztworach zawierających jony halogenkowe z utworzeniem anionów koordynacyjnych typu: AgX2 –, AgX42–, AgX43–. Wszystkie halogenki są wrażliwe na działanie światła. Promieniowanie UV rozkłada wszystkie halogenki srebra(I), a światło widzialne tylko chlorek, bromek i jodek. Jodek srebra(I) ze względu na strukturę podobną do lodu znalazł zastosowanie przy zapobieganiu opadom gradu. Wystrzelenie AgI w chmurę burzową powoduje, kondensację na jego kryształkach i opad deszczu.
tlenek srebra(I) – Ag2O – otrzymanie tego związku z pierwiastków jest trudne i udaje się przy zastosowaniu ciśnień tlenu powyżej 2MPa. Brunatnoczarny związek, zawierający wodę otrzymuje się w wyniku dodania wodorotlenku litowca do roztworu soli srebra(I). Powstający wodorotlenek w normalnych warunkach nie istnieje, a z roztworu wypada uwodniony osad tlenku. Pełne odwodnienie otrzymanego produktu jest trudne gdyż w temperaturze powyżej 433K wydziela się tlen, a powyżej 473K następuje szybki rozkład. Tlenek już w temperaturze pokojowej ulega działaniu wodoru, tlenku węgla czy związków organicznych redukując się do srebra.
siarczek srebra(I) – Ag2S – ze względu na duże powinowactwo srebra do siarki można go otrzymać różnymi metodami. Najprościej jest strącić go z roztworów soli srebra(I) w postaci czarnego osadu. Rozpuszczalność siarczku jest rzędu 10–50.
azotan(V) srebra(I) – AgNO3 – powstaje w wyniku rozpuszczania srebra w kwasie azotowym(V). Jest głównym związkiem srebra. Pod wpływem substancji organicznych lub światła redukuje się do srebra metalicznego. Działa żrąco na skórę powodując koagulację białek. W wyniku ogrzewania najpierw odszczepia tlen tworząc azotan(III) a potem rozkłada się całkowicie:
karboksylany srebra(I) – sole srebra i kwasów karboksylowych mają znaczenie preparatywne w chemii organicznej ponieważ w wyniku ogrzewania łatwo się rozkładają z wydzieleniem CO2. W obecności fluorowców powstają przy tym odpowiednie fluorowcoalkany (reakcja Hunsdieckera). Przykładem może być otrzymywanie trifluorojodometanu:
F3C-COOAg + I2 → CF3I + AgI + CO2
acetylenek srebra(I) – Ag2C2 – strąca się podczas przepuszczania acetylenu przez amoniakalny roztwór azotanu(V) srebra. Jest związkiem bardzo wybuchowym podobnie jak amidek, imidek i azotek srebra(I) powstające w wyniku działania amoniaku na srebro.
+2 stopień utlenienia
Ag(II) otrzymuje się w roztworach wodnych przez utlenianie soli srebra(I) nadtlenodwusiarczanem(VI), fluorem lub ozonem. W roztworach kwaśnych jon Ag2+ jest trwały zwłaszcza w obecności jonów fosforanowych(V), z którymi tworzy trwały związek koordynacyjny. Jony srebra(II) działają silnie utleniająco utleniając nadtlenek wodoru do tlenu, Mn(II) do Mn(VII) czy Cr(III) do Cr(VI).
fluorek srebra(II) – AgF2 – brunatny związek otrzymywany jest przez działanie fluoru na rozdrobnione srebro lub AgCl w temperaturze 473K. Z wodą reaguje gwałtownie z wydzieleniem ozonu.
tlenek srebra(II) – AgO – powstaje w wyniku utlenienia tlenku srebra(I) nadtlenodwusiarczanem(VI) w roztworze alkalicznym lub pod działaniem ozonu na srebro. Ponieważ związek jest diamagnetyczny (konfiguracja jonu Ag - d9 wskazuje na paramagnetyzm) jest to związek o wzorze AgIAgIIIO2. Tlenek ten znajduje zastosowanie w ogniwach galwanicznych o dużej sprawności stosowanych np. na stacjach kosmicznych, zegarkach itp.
+3 stopień utlenienia
W pewnych warunkach srebro daje się utlenić do +3 stopnia. W wyniku działania fluoru na równomolową mieszaninę halogenku srebra(I) i halogenku litowca w wyższych temperaturach otrzymuje się fluorosrebrzany(III):
MCl + AgCl + 2F2 → MAgF4 + Cl2 (M = K, Cs)
Jon Ag(III) może też być stabilizowany przez ligandy organiczne w związkach koordynacyjnych.
Złoto
Złoto jest miękkim, jasnożółtym metalem przejściowym. Niczym nie zanieczyszczone, jest najbardziej miękkie, kowalne i ciągliwe ze wszystkich metali. Bardzo łatwo rozbija się je na super cienkie metaliczne błony i można z niego formować bardzo cienkie druty. Udaje się osiągać błony o grubości 0,00001 cm, a około 30 g złota rozciągnięto w drut o długości około 100 km. Jest doskonałym przewodnikiem ciepła i elektryczności.
Metal ten jest praktycznie obojętny na działanie zwykłych substancji. Rozpuszcza się w wodzie królewskiej, w chlorkach, bromkach i niektórych jodkach. Tworzy związki na +2 i +3 stopniu utlenienia. Złoto występuje w naturze w postaci zarówno czystego metalu jak i związków. Najczęściej spotyka się je w osadach aluwialnych razem ze srebrem. Czasem tworzy z nim naturalny stop zwany elektrum. Złoto w związkach można spotkać w rudach telluru, ołowiu, antymonu, siarki i rtęci. Czasem, wraz ze srebrem, towarzyszy pirytom (siarczkom żelaza). Wody oceanów zawierają duże ilości rozrzedzonego złota (ok. 9 miliardów ton). Do nielicznych ród złota można zaliczyć kalaweryt AuTe2. Najprostszym i głównym sposobem pozyskiwania złota jest wypłukiwanie czystego metalu z osadów. Metoda ta sprawdza się z powodzeniem tak w przypadku zwykłej patelni poszukiwacza złota jak i potężnych nowoczesnych kopalń. Umiejętnie kierowana woda unosi ze sobą piasek i inny bezwartościowy materiał pozostawiając w zagłębieniach cięższe złoto. Inną metodą pozyskiwania tego pierwiastka ze złotonośnego materiału jest przepłukiwanie substancjami go rozpuszczającymi: rtęcią i cyjankami. Opłaca się wydobywać złoto gdy stosunek jego zawartości do zawartości bezwartościowego materiału wynosi 1÷300000. Wielką rzadkością są tzw. samorodki złota, będące bryłkami czystego metalu naturalnego pochodzenia. Największy znany samorodek tego metalu odkryto w okolicy miasta Victoria w Australii w 1869 roku. Leżał on tuż przy powierzchni i został przypadkowo odsłonięty przez koło wozu. Nazwano go "Mile widzianym przybyszem" (Welcome Stranger). Ważył podobno około 71 kg. Państwa będące liderami w produkcji złota to przede wszystkim RPA, USA, Rosja, Australia, Kanada, Chiny i Brazylia. Od czasów prehistorycznych złoto, z racji swego pięknego połysku, koloru, odporności chemicznej, było wartościowym metalem. Ważną cechą była względnie łatwa, w porównaniu do innych metali, obrabialność i łatwość oczyszczania. Względna rzadkość występowania złota spowodowała, że pierwiastek ten od tysiącleci jest podstawą pieniądza. Znaczne ilości stopów złota z innymi metalami wykorzystywane są w jubilerstwie i do produkcji monet (czyste złoto nie nadaje się do produkcji monet ze względu na miękkość). Zawartość kruszcu w takich stopach wyrażana jest w karatach. Karat ma dwie definicje. Pierwsza to jednostka wagi używana w jubilerstwie - równa 0,2 g; druga, to miara zawartości szlachetnego metalu w stopie. Mówiąc, że złoto jest np. dwudziestokaratowe mamy na myśli to, że w 24 jednostkach masy stopu zawartych jest 20 jednostek masy czystego złota. Tak zwany stop złota pierwszej próby ma 23 karaty. Drugiej próbie odpowiadają 18 karatów, a stop próby trzeciej jest stopem czternastokaratowym. Czyste złoto jest oczywiście dwudziestoczterokaratowe. Złoto używane do produkcji monet zawiera zwykle 10% srebra. Obecność innych metali zmienia nieznacznie barwę stopu: zielonkawą daje miedź i srebro zaś białe złoto otrzymuje się stapiając je z cynkiem, niklem lub platyną. Metal ten wykorzystuje się także do uzyskania specyficznych barwników. Rozdrobnione złoto daje szkłu czerwonawe zabarwienie.Złoto używane jest również w dentystyce oraz jako promieniotwórczy izotop, w medycynie, do leczenia raka (znacznik izotopowy).
Związki złota:
+1 stopień utlenienia
Związki złota na +1 stopniu utlenienia są mniej trwałe od połączeń na +3 stopniu utlenienia.
chlorek złota(I) – AuCl – powstaje jako produkt pośredni w procesie otrzymywania lub termicznego rozkładu chlorku złota(III). Jest związkiem trudno rozpuszczalnym w wodzie. W obecności wody ulega dysproporcjonacji
3AuCl → 2Au + AuCl3
jodek złota(I) – AuI – daje się otrzymać zarówno w wyniku bezpośredniej syntezy z pierwiastków jak i przez redukcję związków Au(III) jodkiem. Jest trudniej rozpuszczalny od chlorku i trudniej też ulega dysproporcjonacji. W temperaturze pokojowej ulega powolnemu rozkładowi na pierwiastki.
tlenek złota(I) – Au2O – nie jest znany, ale istnieje złocian(I) cezu CsAuO.
siarczek złota(I) – Au2S – powstaje w wyniku wprowadzenia siarkowodoru do roztworu K[Au(CN)2] w postaci trudno rozpuszczalnego osadu. W obecności siarczków litowców rozpuszcza się z utworzeniem tiozłocianów: MAuS
+3 stopień utlenienia
halogenki złota(III) – znane są halogenki oprócz jodku. Fluorek otrzymuje się w wyniku reakcji pomiędzy chlorkiem złota(III) i fluorem. Chlorek i bromek powstają w wyniku bezpośredniej syntezy z pierwiastków w temperaturach 473K i 423K. Chlorek złota(III) rozpuszczony w wodzie tworzy [AuCl3(OH)]–. Halogenki złota(III) łatwo tworzą tetrahalogenowe aniony koordynacyjne. I tak tetrafluorozłociany(III) MIAuF4 otrzymuje się w wyniku fluorowania mieszaniny chlorków metali. Tetrachlorozłocian(III) i tetrabromozłocian(III) powstają w wyniku rozpuszczenia trójhalogenków w roztworze zawierającym odpowiedni halogenek. Bromek tworzy również związki typu: [AuBr5]2– i [AuBr6]3–. Chociaż nie istnieje trójjodek złota(III) to znane są tetrajodozłociany(III) typu MIAuI4.
wodorotlenek złota(III) – Au(OH)3 – po dodaniu wodorotlenku litowca do roztworu [AuCl4]– strąca się żółtobrunatny wodorotlenek, który można odwodnić przy użyciu tlenku fosforu(V) poprzez AuO(OH) do tlenku złota(III) Au2O3. Tlenek ten jest nietrwały termicznie i już w temperaturach powyżej 423K rozkłada się na pierwiastki. Wodorotlenek rozpuszcza się w nadmiarze ługu prawdopodobnie z utworzeniem [Au(OH)4]–. Z roztworu można wydzielić złociany(III) typu; MIAuO2 i M3IAuO3.