 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
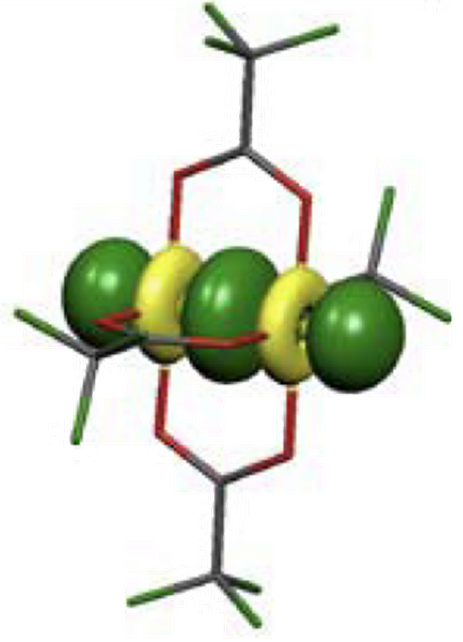 Wiązania metal–metal w związkach koordynacyjnych
Wiązania metal–metal w związkach koordynacyjnych
Wiązania występujące w metalach zostały opisane w części dotyczącej wiązań chemicznych. W tym miejscu zajmiemy się wiązaniami kowalencyjnymi metal–metal jakie powstają w związkach koordynacyjnych.
W chemii organicznej pomiędzy atomami węgla możemy wyróżnić trzy rodzaje wiązań: pojedyncze σ, podwójne σ i π oraz potrójne σ i dwa π. W przypadku dwujądrowych związków koordynacyjnych, gdzie możemy spodziewać się wystąpienia wiązania metal–metal, należy uwzględnić obecność orbitali d, co prowadzi do pojawienia się nowego typu wiązania. Rozpatrzmy więc wzajemne nakładanie orbitali d dwóch atomów centralnych na początek pomijając wpływ ligandów. Oczywiście, wzajemne oddziaływanie dwóch orbitali atomowych prowadzi do pojawienia się cząsteczkowego orbitalu wiążącego i antywiążącego.
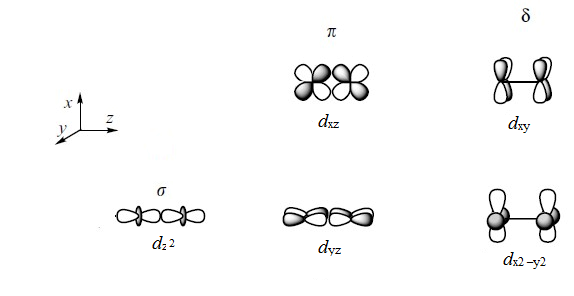
Wiązanie σ tworzy się w wyniku oddziaływania orbitali dz2 natomiast dwa wiązania π powstają przez kombinację orbitali dxz i dyz. Pojawia się trzeci typ wiązania, wiązanie δ, posiadające dwie płaszczyzny węzłowe, powstające w wyniku kombinacji orbitali dxy oraz dx2-y2. Biorąc pod uwagę wielkości nakładania poszczególnych orbitali można stwierdzić, ze najsilniejszym jest wiązanie σ, potem π, a wiązanie typu δ jest najsłabsze. Szacunkowo wartość całki nakładania dla tego wiązania wynosi około ¼ wartości dla wiązania π.
W związku z tym możemy skonstruować diagram orbitali cząsteczkowych dla dwujądrowego związku koordynacyjnego typu [M2L10], dla każdego jądra koordynującego ligandy [ML5] rozpatrując cztery najniżej energetyczne orbitale d. Ponieważ poziom t2g (orbitale dxz, dxy, dyz) jest potrójnie zdegenerowany to kolejność orbitali π i δ jest niejednoznaczna. Dodatkowo trudno też jednoznacznie określić położenie orbitalu σ; jego lokalizacja pomiędzy orbitalami π i δ wynika z założenia stosunkowo niedużej różnicy e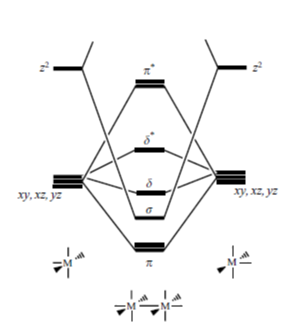 nergii pomiędzy orbitalami obydwu fragmentów [ML5].
nergii pomiędzy orbitalami obydwu fragmentów [ML5].
Kolejnym zagadnieniem jest liczba i rodzaj wiązań występujących pomiędzy atomami centralnymi, które są uzależnione od konfiguracji atomów centralnych. Jako przykład weźmy karbonylek renu(0) – [Re2(CO)10] – w którym atom centralny fragmentu [Re(CO)5] ma konfigurację d 7. W związku z tym 14 elektronów uzyskuje konfigurację: (π)4(σ)2(δ)2(δ*)2(π*)4 czyli wiązania p i d w tym układzie nie występują (zerowy rząd wiązań) i pomiędzy atomami centralnymi Re–Re istnieje pojedyncze wiązanie typu σ. Jednocześnie jasno widać, że aby zwiększył się rząd wiązania, a co za tym idzie pojawiły się wiązania π i δ liczba elektronów d atomów centralnych musi być mniejsza. Sytuacja taka pojawia się w przypadku [Re2Cl8(H2O)2]2-, gdzie ren na +3 stopniu utlenienia ma konfiguracje d 4. W tym wypadku obsadzenie orbitali cząsteczkowych dimeru przyjmuje postać (π)4(σ)2(δ)2; pojawienie się wiązań π i δ przejawia się w skróceniu odległości pomiędzy atomami renu, która to odległość w przypadku dodekakarbonylku wynosi 3.04 Å, a [Re2Cl8(H2O)2]2- tylko 2.22 Å.
Istnienie wiązań poczwórnych w związkach koordynacyjnych po raz pierwszy zostało zaproponowane w roku 1965 przez Cottona w celu wyjaśnienia właściwości [Re2Cl8]2-. Odległość pomiędzy centrami metalicznymi w tym anionie wynosi 2.24 Å, czyli jest bardzo bliska tej wyznaczonej dla podanego powyżej [Re2Cl8(H2O)2]2-. Rozpatrując związek chlorkowy możemy założyć dwie prawdopodobne konformacje:
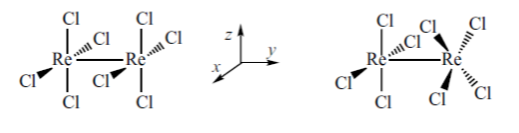 naprzeciwległą i naprzemianległą. Układ ten możemy rozbić na dwa fragmenty typu [ReCl4]- o geometrii płaskiego kwadratu. W takim wypadku orbital σ będzie niżej energetyczny niż orbital π w konfiguracji podanej powyżej dla związku z wiązaniami metal-metal (orbital dz2 przy geometrii płaskiego kwadratu jest niewiążący). Podobnie jak wyżej, ren ma konfigurację elektronową d 4, a związek w stanie podstawowym posiada konfigurację (σ)2(π)4(δ)2. Tak wygląda sytuacja dla konformacji naprzeciwległej. W przypadku konformacji naprzemianległej, w której jeden fragment jest obrócony w stosunku do drugiego o kat 45o wzdłuż osi z, pojawia się znacząca różnica w oddziaływaniu odpowiedzialnym za powstawanie wiązania δ. Otóż orbitale dxy i dx2-y2 obydwu fragmentów mają inną symetrię przez co ich nakładanie zostaje ograniczone i pojawia się poziom niewiążący obejmujący dwa orbitale d.
naprzeciwległą i naprzemianległą. Układ ten możemy rozbić na dwa fragmenty typu [ReCl4]- o geometrii płaskiego kwadratu. W takim wypadku orbital σ będzie niżej energetyczny niż orbital π w konfiguracji podanej powyżej dla związku z wiązaniami metal-metal (orbital dz2 przy geometrii płaskiego kwadratu jest niewiążący). Podobnie jak wyżej, ren ma konfigurację elektronową d 4, a związek w stanie podstawowym posiada konfigurację (σ)2(π)4(δ)2. Tak wygląda sytuacja dla konformacji naprzeciwległej. W przypadku konformacji naprzemianległej, w której jeden fragment jest obrócony w stosunku do drugiego o kat 45o wzdłuż osi z, pojawia się znacząca różnica w oddziaływaniu odpowiedzialnym za powstawanie wiązania δ. Otóż orbitale dxy i dx2-y2 obydwu fragmentów mają inną symetrię przez co ich nakładanie zostaje ograniczone i pojawia się poziom niewiążący obejmujący dwa orbitale d.
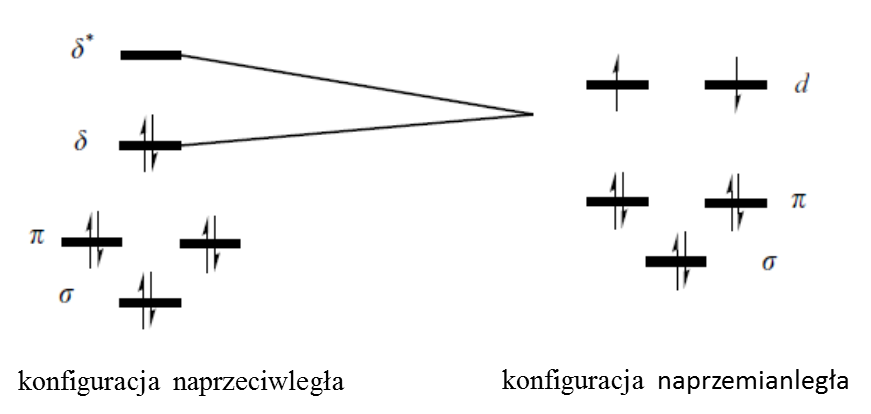
Powoduje to również pojawienie się dwóch niesparowanych elektronów, co musiałoby skutkować paramagnetyzmem rozpatrywanego związku koordynacyjnego. Jednak [ReCl4]- jest diamagnetyczny, więc związek w stanie podstawowym występuje w konformacji naprzeciwległej. Jednak wzbudzenie elektronowe w tym układzie łączy się ze zmianą konformacji z naprzeciwległej do naprzemianległej, gdyż w pierwszym stanie tripletowym wiązanie poczwórne przestaje istnieć.