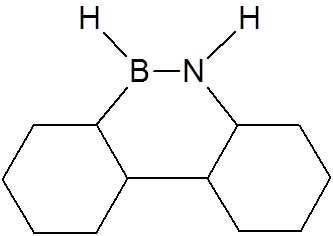Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
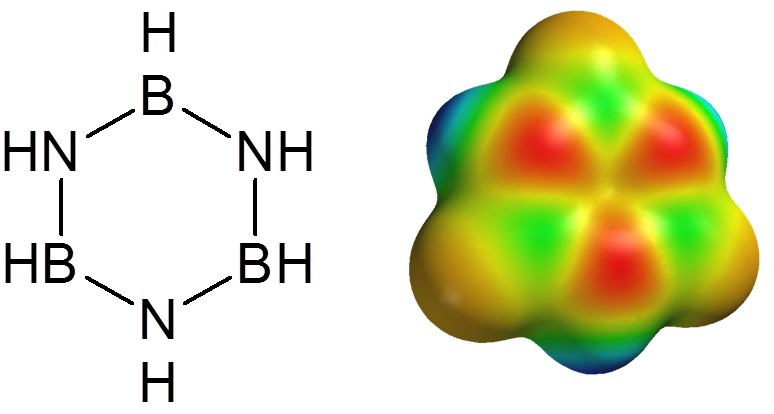 Nieorganiczne związki pierścieniowe
Nieorganiczne związki pierścieniowe
Borazol
W cząsteczce borazolu (borazyny) atomy boru można traktować jako zhybrydyzowane trygonalnie – sp2 – a wtedy każdy z atomów azotu dostarcza dwóch elektronów na pusty orbital π, przez co cząsteczka związku jest izoelektronowa z benzenem, a wiązania B–N ma w pewnym stopniu charakter wiązania podwójnego.
Stwierdzenie, że atom boru połączony z atomem azotu może zastąpić dwa wiązania sprzężone w układach aromatycznych doprowadziło do otrzymania nowej grupy heteroaromatycznych związków chemicznych. Przykładem może być analog fenantrenu.
Fosfazeny
Poza borazolem w chemii nieorganicznej znanych jest szereg układów pierścieniowych. W niektórych z nich występują zasadniczo wiązania π ale 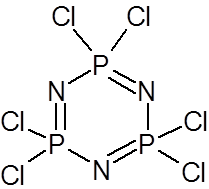 pewną rolę odgrywają orbitale d pierwiastków. Najbardziej typowymi przykładami tej grupy związków są fosfazeny, których przedstawicielem jest związek będący zasadniczo cyklicznym, płaskim trimerem złożonym z jednostek PCl2N. Podobną budowę mają pochodne bromowe i fluorowe.
pewną rolę odgrywają orbitale d pierwiastków. Najbardziej typowymi przykładami tej grupy związków są fosfazeny, których przedstawicielem jest związek będący zasadniczo cyklicznym, płaskim trimerem złożonym z jednostek PCl2N. Podobną budowę mają pochodne bromowe i fluorowe.
Podobne układy cykliczne tworzy siarka, przy czym poza trimerami znane są też tetrametry. Przy czym tetrametry nie mają płaskiej budowy a raczej występują w dwóch konformacjach typu łódki lub korony. W związkach tych oprócz fluorowca może występować grupa aminowa lub metylowa.
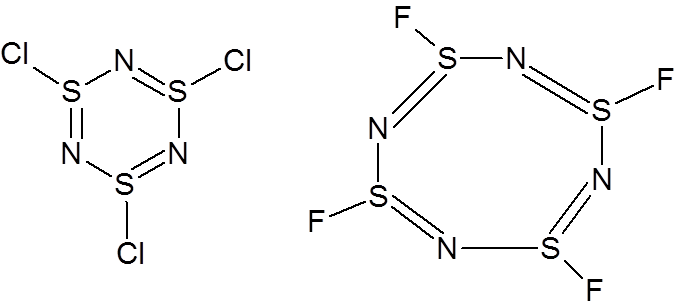 We wszystkich tych związkach pojawia się problem rozmieszczenia wiązań podwójnych. Ponieważ nie ma jednego konkretnego rozmieszczenia tych wiązań to związki te są traktowane jako nieorganiczne związki aromatyczne, ale takie podejście jest błędne.
We wszystkich tych związkach pojawia się problem rozmieszczenia wiązań podwójnych. Ponieważ nie ma jednego konkretnego rozmieszczenia tych wiązań to związki te są traktowane jako nieorganiczne związki aromatyczne, ale takie podejście jest błędne.
Weźmy pod uwagę trimer fosfazeniu. Gdy utworzymy hybrydy sp3 z orbitali s i p fosforu otrzymamy standardowe wiązania σ tworzące połączenia P–Cl i P–N. Pozostaje jeszcze sześć elektronów pochodzących po jednym od każdego z atomów tworzących pierścień. Te elektrony możemy rozdysponować na orbitalach 2pπ azotu oraz pięciu orbitalach 3d fosforu. Odpowiednie orbitale d w równym stopniu będą nakładać się z orbitalami 2pπ azotu, co wskazuje na możliwość utworzenia zdelokalizowanych wiązań w cząsteczce. Natomiast pojawia się istotny czynnik jakim jest różnica w znakach różnych obszarów tych orbitali tak jak to pokazano na rysunku.
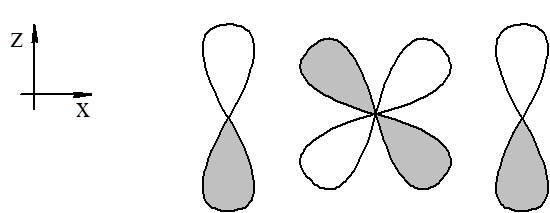 Ponieważ nakrywanie z jednym z orbitali p jest całkowicie dodatnie, a z drugim ujemne to tworzące się orbitale mają charakter wiążący w kierunku w którym nakrywanie jest dodatnie i antywiążący w kierunku gdzie nakrywanie jest ujemne. To powoduje, e dwie całki nakrywania odpowiadające kolejnym wiązaniom w cząsteczce muszą mieć różne znaki i w konsekwencji sprzężenie wiązań ulega naruszeniu. Inaczej mówiąc w pierścieniu fosfazenowym ładunek π rozpada się na trzy obszary obejmujące układ P–N–P
Ponieważ nakrywanie z jednym z orbitali p jest całkowicie dodatnie, a z drugim ujemne to tworzące się orbitale mają charakter wiążący w kierunku w którym nakrywanie jest dodatnie i antywiążący w kierunku gdzie nakrywanie jest ujemne. To powoduje, e dwie całki nakrywania odpowiadające kolejnym wiązaniom w cząsteczce muszą mieć różne znaki i w konsekwencji sprzężenie wiązań ulega naruszeniu. Inaczej mówiąc w pierścieniu fosfazenowym ładunek π rozpada się na trzy obszary obejmujące układ P–N–P