 Principles of Chemistry
Principles of Chemistry
- > Home
-
>
Historia chemii
- > Początki chemii
- > Rozwój alchemii
- > Jatrochemia
- > Badanie spalania i powietrza
- > Odkrycie i badanie gazów
- > Powstanie nowoczesnej chemii
- > Prawa chemiczne
- > Narodziny teorii atomowej
- > Elektrochemia
- > Berzelius, Hisinger, Faraday
- > Początki chemii organicznej
- > Substytucja
- > Wartościowość
- > Chemia fizyczna
- > Rozwój chemii nieorganicznej
- > Struktura atomu
-
>
Pierwiastki
- > Starożytność
- > Średniowiecze
- > Powietrze i woda
- > Analiza chemiczna
- > Halogeny
- > Elektrochemia
- > Metody spektroskopowe
- > Pierwiastki ziem rzadkich
- > Gazy szlachetne
- > Pierwiastki radioaktywne
- > Szeregi pierwiastków promieniotwórczych
- > Pierwiastki otrzymane sztucznie
- > Pierwiastki transuranowe
- > Podsumowanie
- > Układ okresowy
-
>
Mechanika falowa
- > Podstawy teoretyczne
- > Moment pędu
- > Równanie Schrodingera
- > Oscylator liniowy
- > Pole o symetrii sferycznej i pole kulombowskie
- > Spin
- > Identyczność cząstek
- > Oddziaływanie wymienne
- > Druga kwantyzacja
- > Poziomy energetyczne atomów
- > Układ okresowy
- > Atom w polu elektrycznym
- > Atom w polu magnetycznym
- > Cząsteczka dwuatomowa
- > Orto- i parawodór
- > Teoria relatywistyczna
- > Kwantowanie pola elektromagnetycznego
- > Fotony
- > Równanie Diraca
- > Cząstki i antycząstki
- > Atom i cząsteczka
-
>
Związki metali przejściowych
- > Powłoka walencyjna metali przejściowych
- > Efekt Jahna-Tellera
- > Teoria pola krystalicznego
- > Teoria pola ligandów
- > Widma elektronowe
- > Wiązania metal-metal
- > Własności magnetyczne
- > Trwałość związków koordynacyjnych
- > Związki z ligandami π–akceptorowymi
- > Arenowe związki koordynacyjne
- > Oddziaływania agostyczne
- > Wiązania chemiczne
- > Pojęcia chemii nieorganicznej
- > Mechanizmy reakcji
- > Oddziaływania międzycząsteczkowe
- > Elementy fizyki
- > Chemia organiczna
 Wodór
Wodór
Atom wodoru mając jeden elektron tworzy cząsteczki H2, o konfiguracji w stanie podstawowym 1σ2.Znamy trzy główne izotopy prot, którego jądro stanowi proton, deuter – z jądrem zbudowanym, z protonu i neutronu oraz tryt, którego jądro zawiera poza protonem dwa neutrony. Wszystkie izotopy wodoru tworzą cząsteczki dwuatomowe, a ponadto mogą występować cząsteczki typu HD, HT i DT. Deuter jest stabilnym, nieradioaktywnym izotopem wodoru, nazywanym ciężkim wodorem. W naturalnym wodorze jego ilość sięga 0,02%. D2O różni się pod względem właściwości fizykochemicznych od zwykłej wody. Jej temperatura wrzenia wynosi 101,42oC, a zamarzania 3,81oC. Gęstość wody ciężkiej jest o około 0,1% większa od wody zwykłej. Deuter został po raz pierwszy odkryty przez zespół uczonych amerykańskich pod kierunkiem Harolda Urey`a w 1932 roku. Deuter był pierwszym w historii badań izotopem, który udało się wyizolować w czystej postaci. Jądra deuteru są często wykorzystywane w fizyce atomowej do bombardowania atomów innych pierwiastków w celu badania ich promieniotwórczej przemiany. Ponadto stosuje się go jako substancję do oznaczania (badania) metabolizmu w biologii. W czasie drugiej wojny światowej ciężkiej wody używano jako moderatora w pierwszych stosach atomowych. Jest on też głównym składnikiem, obok trytu, bomby wodorowej. Tryt jest radioaktywnym, nietrwałym izotopem wodoru. Ulega samorzutnej przemianie promieniotwórczej, której produktem są atomy helu. Połowiczny czas rozpadu wynosi około 12,26 roku. Wytwarza się go sztucznie w wyniku przemian jądrowych. W warunkach naturalnych niewielkie ilości powstają w górnych warstwach atmosfery jako produkt bombardowania atmosfery neutronami. Izotop ten wykorzystuje się przy produkcji bomb wodorowych oraz jako znacznik w naukach biologicznych.
Cząsteczki wodoru charakteryzuje wysoka trwałość i niska polaryzowalność, niewielki rozmiar, mała masa, a w związku z tym wysoka ruchliwość. Temperatura topnienia wodoru jest niska i wynosi −259,198 °C, a temperatura wrzenia to −252,762 °C. Wodór wykazuje niską rozpuszczalność tak w wodzie jak i w rozpuszczalnikach organicznych. W stanie stałym tworzy cząsteczkową sieć heksagonalną. Skraplanie wodoru prowadzi się metodą ekspansyjną oziębiając początkowo do –70°C. Powyżej tej temperatury wodór wykazuje ujemny efekt Joule’a–Thomsona, czyli gaz rozgrzewa się podczas rozszerzania. Prace nad skropleniem wodoru prowadzili Wróblewski i Olszewski w latach osiemdziesiątych dziewiętnastego wieku oraz Dewar pod koniec XIX wieku. Wodór w stanie cząsteczkowym występuje w dwóch odmianach jako para– i ortowodór, które zostały opisane w części dotyczącej mechaniki kwantowej. Ze względu na wysoką energię dysocjacji (435 kJ/mol) rozpad cząsteczek wodoru na atomy zachodzi dopiero w temperaturach powyżej 2000°C. Pod ciśnieniem rzędu 202650 MPa wodór przechodzi (obliczenia teoretyczne) w stan metaliczny, w którym wykazuje właściwości nadprzewodzące.
W warunkach normalnych wodór cząsteczkowy jest stosunkowo mało aktywny, reagując bezpośrednio jedynie z fluorem. W podwyższonych temperaturach reaguje z licznymi niemetalami oraz aktywnymi metalami jak przykładowo:
2Na + H2 → 2NaH
W temperaturze pokojowej wodór cząsteczkowy może być aktywowany przez sole i związki koordynacyjne pierwiastków d-elektronowych. W procesie aktywacji wyróżnia się trzy główne mechanizmy:
a) w obecności substancji trzeciej cząsteczka wodoru ulega homolitycznemu rozpadowi z utworzeniem wodorku, który ulega dalszej przemianie;
b) następuje heterolityczny rozpad cząsteczki H2 z utworzeniem diwodorku typu MH2;
c) następuje rozpad heterolityczny z utworzeniem wodorku i jonu H+.
Wodór w warunkach laboratoryjnych otrzymuje się:
a) w reakcjach pomiędzy wodą i aktywnymi metalami:
2Na + 2H2O → 2NaOH + H2
b) działając kwasami na niektóre metale
Zn + 2HCl → ZnCl2 + H2
c) w wyniku elektrolitycznego rozkładu wody.
Techniczne metody uzyskiwania wodoru polegają na działaniu parą wodną na koks i następnie konwersji gazu wodnego, w której mieszanina CO i wodoru jest przekształcana na katalizatorach chromowo-żelazowych do mieszaniny dwutlenku węgla i wodoru. Druga metoda wykorzystuje gaz ziemny. Tutaj na katalizatorze niklowym w reakcji pomiędzy metanem i wodą tworzy się mieszanina dwutlenku węgla i wodoru.
CH4 + H2O → CO + H2
CH4 +2H2O → CO2 + H2
CO + H2O → CO2 + H2
Związki wodoru na –1 stopniu utlenienia
W zależności od charakteru pierwiastka związanego z wodorem atomy H mogą być spolaryzowane dodatnio (+1) lub ujemnie. Związki wodoru nazwę wodorków i można je podzielić na trzy grupy:
- LiH i wodorki pozostałych litowców, BeH2 oraz wodorki pozostałych berylowców, B2H6 i wodorki pozostałych borowców – w tej grupie wodór występuje na –1 stopniu utlenienia
- połączenia wodoru z tlenowcami (do fosforu) i fluorowcami – w tych związkach wodór występuje na +1 stopniu utlenienia
- wodorki pośrednie – do tej grupy zaliczamy połączenia wodoru z węglem, krzemem , cyną, arsenem (AsH3) i antymonem (SbH3). W tych związkach ładunek na atomie wodoru w cząsteczce jest niski a związki są słabo polarne.
Gdy wodór występuje jako utleniacz tworzy związki, w których uzyskuje formalny –1 stopień utlenienia. Jednak uzyskanie jonu H– z cząsteczki H2 jest procesem silnie endotermicznym z wartością entalpii tworzenia Δ°298 = +149,5 kJ/mol. Wyraźnie jonowy charakter wykazują jedynie wodorki silnie elektrododatnich metali jak KH czy CaH2.Wodorki jonowe są trudnotopliwymi ciałami stałymi. W stanie stopionym przewodzą prąd elektryczny, a ich elektroliza prowadzi do wydzielenia na anodzie H2.Wodorki jonowe mają charakter zasadowy. Kwaśny charakter posiadają wodorki kowalencyjne jak SiH4 czy B2H6. Wodorki ulegają nieodwracalnej hydrolizie z wydzieleniem wodoru cząsteczkowego. Kwaśne i zasadowe wodorki reagują ze sobą, co przykładowo można przedstawić równaniem reakcji:
LiH + BH3 → LiBH4
Do wodorów amfoterycznych należy wodorek glinu AlH3, który w zależności od reagenta zachowuje się jak donor lub akceptor pary elektronowej:
AlH3 + 3BH3 → Al(BH4)3 (zasadowy charakter wodorku glinu)
AlH3 + KH → K[AlH4] (kwaśny charakter wodorku glinu)
Potencjał standardowy układu ½H2/H– wynosi E° = –2,23 V, co pokazuje, że jon H– jest jednym z silniejszych reduktorów.
Związki wodoru na +1 stopniu utlenienia
Na +1 stopniu utlenienia wodór tworzy liczne związki, które występują w stanach skupienia gazowym,. ciekłym i stałym. Właściwości chemiczne tych związków są uzależnione od natury pierwiastka, z którym bezpośrednio związany jest wodór. Ze względu na tworzenie wiązań wodorowych HF, H2O i NH3 wykazują anomalnie wysokie temperatury wrzenia. Dodatkowo zdolność do tworzenia wiązań wodorowych jak również właściwości akceptorowo-donorowe związki te w stanie ciekłym są dobrymi rozpuszczalnikami jonizującymi substancje rozpuszczane.
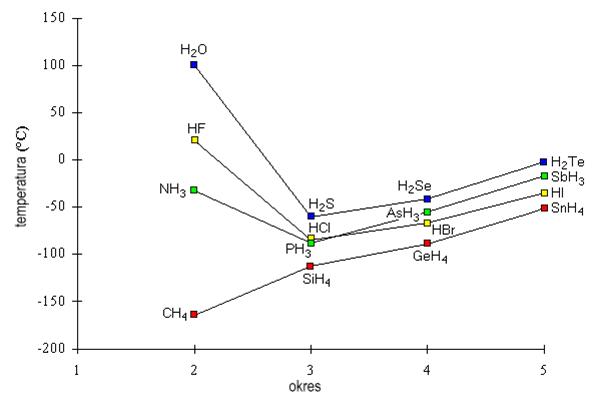 Tendencja do tworzenia związków anionowych realizuje się na przykład w reakcji:
Tendencja do tworzenia związków anionowych realizuje się na przykład w reakcji:
KF + HF → K[HF2]
Związki wodoru z wiązaniem metalicznym
Właściwości metaliczne wykazują związki wodoru z pierwiastkami d– i f–elektronowymi. Wodorki tych metali otrzymuje się w postaci ciemnych proszków lub kruchych mas. Charakteryzują się one przewodnictwem elektrycznym i cieplnym odpowiadającym wartościom charakterystycznym da metali. W większości przypadków mają one skład niestechiometryczny. Charakter wiązań w tych związkach nie jest do końca jasny. Zgodnie z jedną z teorii atom wodoru oddaje swój elektron do pasma przewodnictwo kryształu metalu i występuje jako kation H+. Druga teoria opiera się na przyłączaniu elektronu z pasma przewodnictwa przez atom wodoru, który tym samym staje się anionem H–. Wodorki metali otrzymuje się w reakcjach bezpośredniej syntezy z substancji prostych, czemu towarzyszy silny efekt egzotermiczny. W reakcjach tego typu następuje obniżenie entropii gdyż po stronie substratów mamy ciało stałe i gaz , a po stronie produktów ciało stałe. W związku z tym bezpośrednia reakcja pomiędzy substancjami prostymi jest możliwa jedynie wtedy gdy towarzyszy jej wydzielanie dużych ilości ciepła.
| Konfiguracja elektronowa | 1 s1 | |
| Masa atomowa | 1,0079 | |
| Gęstość [kg×m3] | 0.09 (273K) | |
| Główny stopień utlenienia | +1 (0; -1) | |
| Izotopy: | masa - zawartość – okres półrozpadu | |
| prot 11H deuter 21D tryt 31T |
1.008 - 99.99% - stabilny 2.014 - 0.015% - 12.262 lat 0% |
|
| Temperatura topnienia | 13,95K (-259,20oC) | |
| Temperatura wrzenia | 20,38K (-252,77oC) | |
| Promień atomowy [pm] | 37 | |
| Promień jonowy H- [pm] | 208 | |
| Energia jonizacji [kJ·mol-1] H → H+ | 1312 | |
| Powinowactwo elektronowe [kJ×mol-1] | 69,5 | |
| Elektroujemność | 2,20 (Paulinga) 7,18 (absolutna) | |
| Energia wiązań kowalencyjnych [kJ·mol-1] | H - H H - F H - Cl H - Br H - I |
453.6 566 431 366 299 |